Содержание
- 2. План лекции: Использование ОВР в аналитической химии. Типы ОВР. Количественное описание ОВР. Константа равновесия ОВР. Устойчивость
- 3. Использование ОВР в аналитической химии При пробоподготовке для переведения в раствор пробы. Для разделения смеси ионов.
- 4. Например, при гипоксии (состояние кислородного голодания) происходит замедление транспорта Н+ и е – в дыхательной цепи
- 5. Типы ОВР 1. Межмолекулярные – изменяются степени окисления (С.О.) атомов элементов, входящих в состав разных веществ:
- 6. 2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
- 7. 3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О. Cl2
- 8. Количественное описание ОВР Например, чем сильнее основание, тем больше его сродство в протону. Также и сильный
- 9. Рассматривая ОВ пару в целом, можно записать схематичное уравнение реакции: Ox + nē = Red Равновесие
- 10. При температуре 298 К уравнение Нернста принимает вид:
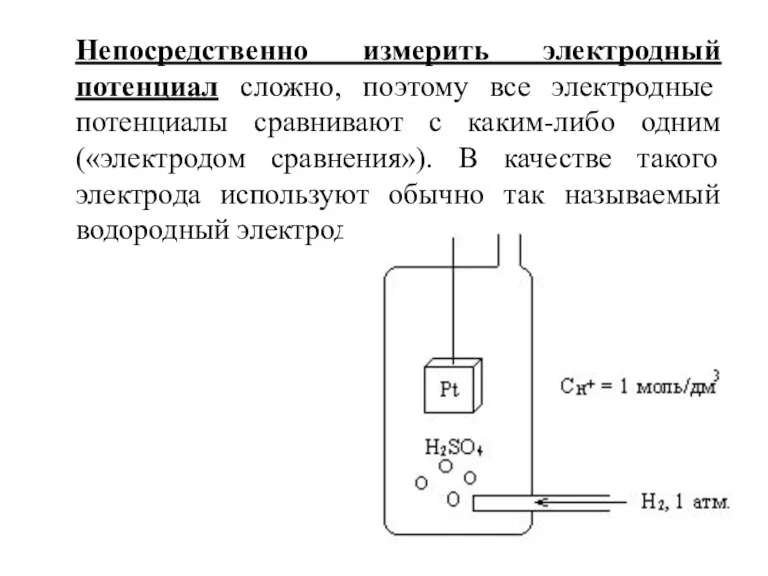
- 11. Непосредственно измерить электродный потенциал сложно, поэтому все электродные потенциалы сравнивают с каким-либо одним («электродом сравнения»). В
- 12. В уравнении Нернста можно использовать вместо активностей ионов их концентрации, но тогда необходимо знать коэффициенты активностей
- 13. На силу окислителя и восстановителя могут влиять: значение рН, реакции осаждения реакции комплексообразования. Тогда свойства редокс-пары
- 14. Для расчета реального потенциала полуреакций, получаемых сочетанием ОВР и реакций осаждения, используются формулы: ∙ если окисленная
- 15. ∙ если восстановленная форма представляет собой малорастворимое соединение:
- 16. Сочетание ОВР и реакций комплексообразования ∙ если окисленная форма связана в комплекс:
- 17. ∙ если восстановленная форма связана в комплекс:
- 18. ∙ если обе формы связаны в комплекс:
- 19. Сочетание ОВР и реакций протонирования если протонируется окисленная форма:
- 20. если протонируется восстановленная форма:
- 21. если протонируются обе формы:
- 22. если реакция протекает по следующему уравнению: Ox + mH+ + nē = Red + H2O тогда
- 23. Константа равновесия ОВР Расчет константы равновесия для реакции: Sn2+ + 2Fe3+ = Sn4+ + 2Fe2+ Константа
- 24. Выражения для реальных ОВ потенциалов каждой редокс-пары будут выглядеть следующим образом:
- 25. В условиях равновесия:
- 26. Проведя математические операции, получим: К = 1021
- 27. Используя приведенное вычисление константы равновесия, получим для любого обратимого ОВ процесса при 20 0С следующее уравнение:
- 28. Например, в цериметрии (окислитель Се4+): Fe2+ + Се4+ = Fe3+ + Се3+ К = 1011,4 =
- 30. Скачать презентацию















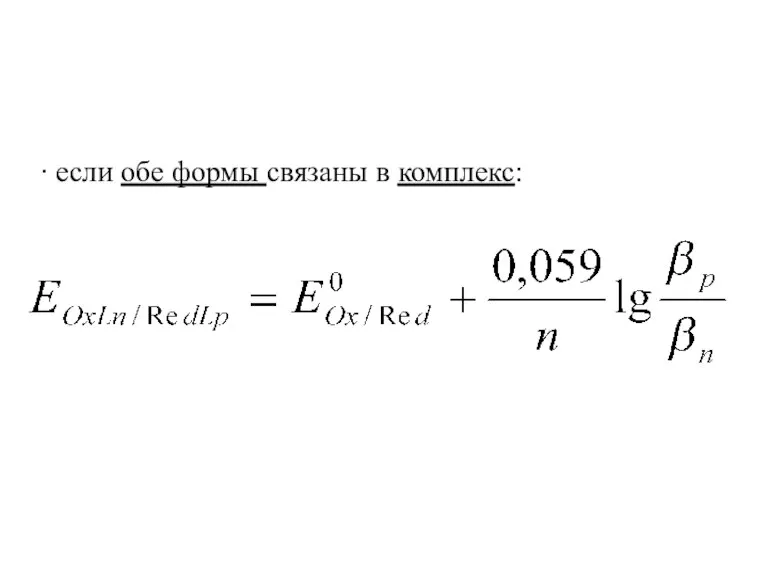










 Жизнь и творчество Даля
Жизнь и творчество Даля Условия осмотра труб при монтаже. Монтаж узлов
Условия осмотра труб при монтаже. Монтаж узлов INSTRUCTION DEFINITIONS
INSTRUCTION DEFINITIONS  Изучение инструктивно-методических материалов как одно из важнейших направлений деятельности ШМО
Изучение инструктивно-методических материалов как одно из важнейших направлений деятельности ШМО Современная банковская система Италии
Современная банковская система Италии Презентация на тему Город Владимир
Презентация на тему Город Владимир Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» БАСОВ ЯКОВ АЛЕКСАНДРОВИЧ
БАСОВ ЯКОВ АЛЕКСАНДРОВИЧ Презентация на тему Животные лесов Башкортостана
Презентация на тему Животные лесов Башкортостана  Ежедневный отдых. Активный отдых. Гигиена труда. Отдых в праздничные дни и во время каникул. Никитенко О.Д.
Ежедневный отдых. Активный отдых. Гигиена труда. Отдых в праздничные дни и во время каникул. Никитенко О.Д. 20170623_zhivi_rodnaya_rechushka
20170623_zhivi_rodnaya_rechushka "РАССЛЕДОВАНИЕ НЕСЧАСТНОГО СЛУЧАЯ"
"РАССЛЕДОВАНИЕ НЕСЧАСТНОГО СЛУЧАЯ" Famous People
Famous People Презентация к курсовой работе «Компетентностный подход к формированию и развитию творческого потенциала учащихся при преподава
Презентация к курсовой работе «Компетентностный подход к формированию и развитию творческого потенциала учащихся при преподава Today Learning language
Today Learning language Модели коммуникаций
Модели коммуникаций Феноменология. Философия психоанализа
Феноменология. Философия психоанализа 21 ФЕВРАЛЯ
21 ФЕВРАЛЯ Процесс совершенствования системы управления конфликтами в организации
Процесс совершенствования системы управления конфликтами в организации It’s good to be a child
It’s good to be a child Реконструкция компрессорного цеха №3 компрессорной станции №19
Реконструкция компрессорного цеха №3 компрессорной станции №19 Автоматизация проектирования ОТД
Автоматизация проектирования ОТД Студенчества прекрасная пора
Студенчества прекрасная пора Псевдонимы
Псевдонимы Форум лидеров бизнеса стран СНГ- проект Делового Центра экономического развития СНГ www.forum.bc-cis.ru Проект по состоянию на 21.12.2011г Секц
Форум лидеров бизнеса стран СНГ- проект Делового Центра экономического развития СНГ www.forum.bc-cis.ru Проект по состоянию на 21.12.2011г Секц Техника прыжка в длину с разбега
Техника прыжка в длину с разбега Принципы декомпозиции LBS услуг c целью расчёта стандартных параметров качества В.Н. Максименко - к.т.н., доцент, Директор аналитич
Принципы декомпозиции LBS услуг c целью расчёта стандартных параметров качества В.Н. Максименко - к.т.н., доцент, Директор аналитич Школьный праздник карнавал. Урок рисования
Школьный праздник карнавал. Урок рисования