Содержание
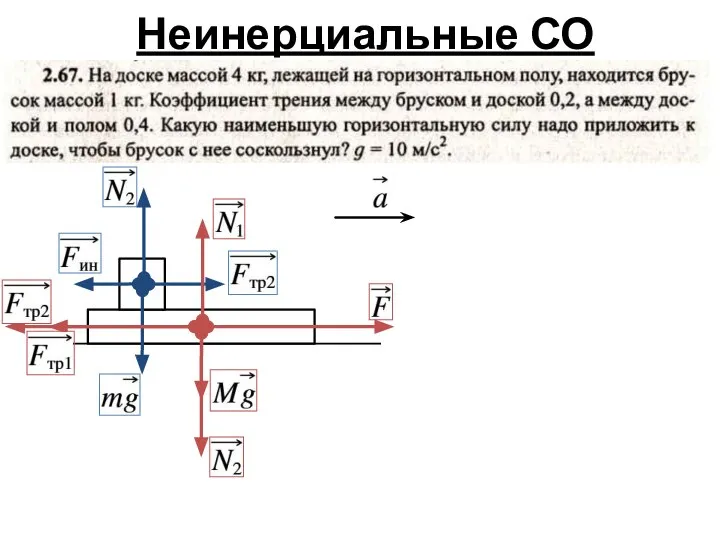
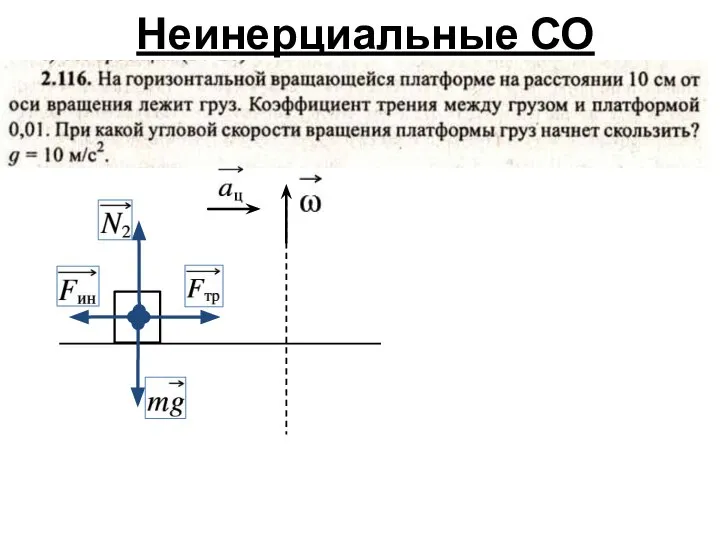
- 3. Неинерциальные СО
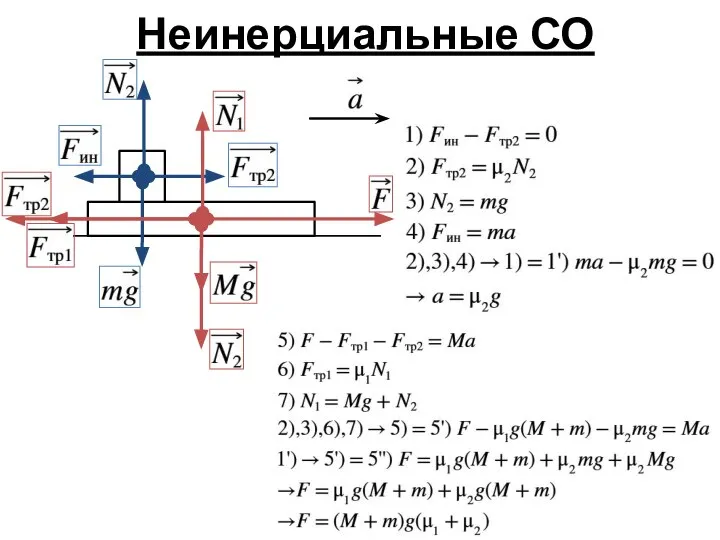
- 4. Неинерциальные СО
- 5. Неинерциальные СО
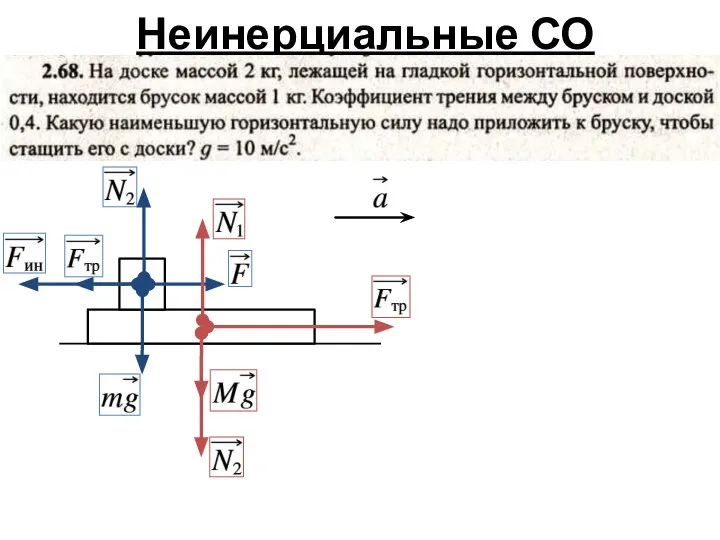
- 6. Неинерциальные СО
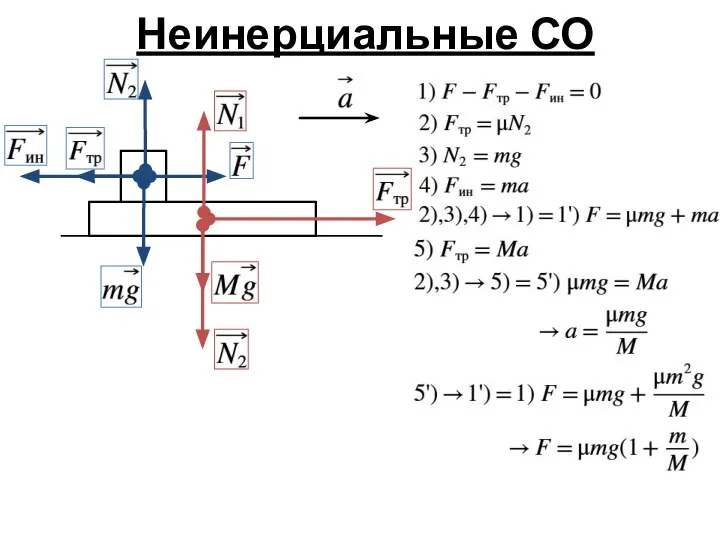
- 7. Неинерциальные СО
- 8. Неинерциальные СО
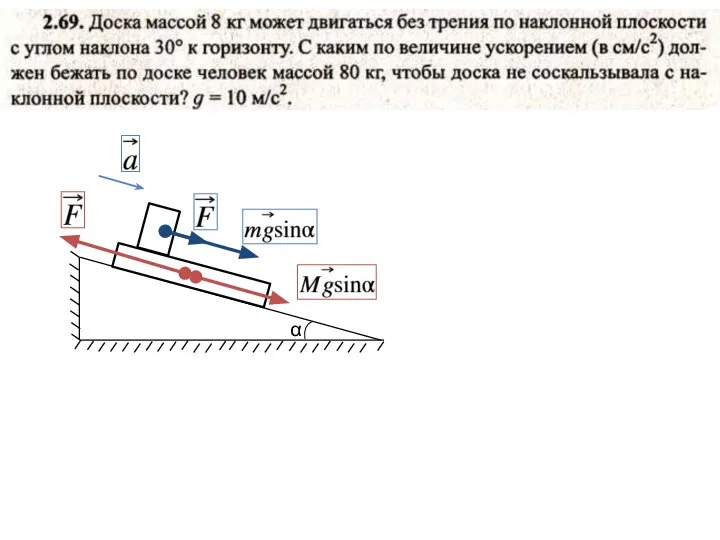
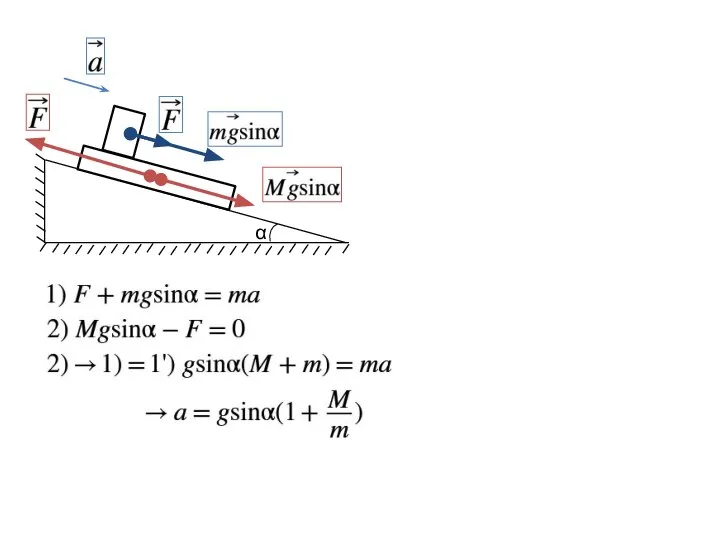
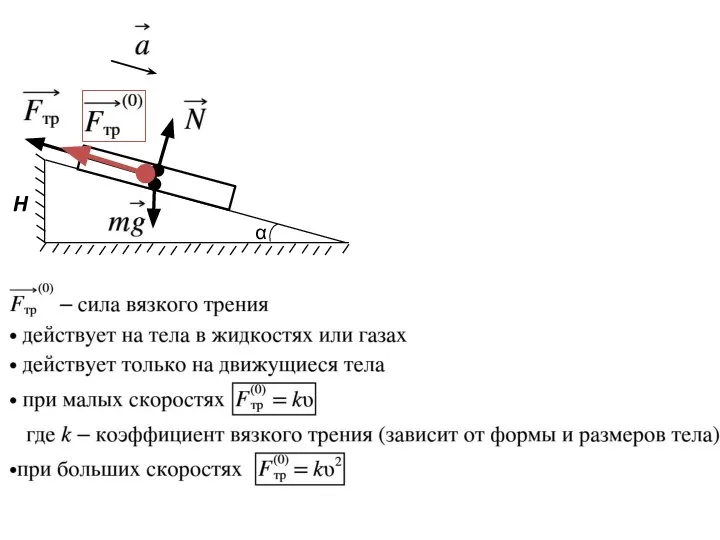
- 9. α
- 10. α
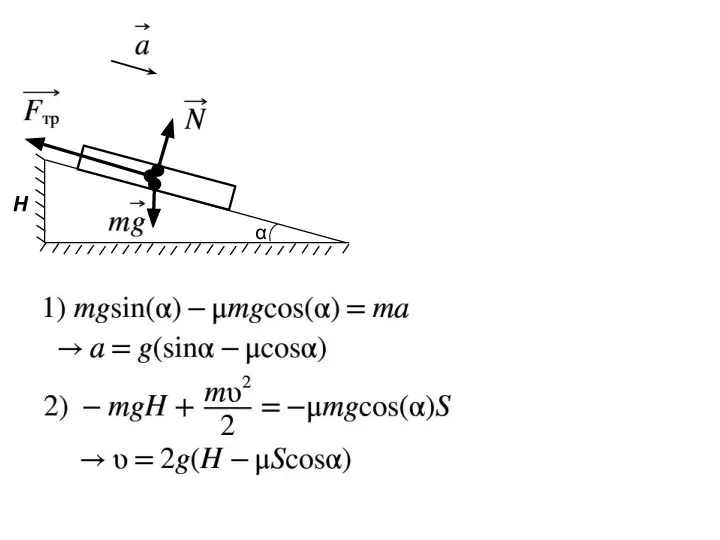
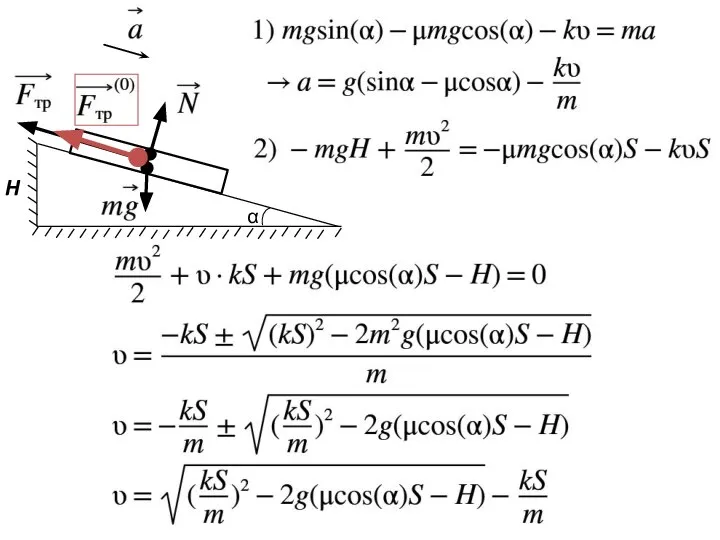
- 11. α H
- 12. α H
- 13. α H
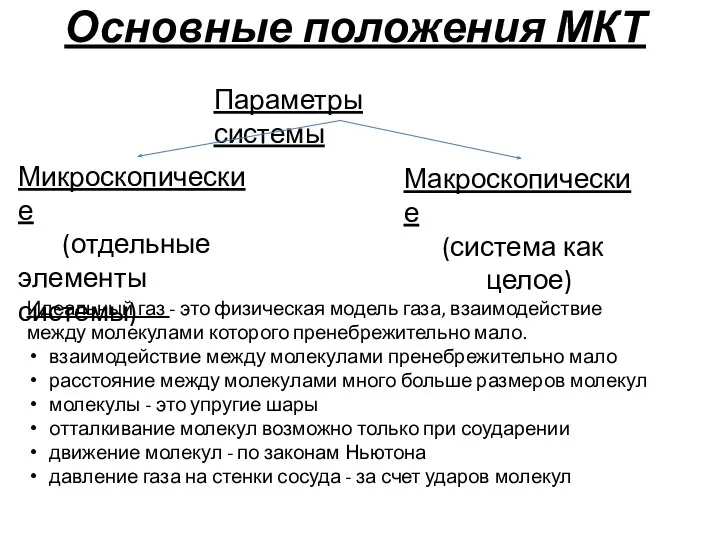
- 14. Основные положения МКТ Параметры системы Микроскопические (отдельные элементы системы) Макроскопические (система как целое) Идеальный газ -
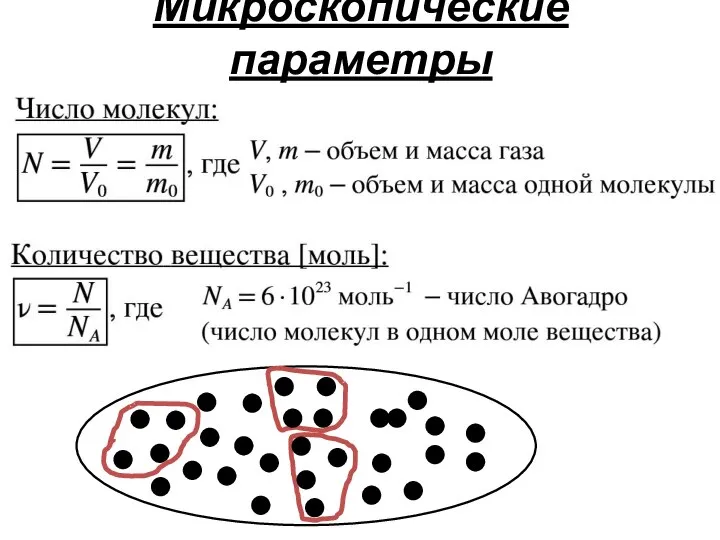
- 15. Микроскопические параметры
- 16. Микроскопические параметры
- 19. Связь микро- и макро- параметров
- 20. Макроскопические параметры
- 22. Закон Дальтона Давление смеси химически невзаимодействующих элементов равно сумме парциальных давлений Парциальное давление-давление, которое создавал бы
- 27. Фазовые превращения. Удельная темплоемкость вещества c – количество теплоты, которое надо сообщить телу массой 1 кг,
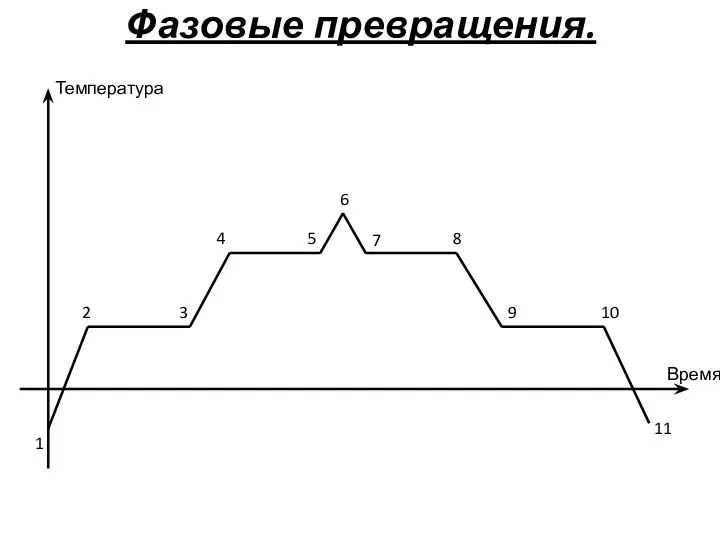
- 28. Фазовые превращения. Температура Время 1 2 3 4 5 6 7 8 9 10 11
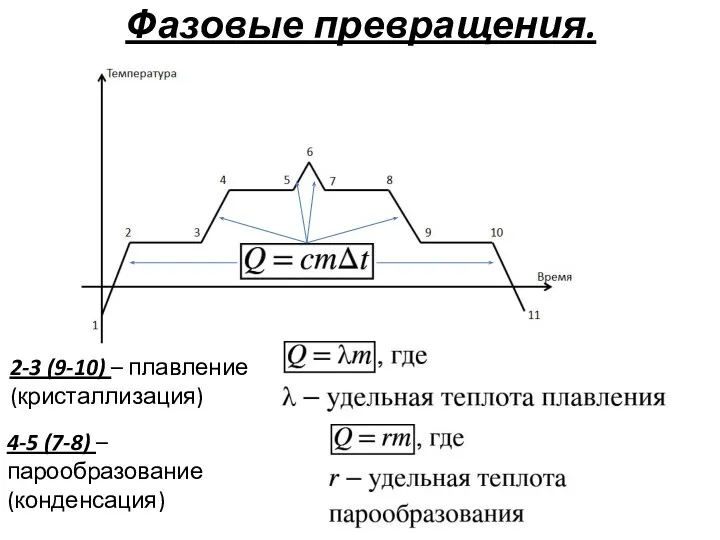
- 29. Фазовые превращения. 2-3 (9-10) – плавление (кристаллизация) 4-5 (7-8) – парообразование (конденсация)
- 30. Фазовые превращения. Количество теплоты, выделяющееся при сгорании топлива :
- 31. Фазовые превращения. Уравнение теплового баланса: В замкнутой системе тел алгебраическая сумма количеств теплоты, отданных и полученных
- 32. Фазовые превращения.
- 33. Фазовые превращения.
- 34. Фазовые превращения.
- 35. Термодинамика. Внутренняя энергия идеального одноатомного газа: Изменение внутренней энергии :
- 36. Термодинамика. *Если газ не одноатомный:
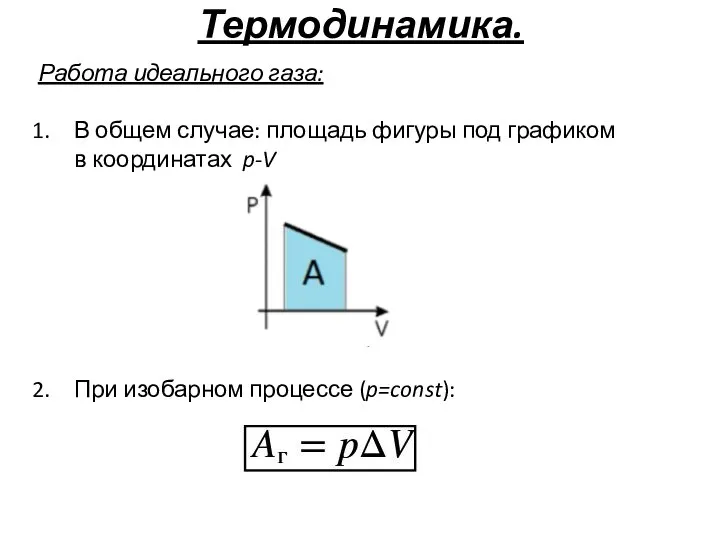
- 37. Термодинамика. Работа идеального газа: В общем случае: площадь фигуры под графиком в координатах p-V При изобарном
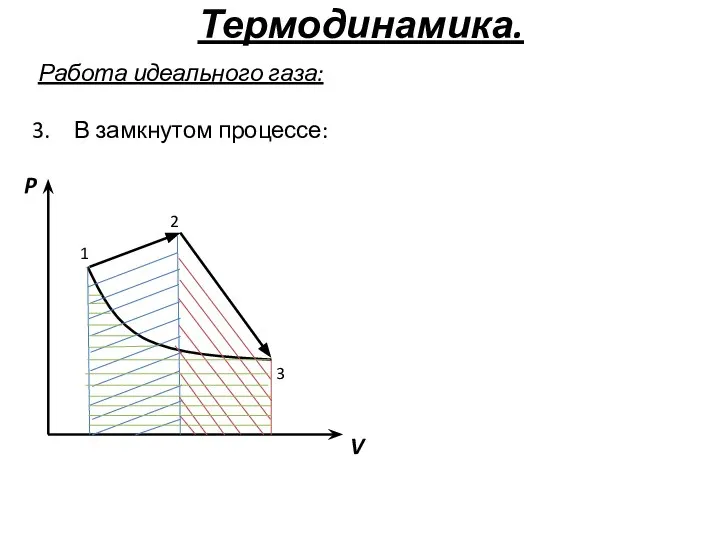
- 38. Термодинамика. Работа идеального газа: В замкнутом процессе: P V
- 39. Термодинамика. Первый закон термодинамики : Количество теплоты, сообщаемое газу, идет на совершение газом работы и изменение
- 40. Термодинамика. Изобарный процесс (p=const): Изохорный процесс (V=const): Изотермический процесс (T=const):
- 41. Термодинамика. Адиабатический процесс (Q=0):
- 47. Скачать презентацию




























 Проводники и диэлектрики в электрическом поле
Проводники и диэлектрики в электрическом поле Трансатлантический кабель
Трансатлантический кабель Кинематика точки
Кинематика точки Презентация по физике "Ядерная энергия" -
Презентация по физике "Ядерная энергия" -  Презентация на тему Физика как наука. Методы познания
Презентация на тему Физика как наука. Методы познания  Неразъемные соединения
Неразъемные соединения Тайны мыльных пузырей
Тайны мыльных пузырей Презентация на тему Короткое замыкание
Презентация на тему Короткое замыкание  ВКР: Розрахунок режимів роботи електричних мереж
ВКР: Розрахунок режимів роботи електричних мереж Звуковые волны. Распространение звука
Звуковые волны. Распространение звука Презентация на тему Расчет сопротивления проводников
Презентация на тему Расчет сопротивления проводников  Организация технического обслуживания и ремонта системы питания дизельного двигателя Mitsubishi L200
Организация технического обслуживания и ремонта системы питания дизельного двигателя Mitsubishi L200 Презентация на тему Магнитное поле и его графическое изображение
Презентация на тему Магнитное поле и его графическое изображение  Основные требования, предъявляемые к устройствам релейной защиты
Основные требования, предъявляемые к устройствам релейной защиты Антони ван Левенгук. Изобретатель микроскопа
Антони ван Левенгук. Изобретатель микроскопа Презентация на тему Задачи на движение
Презентация на тему Задачи на движение  Электрические свойства веществ - классификация
Электрические свойства веществ - классификация Принципы радиосвязи
Принципы радиосвязи Энергия (10 класс)
Энергия (10 класс) Механика многофазных сред
Механика многофазных сред Физика – одна из наук о природе
Физика – одна из наук о природе Закон Всемирного тяготения. Вес тела. Решение задач
Закон Всемирного тяготения. Вес тела. Решение задач Теория автоматического управления. Позиционные звенья
Теория автоматического управления. Позиционные звенья Технология ремонта резьбовых соединений
Технология ремонта резьбовых соединений Классификация подъёмников для автомобилей в СТО
Классификация подъёмников для автомобилей в СТО Лекция 1 Презентация Microsoft Office PowerPoint 2007
Лекция 1 Презентация Microsoft Office PowerPoint 2007 Путь от Солнца к сознанию. Базовые понятия
Путь от Солнца к сознанию. Базовые понятия Свободное падение
Свободное падение