Содержание
- 2. Алканы - Предельные углеводороды с общей формулой CnH2n+2
- 3. Особенности алканов: Все атомы углерода в sp-3 гибридном состоянии; Нет межклассовых изомеров; Нет качественных реакций; Не
- 4. Химические свойства алканов. Взаимодействие с галогенами: CH4+Cl2 CH3Cl+HCl Нитрование: CH4+HNO3 CH3NO2+H2O
- 5. Окисление. а) полное (горение): C4H10+13O2 8CO2+10H2O б) неполное: C2H5OH C2H6 CH3- C=О Н CH3-C=О ОН
- 6. Реакция изомеризации: CH3-CH2-CH2-CH3 CH3-CН-CH3 СН3 Разложение: СН4 С + 2Н2 2СН4 СН = СН +3Н2
- 7. Реакции отщепления:
- 8. Реакции, протекающие с разрывом связи С-С: а)Изомеризация (AlCl3, t) б)Крекинг (высокотемпературная переработка нефти и ее фракций
- 9. Реформинг – изменение формы (характерна для гексана и его гомологов при 500ºС, Al2O3, 40 атм): С6Н14
- 10. Получение алканов: В промышленности: а)Крекинг; б)Из синтез-газа: СО + Н2 = СН4 + Н2О (катализатор –
- 11. Получение алканов: В лаборатории: а) Синтез из простых веществ: С + Н2 = СН4; б) Гидролиз
- 12. г) Сплавление солей карбоновых кислот с щелочами (деркабоксилорование): CH3COONa + NaOH = CH4 + Na2CO3; д)
- 14. Скачать презентацию











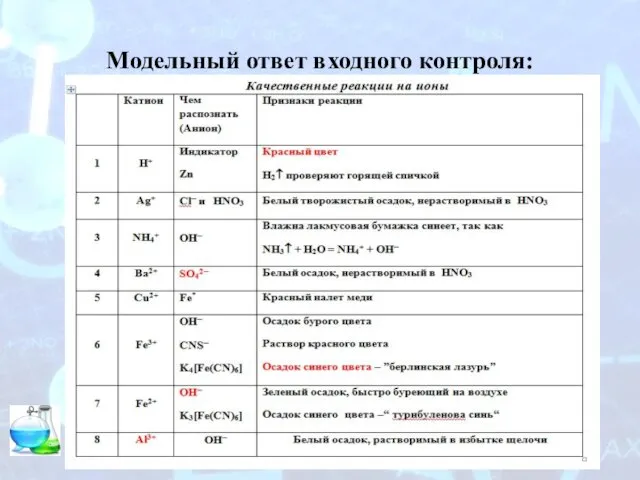 Модельный ответ входного контроля
Модельный ответ входного контроля Магний для растений
Магний для растений Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева
Современная теория строения атома. Периодический закон и периодическая система элементов Д.И. Менделеева Практическое занятие: Решение задач. Классификация химических реакций
Практическое занятие: Решение задач. Классификация химических реакций Алкадиены: кумулированные, сопряженные, изолированные
Алкадиены: кумулированные, сопряженные, изолированные История развития химии
История развития химии Железо - основа всего мира
Железо - основа всего мира Презентация на тему Теория электролитической диссоциации обобщающий урок
Презентация на тему Теория электролитической диссоциации обобщающий урок  Реакции ионного обмена составление ионных уравнений
Реакции ионного обмена составление ионных уравнений Использование разнообразных форм и методов обучения при подготовке учащихся к ЕГЭ по химии
Использование разнообразных форм и методов обучения при подготовке учащихся к ЕГЭ по химии Химия. Контроль знаний
Химия. Контроль знаний Valentnost
Valentnost Химические реакции в органике
Химические реакции в органике Химическая связь в органических соединениях
Химическая связь в органических соединениях Chem-квест. Химический диктант
Chem-квест. Химический диктант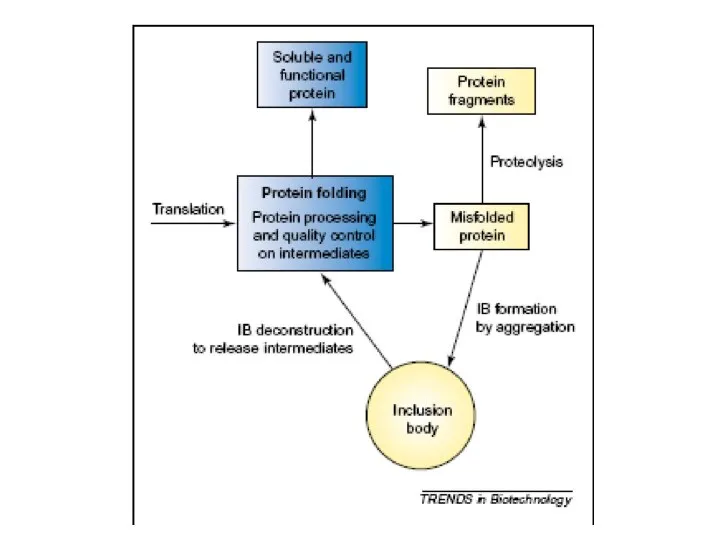 Рефолдинг миниантител
Рефолдинг миниантител Определение времени прохождения диффузии
Определение времени прохождения диффузии Гидролиз солей
Гидролиз солей Коррозия металлов
Коррозия металлов Электролитическая диссоциация
Электролитическая диссоциация Химические свойства алканов
Химические свойства алканов Степень окисления в соединениях
Степень окисления в соединениях Химическая промышленность
Химическая промышленность Хімічна промисловість
Хімічна промисловість Презентация на тему Влияние химических веществ на рост и развитие растений
Презентация на тему Влияние химических веществ на рост и развитие растений  Д-5 Альдегидтер
Д-5 Альдегидтер Оксиды
Оксиды Практическая работа по теме Получение и свойства соединений металлов
Практическая работа по теме Получение и свойства соединений металлов