Содержание
- 2. Арены – циклические углеводороды, содержащие фенильную группу в качестве функциональной и образующие гомологический ряд с общей
- 3. Пропаноил 1-пропаноил –3-этил-4-втор-пентилбензол 2. Рациональная Указание положения заместителей дается с помощью начальных букв соответствующих позиций взаимного
- 4. Тривиальная Названия собственные (Симм.) Диметилэтилбензол Рядовой триметилбензол м-Изопропилметилбензол Бензол Толуол о-Ксилол м-Ксилол п-Ксилол Мезитилен Кумол Цимол
- 5. Антрацен Фенантрен Фенален Ацефенантрилен Ацеантрилен Трифенилен Флуорен Аценафтилен Нафтацен Хризен Пицен
- 6. Физические свойства Ароматические соединения — твёрдые или жидкие вещества, отличающиеся от алифатических и алициклических аналогов высокими
- 7. Бензол и его простейшие гомологи в обычных условиях – токсичные жидкости с характерным запахом. Они плохо
- 8. 3 узловых поверхности 2 узловых поверхности 1 узловая поверхность Нет узловых поверхностей α+2β α+β α-β α-2β
- 9. Энергетический критерий ароматичности (по Хюккелю) Впервые подойти к проблеме ароматичности с т.з. теории МО удалось Хюккелю
- 10. Системы, для которых не выполняется хотя бы одно условие ароматичности относятся к НЕароматическим. Круг Фроста Для
- 11. Горизонтальная диагональ пересекает окружность в точках с энергией α, что отвечает несвязывающим орбиталям. Отнесение остальных точек
- 12. α+2β α-β α-β E = 2·(α+2β) = 2α+4β α Примеры: α+2β α-2β α α E =
- 13. Другие критерии ароматичности: Структурный – ароматические частицы планарны (плоские), циклические, сопряженные. Химический – ароматические соединения устойчивы
- 14. Методы получения Промышленные способы Коксование каменного угля и каменно-угольной смолы: 80-170 С – бензол, толуол, ксилолы,
- 15. 2. Лабораторные способы 1) Алкилирование по Фриделю-Крафтсу-Густавсону
- 17. Скачать презентацию














 Расстворение. Расстворы
Расстворение. Расстворы Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) Углеводы
Углеводы Своя игра. Химия и охрана почв
Своя игра. Химия и охрана почв Циклоалканы. Физические свойства
Циклоалканы. Физические свойства Вода… Химические названия
Вода… Химические названия Хим-1 презент
Хим-1 презент Физические и химические свойства алкенов
Физические и химические свойства алкенов Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА)
Вольтамперометрия. Полярография постоянного тока. Лекция 3 (ФХМА) Формулы оксидов
Формулы оксидов Конкурс проектных работ Химический элемент … – и это все о нем
Конкурс проектных работ Химический элемент … – и это все о нем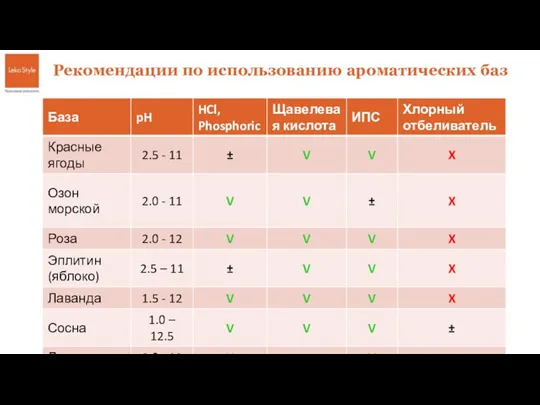 Базы для кислых и щелочных сред
Базы для кислых и щелочных сред Кремневая кислота и ее соли
Кремневая кислота и ее соли Презентация на тему Спирты 10 класс
Презентация на тему Спирты 10 класс  Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Контрольна робота, хімія
Контрольна робота, хімія Коррозия металлов и способы борьбы с ней
Коррозия металлов и способы борьбы с ней Мицеллобразование (2)
Мицеллобразование (2) Наблюдения в сходящемся свете. Коноскопия
Наблюдения в сходящемся свете. Коноскопия Основания. Структурная формула
Основания. Структурная формула Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Аммиа́к (нитрид водорода)
Аммиа́к (нитрид водорода) Устный журнал из истории развития химии
Устный журнал из истории развития химии Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Алканы. Циклоалканы
Алканы. Циклоалканы Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Реакции поликонденсации
Реакции поликонденсации Электролитическая диссоциация (9 класс)
Электролитическая диссоциация (9 класс)