Содержание
- 2. Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотного остатка HCl =
- 3. H3PO4 ⇆ H+ + H2PO4- 2) H2PO4- ⇆ H+ + HPO42- 3) HPO42- ⇆ H+ +
- 4. При диссоциации кислоты образуют катионы водорода Кислоты имеют кислый вкус Кислоты изменяют окраску индикаторов
- 5. Основания – это электролиты, при диссоциации которых образуются катионы металла и в качестве анионов гидроксид-ионы NaOH
- 6. Соли – это электролиты, при диссоциации которых образуются катионы металлов (или аммония) и анионы кислотного остатка
- 7. (NH4)2SO4 NH4+ SO42- Ион аммония Сульфат-ион
- 8. NaHCO3 = Na+ + HCO3- HCO3- ⇆ H+ + CO32- Диссоциация кислых солей
- 11. Скачать презентацию








 смеси
смеси Уравнения диссоциации
Уравнения диссоциации Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Цитология
Цитология Как меняется термическая устойчивость и реакционная способность связей Э-C и Э-O-Э в ряду Э=Si, Ge, Sn, Pb
Как меняется термическая устойчивость и реакционная способность связей Э-C и Э-O-Э в ряду Э=Si, Ge, Sn, Pb Применение брома
Применение брома Производство органических препаратов ароматического ряда
Производство органических препаратов ароматического ряда Металлы. Группы металлов
Металлы. Группы металлов Реакции ионного обмена
Реакции ионного обмена Неорганическая химия 1 семестра. Растворы
Неорганическая химия 1 семестра. Растворы Теория радиационной деформации в некубических металлах: явление анизотропной диффузии
Теория радиационной деформации в некубических металлах: явление анизотропной диффузии Электролиз
Электролиз Многоядерные Арены
Многоядерные Арены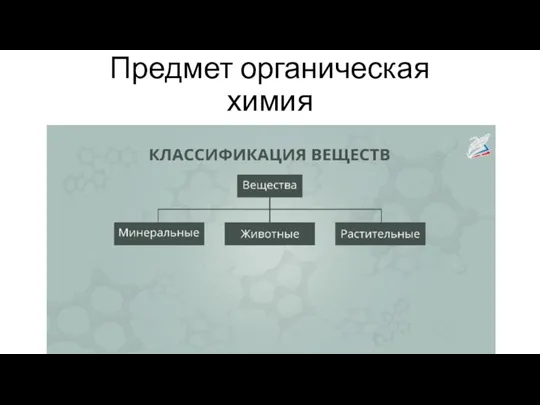 Органическая химия
Органическая химия Фосфор туралы
Фосфор туралы Типы химических реакций. Класс оксиды
Типы химических реакций. Класс оксиды Влияние давления на скорость химических реакций с участием газов
Влияние давления на скорость химических реакций с участием газов Хром
Хром Ионообменная хроматография в разделении белков
Ионообменная хроматография в разделении белков Презентация на тему Витамины. Урок химии 10 класс
Презентация на тему Витамины. Урок химии 10 класс  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Витамины. Классификация витаминов
Витамины. Классификация витаминов Комплексные соединения
Комплексные соединения Мифы и реальность о суперклее
Мифы и реальность о суперклее Нефть. Способы переработки нефти
Нефть. Способы переработки нефти Амины. Номенклатура
Амины. Номенклатура Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Физика полимеров Ч1
Физика полимеров Ч1