Содержание
- 2. CH3COOH ↔ CH3COO- + H+ Kдисс = [CH3COO-][H+] / [CH3COOH] C0 = [CH3COO-] + [CH3COOH] α
- 3. Сильные: α > 0.3 Ka>10-1 Средние: 0.03 Слабые: α Сила электролитов Активность — «эффективная» концентрация a
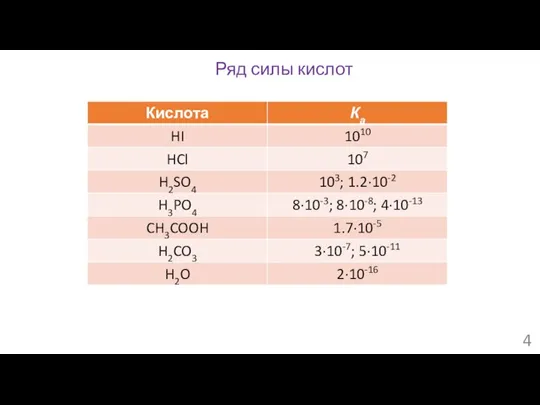
- 4. Ряд силы кислот
- 5. Кислотность воды и растворов H2O ↔ OH- + H+ Kдисс = [OH-]∙[H+] / [H2O] Ионное произведение
- 6. Задача Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации равна 1.5%.
- 7. Задача Рассчитать рН 0.1М раствора масляной (одноосновной) кислоты, если её степень диссоциации равна 1.5%. НА ↔
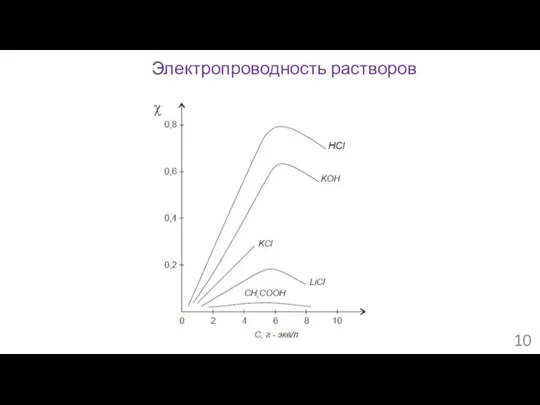
- 9. Электропроводность растворов Закон Ома: I = U/R Сопротивление проводника: R = ρ∙L/S Проводимость 1/R = 1/ρ
- 10. Электропроводность растворов
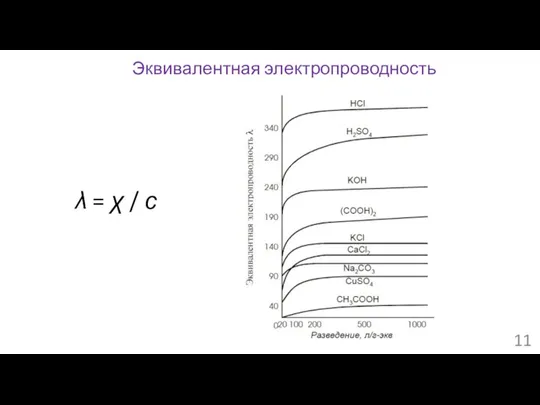
- 11. Эквивалентная электропроводность λ = χ / с
- 12. λ∞ = λ+ + λ- α = λ/ λ∞ Эквивалентная электропроводность и подвижность ионов
- 13. Аномальная подвижность H+ и OH- эстафетный механизм
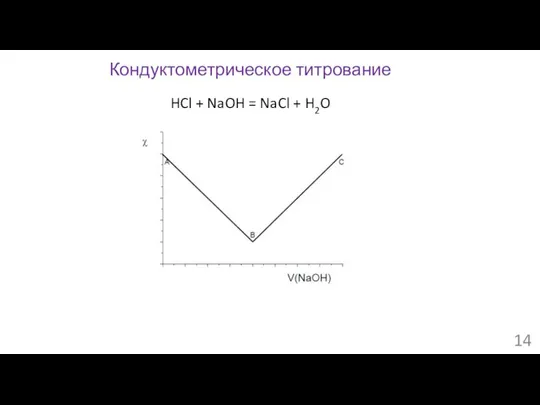
- 14. Кондуктометрическое титрование HCl + NaOH = NaCl + H2O
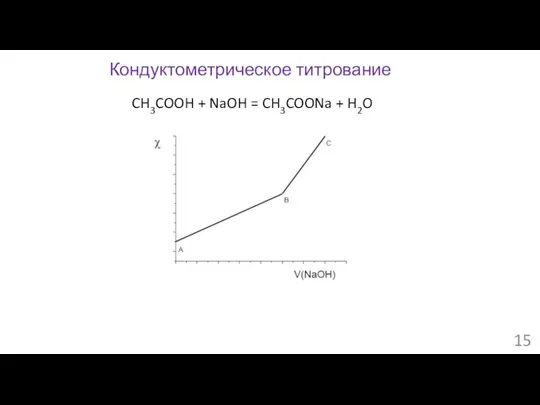
- 15. Кондуктометрическое титрование CH3COOH + NaOH = CH3COONa + H2O
- 16. Гальванический элемент
- 17. Гальванический элемент
- 18. Гальванический элемент
- 19. Стандартные потенциалы Е0
- 20. ЕХC = ЕAg,0 + (0.059/1)∙log(aAg+) = 0.222 В Хлорсеребряный электрод Ag | AgCl | KClнасыщ. AgCl
- 21. ЕХГ = ЕХГ,0 + (0.059/2)∙log(aх∙а2Н2/агх) = = ЕХГ,0 - 0.059∙pH Определение рН
- 22. Задача ЭДС гальванического элемента, состоящего из хлорсеребряного и хингидронного электродов, равна 0.32 Вольт. Найти рН хингидронного
- 24. Скачать презентацию
![CH3COOH ↔ CH3COO- + H+ Kдисс = [CH3COO-][H+] / [CH3COOH] C0 =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1110452/slide-1.jpg)

![Кислотность воды и растворов H2O ↔ OH- + H+ Kдисс = [OH-]∙[H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1110452/slide-4.jpg)













 Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Презентация на тему Викторина "Узнай химический элемент"
Презентация на тему Викторина "Узнай химический элемент"  Типы кристаллических решеток. Тест
Типы кристаллических решеток. Тест Формирование универсальных учебных действий
Формирование универсальных учебных действий кремний и его соединения
кремний и его соединения Презентация на тему Кислоты
Презентация на тему Кислоты  Расчет печи кипящего слоя в производстве хлорида калия
Расчет печи кипящего слоя в производстве хлорида калия Исследование фармакологических препаратов на хлориды, методом аргентометрии
Исследование фармакологических препаратов на хлориды, методом аргентометрии Презентация по Химии "Химический БРЕЙН-РИНГ"
Презентация по Химии "Химический БРЕЙН-РИНГ"  Оксиды. 8 класс
Оксиды. 8 класс Основные положения теории строения органических соединений А.М. Бутлерова
Основные положения теории строения органических соединений А.М. Бутлерова Структура електронної оболонки атома. Енергетичні рівні та підрівні
Структура електронної оболонки атома. Енергетичні рівні та підрівні Органические вещества
Органические вещества Метод молекулярных орбиталей для координационных соединений
Метод молекулярных орбиталей для координационных соединений Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Азотная кислота
Азотная кислота Арены. Бензол
Арены. Бензол Жидкое агрегатное состояние вещества. Растворы
Жидкое агрегатное состояние вещества. Растворы Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Металлы. Урок – обобщения
Металлы. Урок – обобщения Красители для волос. Первая группа
Красители для волос. Первая группа Железо и его соединения
Железо и его соединения Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Соли
Соли Свойства алмаза
Свойства алмаза Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) Строение твердых и жидких металлов. Зональная ликвация
Строение твердых и жидких металлов. Зональная ликвация