Содержание
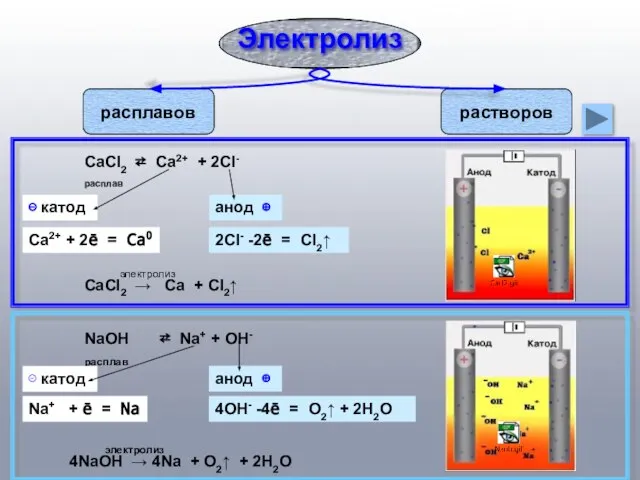
- 2. Электролиз расплавов растворов CaCl2 ⇄ Ca2+ + 2Cl- расплав ⊝ катод анод ⊕ Ca2+ + 2ē
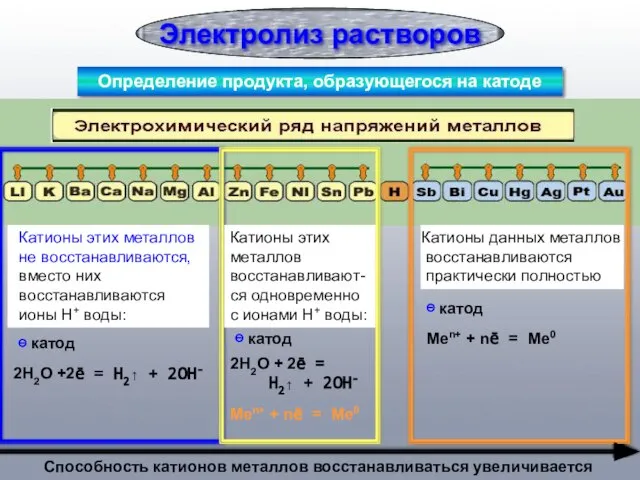
- 3. Электролиз растворов Определение продукта, образующегося на катоде Катионы этих металлов не восстанавливаются, вместо них восстанавливаются ионы
- 4. Электролиз растворов Определение продукта, образующегося на аноде S2- I- Br- Cl- OH- SO42- NO3- CO32- PO43-
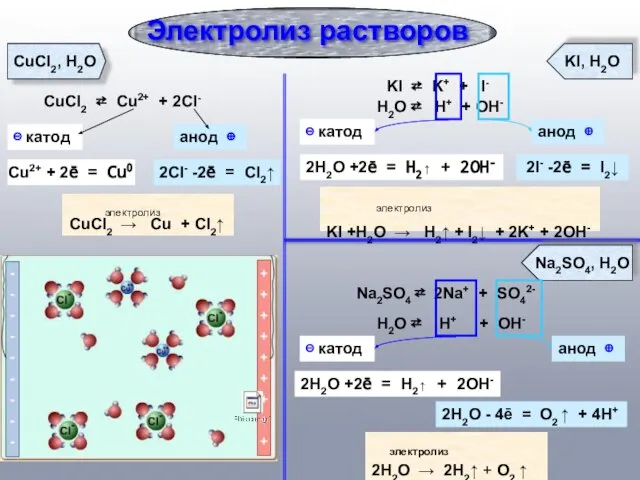
- 5. CuCl2 ⇄ Cu2+ + 2Cl- Электролиз растворов ⊝ катод анод ⊕ Cu2+ + 2ē = Cu0
- 6. Na2SO4 + H2O → Диссоциация: Na2SO4 →2 Na+ + SO42− аноде (+) : SO42−, Н2О: 2
- 7. Ni2+ + 2e− = Ni0 2Н2О + 2e− = Н20 + 2ОН−; NiSO4 + H2O →
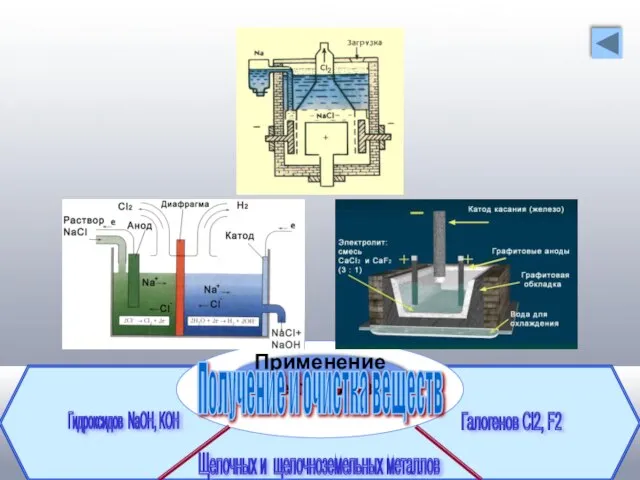
- 8. Применение электролиза Получение и очистка веществ Щелочных и щелочноземельных металлов Гидроксидов NaOH, KOH Галогенов Cl2, F2
- 10. Скачать презентацию



 Празеодим
Празеодим Экологическая химия
Экологическая химия Презентация на тему Электролиты
Презентация на тему Электролиты  Особенности формирования естественно-научной картины мира на уроках географии и химии
Особенности формирования естественно-научной картины мира на уроках географии и химии Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача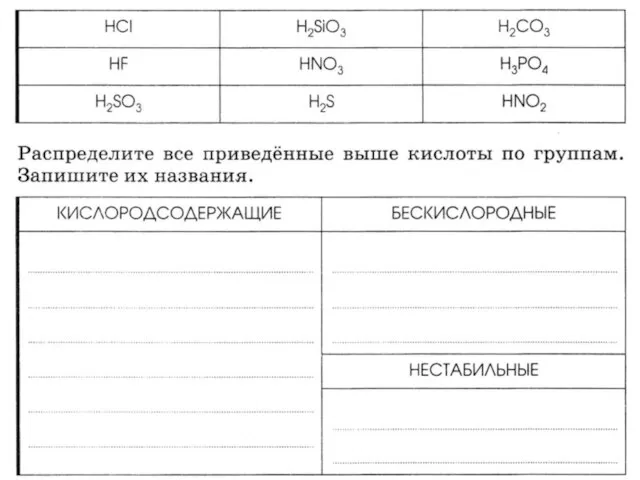 Соли. Классификация сложных веществ
Соли. Классификация сложных веществ Презентация на тему Использование информационных технологий на уроках химии
Презентация на тему Использование информационных технологий на уроках химии  Строение атома
Строение атома Химические системы. Химическая термодинамика. Химическое равновесие
Химические системы. Химическая термодинамика. Химическое равновесие Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов
Роль Хеуорса, Фишера, Лемье в изучении структуры углеводов Уретановый каучук
Уретановый каучук Синтетический каучук
Синтетический каучук Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)  Аммиак. Состав вещества
Аммиак. Состав вещества Строение вещества
Строение вещества История открытия периодической системы химических элементов Д.И.Менделеева
История открытия периодической системы химических элементов Д.И.Менделеева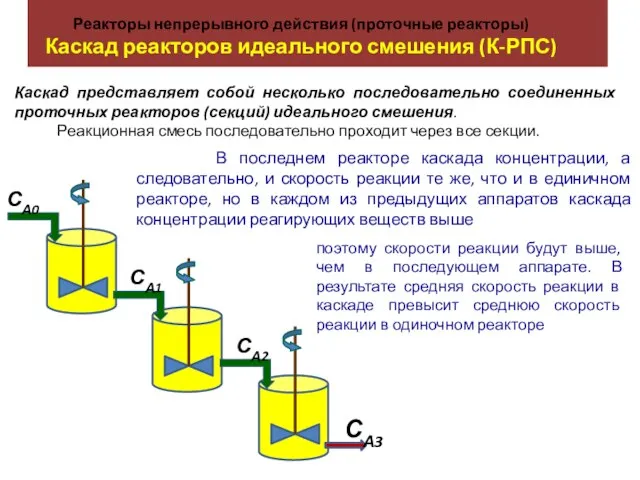 Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС)
Реакторы непрерывного действия (проточные реакторы). Каскад реакторов идеального смешения (К-РПС) Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов"
Презентация по Химии "Электрохимический ряд напряжений металлов. Общие химические свойства металлов" 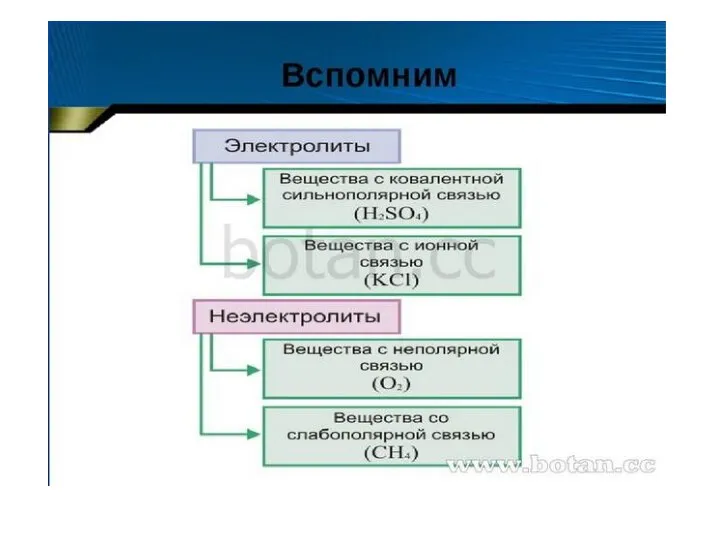 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Металлургия
Металлургия Сырье, продукты, параметры гидроочистки
Сырье, продукты, параметры гидроочистки Полиэтилен-1
Полиэтилен-1 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Необходимые навыки для составления уравнений ОВР
Необходимые навыки для составления уравнений ОВР Незаменимая уксусная кислота
Незаменимая уксусная кислота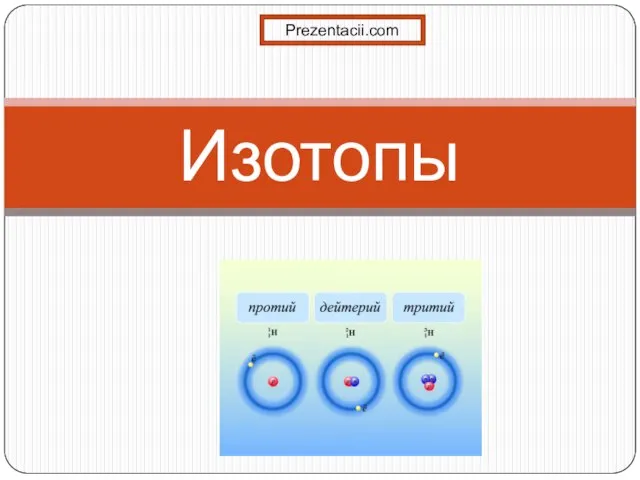 Презентация на тему Изотопы
Презентация на тему Изотопы  Сероводород. Соединения серы
Сероводород. Соединения серы Мыла и синтетические
Мыла и синтетические