Содержание
- 2. ЭЛЕКТРОЭНЕРГИЯ В НАШЕЙ ЖИЗНИ
- 3. ГЕНЕРАЦИЯ ЭЛЕКТРОЭНЕРГИИ
- 4. ПОРТАТИВНЫЕ ИСТОЧНИКИ ЭЛЕКТРОЭНЕРГИИ
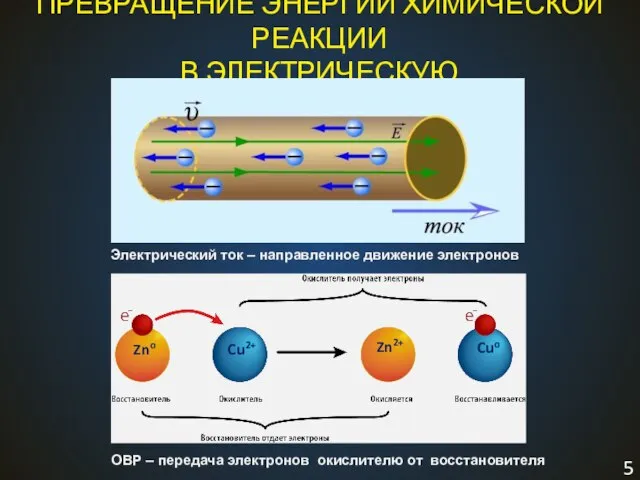
- 5. ПРЕВРАЩЕНИЕ ЭНЕРГИИ ХИМИЧЕСКОЙ РЕАКЦИИ В ЭЛЕКТРИЧЕСКУЮ Электрический ток – направленное движение электронов ОВР – передача электронов
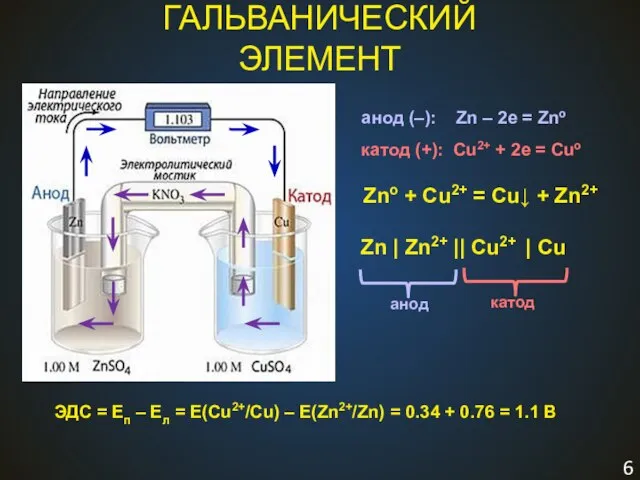
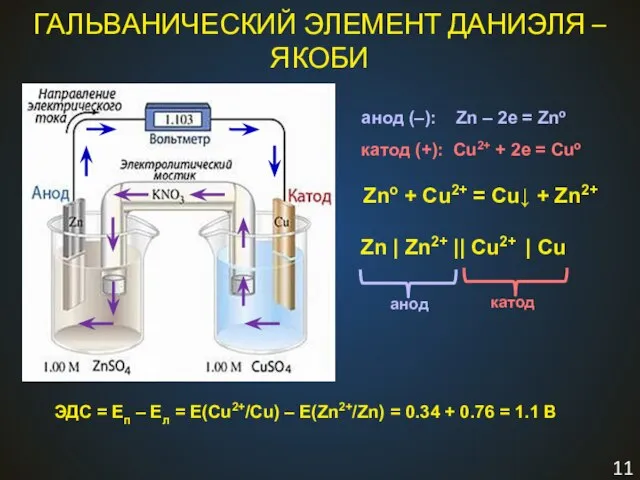
- 6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Zno + Cu2+ = Cu↓ + Zn2+ Zn | Zn2+ || Cu2+ | Cu
- 7. Стандартный водородный электрод (СВЭ) Платиновый электрод, покрытый порошком Pt, в водном растворе кислоты c С(Н+) =
- 8. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Анод (окисление): Zn - 2e = Zn2+ Катод (восстановление): 2H+ + 2e = H2
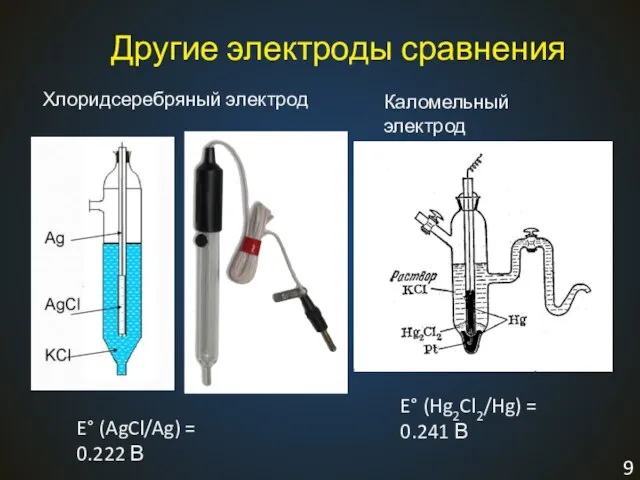
- 9. Другие электроды сравнения Хлоридсеребряный электрод E° (AgCl/Ag) = 0.222 В Электрод II рода AgCl +1ē =
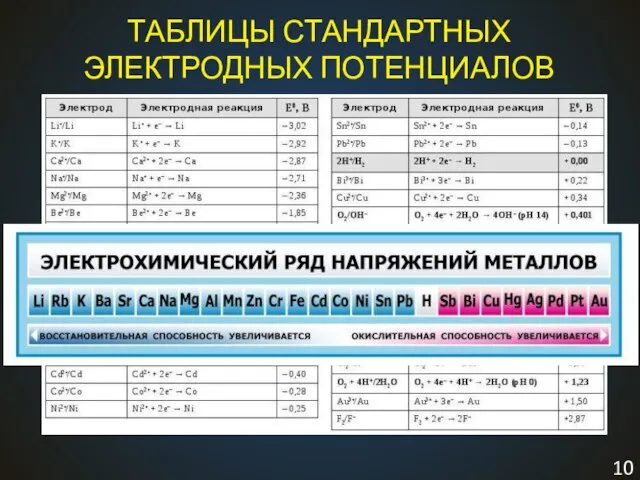
- 10. ТАБЛИЦЫ СТАНДАРТНЫХ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ Чем выше потенциал, тем сильнее окислитель, чем ниже (отрицательнее) потенциал, тем сильнее
- 11. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ Zno + Cu2+ = Cu↓ + Zn2+ Zn | Zn2+ ||
- 12. Луиджи Гальвани (1737 – 1798) ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ДАНИЭЛЯ – ЯКОБИ Алессандро Вольта (1745 – 1827) Вольтов
- 13. ДРЕВНИЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ ? «Багдадская батарейка» (~ III в. до н.э.)
- 15. МАРГАНЕЦ-ЦИНКОВЫЙ ЭЛЕМЕНТ (элемент Лекланше, солевой элемент) Анод: Zn – 2e− → Zn2+ Катод: 2MnO2 + 2H3O+
- 16. ЩЕЛОЧНОЙ ЭЛЕМЕНТ Анод: Zn + 2OH− → Zn(OH)2 + 2ē Катод: 2MnO2 + H2O + 2ē
- 17. ЭЛЕКТРИЧЕСКИЕ АККУМУЛЯТОРЫ Электрический аккумулятор — химический источник тока многоразового действия. Разряжение: как гальванический элемент (источник тока)
- 18. СВИНЦОВО-КИСЛОТНЫЙ АККУМУЛЯТОР Pb | H2SO4 | PbO2, Pb анод (–): Pb + SO42- – 2е =
- 19. Никель-кадмиевый аккумулятор Ni(OH)2/Fe Cd(OH)2/Fe Электролит: KOH Заряжение: анод (+): Ni(OH)2 + OH- – 1е = NiO(OH)
- 20. Никель-металлгидридный аккумулятор Заряжение: анод (+): Ni(OH)2 + OH- – 1е = NiO(OH) + H2O катод (–):
- 21. Майкл Стэнли Уиттингем (1941 г.., Великобритания) Джон Гуденаф (1922 г.., США) Акиро Ёсина (1922 г.., США)
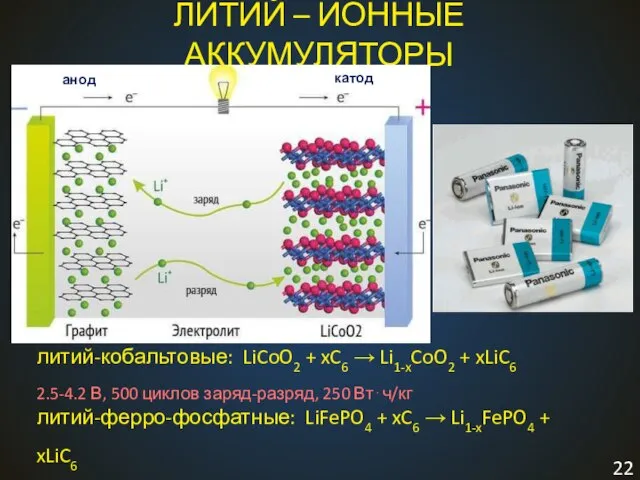
- 22. литий-кобальтовые: LiCoO2 + xC6 → Li1-xCoO2 + xLiC6 2.5-4.2 В, 500 циклов заряд-разряд, 250 Вт⋅ч/кг литий-ферро-фосфатные:
- 24. Скачать презентацию















 Водород. Свойства, применение
Водород. Свойства, применение Ионная химическая связь
Ионная химическая связь Классификация органических веществ
Классификация органических веществ Качественные реакции в химии
Качественные реакции в химии Конкурс юных химиков
Конкурс юных химиков Альдегиды. Общая формула
Альдегиды. Общая формула Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения
Фармаколого-фармакогностическое исследование биологически активных добавок, применяемых для похудения Метаболизм чужеродных соединений
Метаболизм чужеродных соединений Узоры на молоке. Опыт
Узоры на молоке. Опыт Электролитическая диссоциация
Электролитическая диссоциация Презентация на тему Моющие и чистящие средства
Презентация на тему Моющие и чистящие средства  α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26)
α-Аминокислоты. Биологически важные реакции α-аминокислот. Строение пептидов и белков (Лекция 26) Азот в сельском хозяйстве
Азот в сельском хозяйстве Способы получения металлов
Способы получения металлов Управления реакций
Управления реакций Молекулярно-массовое распределение
Молекулярно-массовое распределение Классификация и номенклатура аминов. 11 класс
Классификация и номенклатура аминов. 11 класс Практика по химии
Практика по химии Презентация на тему Полимеры
Презентация на тему Полимеры  Алканы – строение, химические свойства
Алканы – строение, химические свойства Физичекие явления - основа разделения смесей в химии. 17.09.21
Физичекие явления - основа разделения смесей в химии. 17.09.21 Основные понятия органической химии
Основные понятия органической химии Основы химического анализа. Лекция 8
Основы химического анализа. Лекция 8 Электронные оболочки атомов
Электронные оболочки атомов Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Повторение по теме Химические реакции
Повторение по теме Химические реакции Нанотехнологии в быту
Нанотехнологии в быту