Содержание
- 2. ПЛАН УРОКА 1) Характеристика элемента неметалла. Положение неметаллов в ПСХЭ Д.И. Менделеева. Нахождение в природе. Строение
- 3. НЕМЕТАЛЛЫ - это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего уровня.
- 5. Особенности атомного строения неметаллов Небольшой атомный радиус На внешнем уровне 4-8 электронов Располагаются только в главных
- 6. Задание Установите соответствия между элементами и степенями окисления 4573621
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ
- 8. Агрегатное состояние Газы Жидкие Твердые Br2 I2, P4, C, Si, B, S8
- 9. Цвет неметаллов КРАСНЫЙ ЖЕЛТЫЙ ФИОЛЕТОВЫЙ ФОСФОР СЕРА ЙОД БЕСЦВЕТНЫЙ УГЛЕРОД
- 10. Цвет неметаллов БЕЛЫЙ ЧЕРНЫЙ ФОСФОР ФОСФОР ГРАФИТ ЖЕЛТО-ЗЕЛЕНЫЙ ХЛОР
- 11. Температура плавления 3 8000 С – у графита - 2100 С - азота
- 12. Типы кристаллических решеток
- 13. Аллотропия Разные типы кристаллических решеток Р - фосфор Красный фосфор - атомная Белый фосфор - молекулярная
- 14. Аллотропия Разная структура кристаллических решеток С - углерод Тетраэдр Слоистая
- 15. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 16. Аллотропия Разный состав молекул О - кислород Кислород Озон
- 17. ХИМИЧЕСКИЕ СВОЙСТВА НЕМЕТАЛЛОВ Окислительные свойства простых веществ: Реагируют с металлами 2Fe + 3 Cl₂⁰ = 2
- 18. Восстановительные свойства неметаллов ( простых веществ): Со фтором все восстановители 2) С кислородом Si⁰ + O₂
- 19. НЕМЕТАЛЛЫ реагируют с кислотами окислителями (H2SO4(конц) и HNO3 ) неМе + H2SO4(конц) = к-та(max c.o.) +
- 20. Реакции диспрпорционирования галогены (кроме фтора) и сера при взаимодействии со щелочами S + KOH = Cl2
- 21. Задание 2 –выполните все семь заданий 1.Задана следующая схема превращений веществ: x y N2→ Mg3N2→ NH3
- 22. 2. Установите соответствие между простыми веществами и формулами реагентов, с которыми они могут взаимодействовать: А) Ca
- 23. 4.Установите соответствие между названием простого вещества и реагентами, с каждым из которых оно может взаимодействовать: ПРОСОЕ
- 25. Скачать презентацию






















 Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Պոլիմերներ
Պոլիմերներ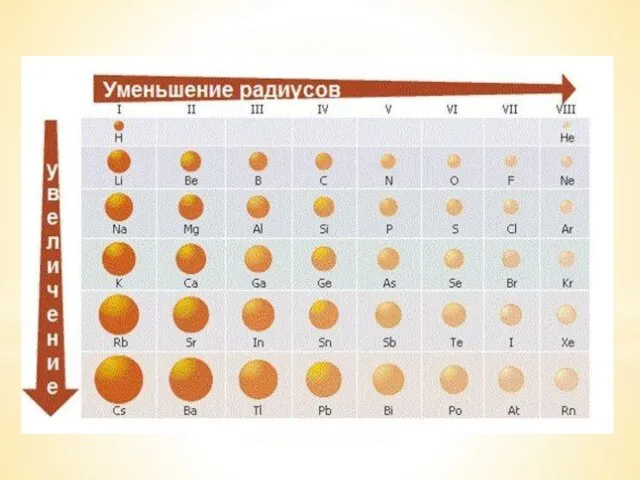 Электроотрицательность химических элементов
Электроотрицательность химических элементов Лекарственные средства – производные пиримидин 2,4,6-триона
Лекарственные средства – производные пиримидин 2,4,6-триона Осмотическое давление
Осмотическое давление Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Вода. Физические и химические свойства
Вода. Физические и химические свойства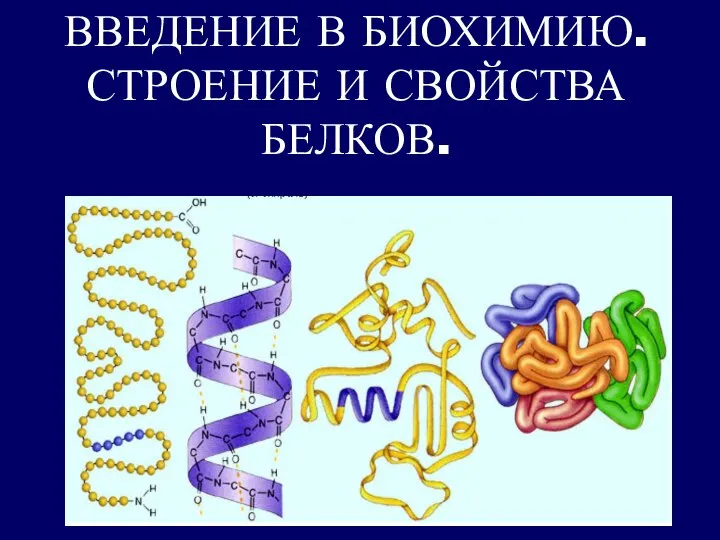 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Вариативные задачи по химии различных типов в тестовой форме
Вариативные задачи по химии различных типов в тестовой форме Строение атома
Строение атома Пространственное строение органических соединений
Пространственное строение органических соединений Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН
Методы отбора проб воды. Оформление и подготовка к анализу, протокол исследования воды, определение рН Природные источники углеводородов
Природные источники углеводородов Проантоцианидины. Антиоксидантные и антирадикальные свойства
Проантоцианидины. Антиоксидантные и антирадикальные свойства Серная кислота
Серная кислота Смеси и взвеси веществ. Простейшие операции с веществом
Смеси и взвеси веществ. Простейшие операции с веществом Курсовой синтез ацетоуксусного эфира
Курсовой синтез ацетоуксусного эфира Кетоны. Реагирующие вещества
Кетоны. Реагирующие вещества Свинец
Свинец Силикаты
Силикаты Краски своими руками. Проектная работа
Краски своими руками. Проектная работа Химическая технология органических веществ
Химическая технология органических веществ Липиды. Омыляемые липиды. Рубежный контроль №2
Липиды. Омыляемые липиды. Рубежный контроль №2 Разбор 25 задания. Установим соответствие
Разбор 25 задания. Установим соответствие Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Сера, соединения серы
Сера, соединения серы ОВР - метод полуреакции
ОВР - метод полуреакции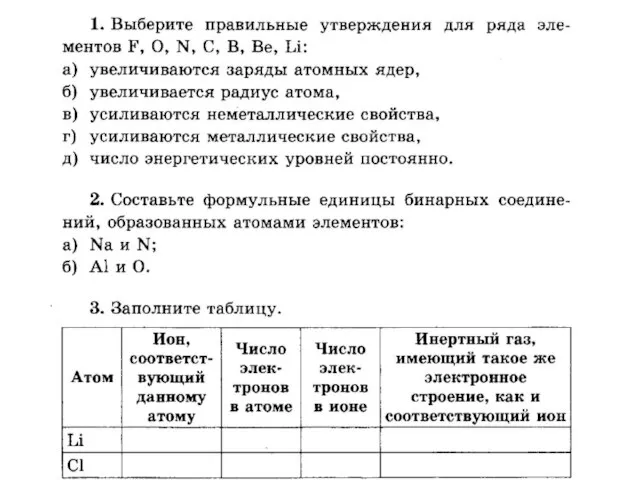 Взаимодействие атомов элементов-неметаллов между собой
Взаимодействие атомов элементов-неметаллов между собой