Слайд 7Применение
Благодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту

и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливоБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химииБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицинеБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующихБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора (ускорителя химических реакций). В медицине растворы пероксида водорода применяются как антисептическое средствоБлагодаря своим сильным окислительным свойствам пероксид водорода нашёл широкое применение в быту и в промышленности, где используется, например, как отбеливатель на текстильном производстве и при изготовлении бумаги. Применяется как ракетное топливо — в качестве окислителя или как однокомпонентное (с разложением на катализаторе). Используется в аналитической химии, в медицине, в качестве пенообразователя при производстве пористых материалов, в производстве дезинфицирующих и отбеливающих средств. В промышленности пероксид водорода также находит свое применение в качестве катализатора (ускорителя химических реакций). В медицине растворы пероксида водорода применяются как антисептическое средство. При контакте с поврежденной кожей и слизистыми пероксид водорода под влиянием фермента каталазы распадается с выделением кислорода, что способствует сворачиванию крови и создает неблагоприятные условия для развития микроорганизмов (противомикробное средство).












 Оксиды и гидроксиды металлов
Оксиды и гидроксиды металлов Дигибридное скрещивание.Третий закон Г.Менделя.
Дигибридное скрещивание.Третий закон Г.Менделя. Карбоновые кислоты и их производные. (Лекция 11)
Карбоновые кислоты и их производные. (Лекция 11) Алкадиены
Алкадиены Состав популярных напитков, рН-группа
Состав популярных напитков, рН-группа Соли. 8 класс
Соли. 8 класс Свойства растворов электролитов
Свойства растворов электролитов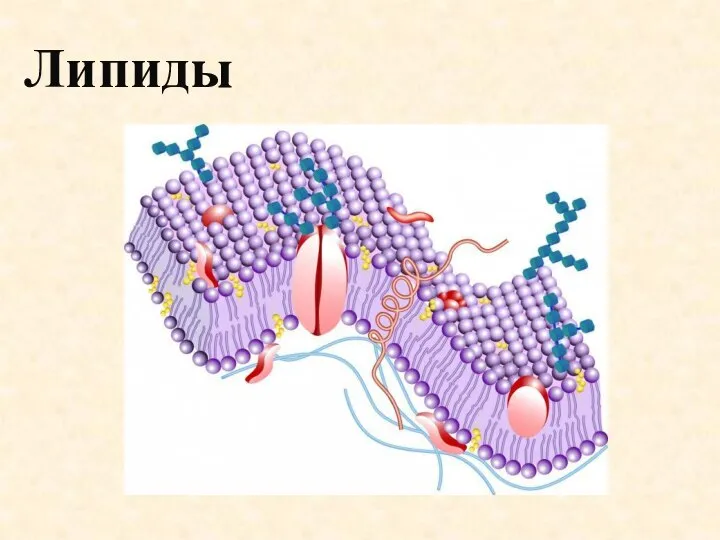 Липиды. Источники
Липиды. Источники Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Комбинаторика в химии
Комбинаторика в химии Вторичная переработка нефти. Крекинг
Вторичная переработка нефти. Крекинг Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"  Ароматические углеводороды
Ароматические углеводороды Ионная полимеризация
Ионная полимеризация Вывод и обсуждение
Вывод и обсуждение Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Мыло. Интересно об известном
Мыло. Интересно об известном Строение атомов. Изотопы
Строение атомов. Изотопы Оксосоединения. Альдегиды и кетоны
Оксосоединения. Альдегиды и кетоны Фенолы
Фенолы Презентация на тему Полимеразная цепная реакция
Презентация на тему Полимеразная цепная реакция  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Презентация на тему Витамин Е
Презентация на тему Витамин Е  Введение в органическую химию. Состав и структура органических веществ
Введение в органическую химию. Состав и структура органических веществ Problem-solving. Test: real-time polymerase chain reaction
Problem-solving. Test: real-time polymerase chain reaction Лекция 1 Основные понятия и законы химии
Лекция 1 Основные понятия и законы химии Химический процесс: энергетика и равновесие
Химический процесс: энергетика и равновесие