Содержание
- 2. 5.Побочные реакции комплексообразования и осаждения
- 3. Пример: Как будет протекать реакция между двумя окислительно-восстановительными парами Fe3+/Fe2+ и I2/2I- в присутствии ЭДТА (Na2H2Y)?
- 7. Формулы для расчета реального потенциала в случае участия компонентов окислительно-восстановительных пар в реакциях комплексообразования В побочных
- 8. Влияние реакций осаждения Рассмотрим реакцию между двумя окислительно-восстановительными парами Cu2+/Cu+ I2/2I- E0Cu2+/Cu+ = 0,16 В ;
- 11. Формулы для расчета реальных потенциалов для случая образования малорастворимых соединений компонентами окислительно-восстановительной пары
- 12. Возможность изменения потенциала определенной окислительно- восстановительной пары путем добавления подходящего осадителя или комплексообразующего реагента или изменения
- 13. Константа химического равновесия окислительно- восстановительных реакций
- 16. Если в окислительно- восстановительной системе присутствуют факторы, влияющие на величину потенциала, то расчет константы химического равновесия
- 19. Скачать презентацию
















 Строение атома. История открытия атома
Строение атома. История открытия атома Техника безопасности на уроках химии
Техника безопасности на уроках химии Вирощування кристалів солей
Вирощування кристалів солей Неметаллы. 8 класс
Неметаллы. 8 класс Валентность. Определение валентности химических элементов по формуле вещества
Валентность. Определение валентности химических элементов по формуле вещества Презентация на тему Неметаллы, особенности строения
Презентация на тему Неметаллы, особенности строения  Липиды. Состав липидов
Липиды. Состав липидов Галогены
Галогены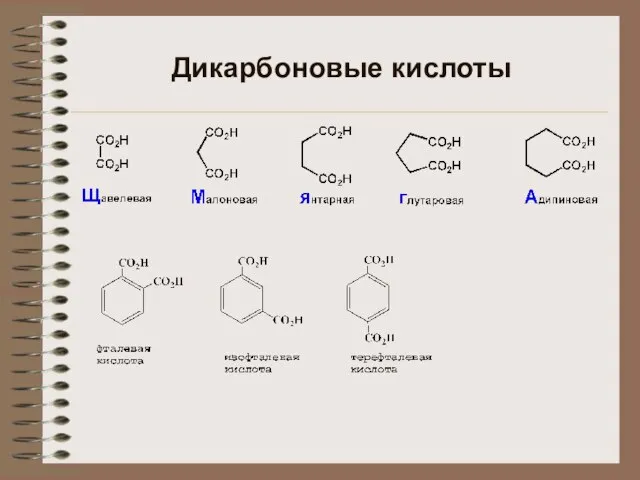 диовые кислоты
диовые кислоты Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Получение галогеноалканов
Получение галогеноалканов Презентация1
Презентация1 Ионная химическая связь
Ионная химическая связь Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения
Анализ процесса гальванического нанесения рения. Поиск альтернативных способов нанесения рения Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях ЛБ 1 ОВР (1)
ЛБ 1 ОВР (1) Минералы. Самородные элементы
Минералы. Самородные элементы Презентация на тему Йод
Презентация на тему Йод  Углеводороды: классификация
Углеводороды: классификация Тема урока «Ионная связь»
Тема урока «Ионная связь» Водопроводная вода и её фильтрация
Водопроводная вода и её фильтрация Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Неметаллические материалы
Неметаллические материалы 10 класс природные источники углеводородов
10 класс природные источники углеводородов Презентация на тему Природные источники углеводородов и их переработка
Презентация на тему Природные источники углеводородов и их переработка  Презентация на тему Химическая связь и её типы
Презентация на тему Химическая связь и её типы  Реактор гидроочистки дизельного топлива
Реактор гидроочистки дизельного топлива Амилаза. Строение амилазы
Амилаза. Строение амилазы