83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
Самородная ртуть














 Водородные соединения неметаллов
Водородные соединения неметаллов Общая характеристика элементов подгруппы углерода. Углерод как простое вещество
Общая характеристика элементов подгруппы углерода. Углерод как простое вещество Установка ЛЧ-35-11/600. Блок Гидроочистки
Установка ЛЧ-35-11/600. Блок Гидроочистки Презентация на тему Жиры (9 класс)
Презентация на тему Жиры (9 класс)  Валентность
Валентность Презентация на тему Аминокислоты. История их открытия
Презентация на тему Аминокислоты. История их открытия  Презентация на тему Жидкое состояние вещества
Презентация на тему Жидкое состояние вещества  Химические реакции. Классификация
Химические реакции. Классификация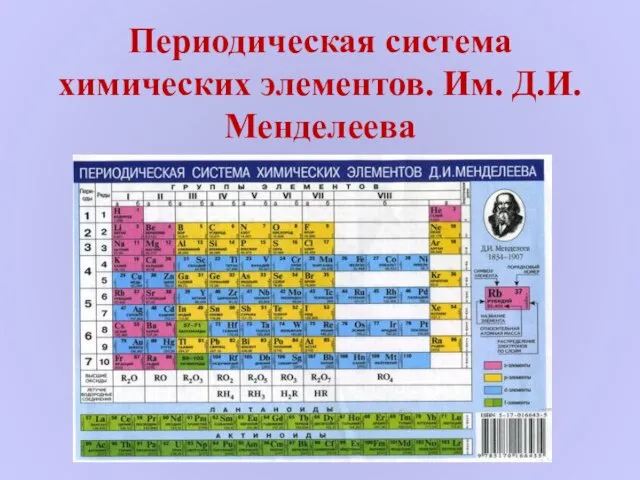 Периодическая система химических элементов. Им. Д.И. Менделеева
Периодическая система химических элементов. Им. Д.И. Менделеева Soft Matter. Emulsions
Soft Matter. Emulsions Substanță chimică
Substanță chimică Svins. Iegūšana
Svins. Iegūšana Химические формулы
Химические формулы Систематизация знаний по периодической системе химических элементов
Систематизация знаний по периодической системе химических элементов Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Щелочные металлы
Щелочные металлы Презентация на тему М.В. Ломоносов
Презентация на тему М.В. Ломоносов  Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9
Топология кристаллических структур. Топологические типы. Программы и базы данных для анализа топологии. Лекция 9 Проблемы и меры по защите окружающей среды ПМР
Проблемы и меры по защите окружающей среды ПМР Свойства воды
Свойства воды Ароматические системы
Ароматические системы Алкины
Алкины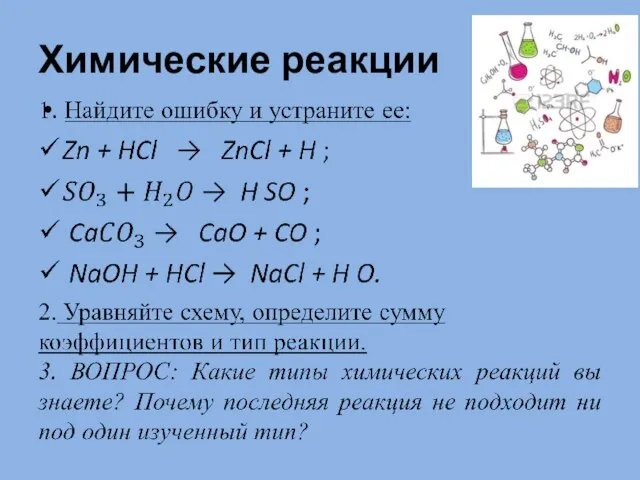 Химические реакции
Химические реакции Альдегиды и кетоны
Альдегиды и кетоны Амины. Номенклатура
Амины. Номенклатура Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Пищевая сода
Пищевая сода Синтетическое моторное масло. Маркировка моторных масел
Синтетическое моторное масло. Маркировка моторных масел