уксусной, примерно в Х веке. Честь ее открытия приписывается персидскому химику Абубекеру аль Рези. Но это установлено не совсем точно. По крайней мере серную кислоту человечество знает около 1000 лет.
ГЛАУБЕР, ИОГАНН РУДОЛЬФ (1604–1670), немецкий химик. Родился в Карлштадте в Нижней Франконии (Германия), в семье бедного цирюльника. Рано потерял отца. Не имея средств на обучение в университете, молодой Иоганн до всего доходил сам – с помощью книг и бесед с учеными людьми. Особенно его привлекали превращения одних веществ в другие.
Концентрированную серную кислоту он получил прокаливанием «зеленого витриола» (железного купороса FeSO4 ·7H2O), квасцов (сульфата калия-алюминия KAl(SO4)2·12H2O) или «белого витриола» (цинкового купороса ZnSO4·7H2O); отсюда – другое старинное название серной кислоты – купоросное масло.














 Осаждение нитрида кремния
Осаждение нитрида кремния строение атома углерода. Валентные состояния атома углерода
строение атома углерода. Валентные состояния атома углерода Синтез и свойства кукурбитурилов
Синтез и свойства кукурбитурилов Альдегиды (номенклатура и изомерия)
Альдегиды (номенклатура и изомерия) Алкины. Строение.номенклатура. Изомерия. Получение
Алкины. Строение.номенклатура. Изомерия. Получение Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Проблемное обучение на уроках химии
Проблемное обучение на уроках химии Практика по химии
Практика по химии Углерод и его соединения
Углерод и его соединения Определение площади поверхности и пористости материалов методом сорбции газов
Определение площади поверхности и пористости материалов методом сорбции газов Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории
Подготовила Ковальчук О.М. учитель химии высшей квалификационной категории Свойства кальция и магния. Жёсткость воды. Лекция №7
Свойства кальция и магния. Жёсткость воды. Лекция №7 Элемент протактиний
Элемент протактиний Проектная работа Кристаллизация
Проектная работа Кристаллизация Молярный объем газов
Молярный объем газов Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Дополнительный_материал_11.15_23.09.2022_e4f87550
Дополнительный_материал_11.15_23.09.2022_e4f87550 Тема урока: «Серная кислота» 9 класс
Тема урока: «Серная кислота» 9 класс Команда Оптимисты
Команда Оптимисты Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2
Характеристика нефти и ее фракций как сырья для производства мoторныx топлив. Тема 2 Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика Нихром. Физические свойства
Нихром. Физические свойства Каучук. История открытия каучука
Каучук. История открытия каучука Свойства алкенов
Свойства алкенов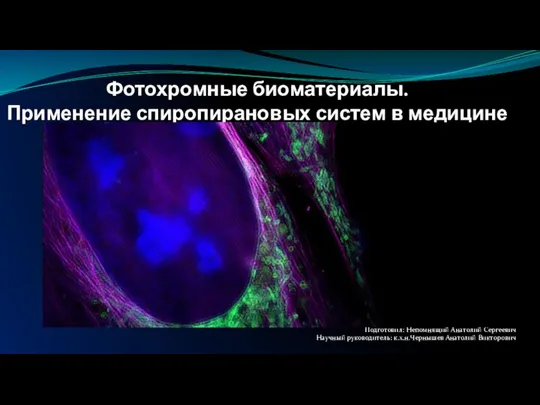 Фотохромные биоматериалы. Применение спиропирановых систем в медицине
Фотохромные биоматериалы. Применение спиропирановых систем в медицине Основы химии буровых растворов
Основы химии буровых растворов Степень окисления. Составление химических формул бинарных соединений
Степень окисления. Составление химических формул бинарных соединений Олово
Олово