Содержание
- 2. А + В = С + D Условная реакция Чем быстрее происходит процесс изменения концентраций веществ,
- 3. Δn Для того чтобы определить скорость химической реакции нужно знать изменение химического количества ∆n одного из
- 4. Скорость химической реакции — это величина, которая равна отношению изменения молярной концентрации вещества к интервалу времени,
- 5. Гомогенные реакции — это реакции, протекающие в однородной среде, т.е. там, где нет поверхности раздела реагирующих
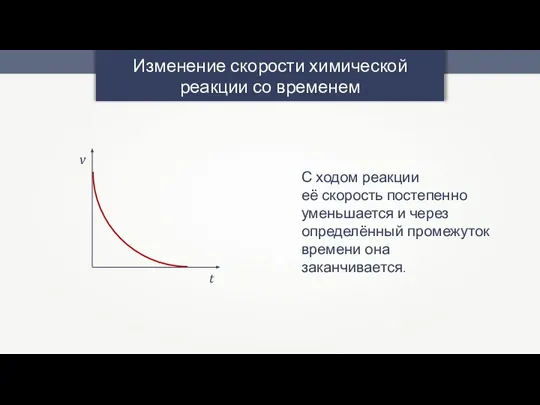
- 6. Изменение скорости химической реакции со временем v t С ходом реакции её скорость постепенно уменьшается и
- 7. Химическая кинетика — раздел химии, который изучает скорость химических реакций.
- 8. Факторы, которые оказывают влияние на скорость химических реакций: – природа реагирующих веществ; – их концентрация; –
- 9. 1. Природа реагирующих веществ HCl Цинк (Zn) Железо (Fe) Медь (Cu)
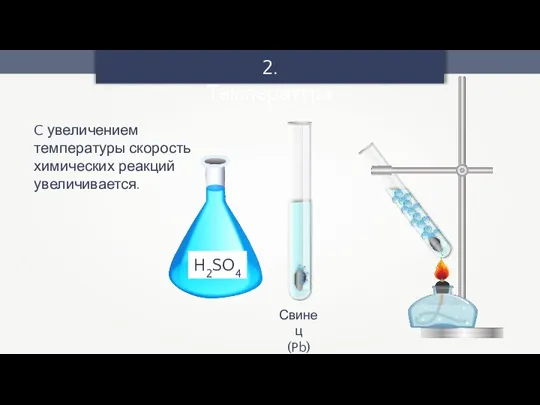
- 10. 2. Температура Свинец (Pb) C увеличением температуры скорость химических реакций увеличивается.
- 11. Якоб Хендрик Вант-Гофф 1852–1911 гг. Голландский учёный. Установил количественную зависимость скорости реакций от температуры в 1884
- 12. Правило Вант-Гоффа: при изменении температуры (повышении либо понижении) на каждые 10°С скорость реакции соответственно изменяется (увеличивается
- 13. γ — температурный коэффициент, который показывает во сколько раз увеличится скорость реакции с повышением температуры на
- 14. 3. Концентрация исходных веществ Чем выше молярные концентрации исходных веществ, тем больше скорость химической реакции.
- 15. К. Гульдберг и П. Вааге Зависимость скорости химической реакции от концентрации реагирующих веществ описана основным законом
- 16. Закон действующих масс: скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных
- 17. Закон действующих масс справедлив только для наиболее простых по своему механизму взаимодействий.
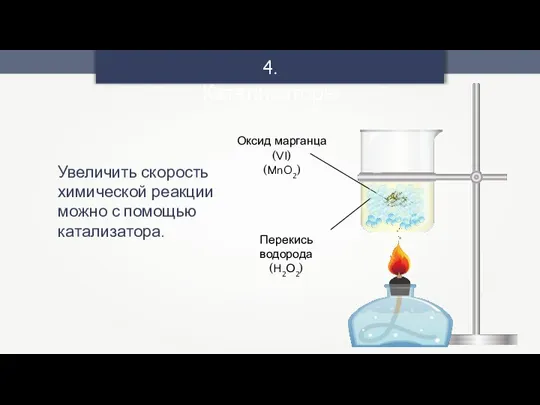
- 18. 4. Катализаторы Увеличить скорость химической реакции можно с помощью катализатора.
- 19. Катализатор — вещество, которое увеличивает скорость химической реакции, но само при этом не расходуется и в
- 20. Катализ — процесс изменения скорости химической реакции добавлением катализатора. Каталитические реакции — реакции с участием катализаторов.
- 21. Ферменты — биологические катализаторы белковой природы.
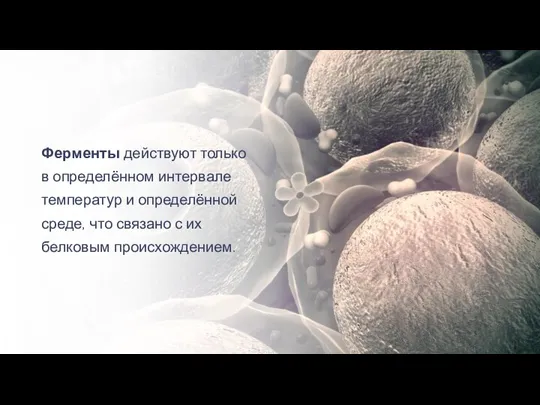
- 22. Ферменты действуют только в определённом интервале температур и определённой среде, что связано с их белковым происхождением.
- 23. Ингибиторы — вещества, которые служат для уменьшения скорости реакции.
- 25. Скачать презентацию

















 СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Презентация на тему История каучука
Презентация на тему История каучука  Номенклатура и изомерия алкенов
Номенклатура и изомерия алкенов Обобщение знаний по курсу органической химии
Обобщение знаний по курсу органической химии Кремний. Физический свойства. Получение. Применение
Кремний. Физический свойства. Получение. Применение Судың химиялық потенциялы
Судың химиялық потенциялы Соли
Соли Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций Среды для культивирования эмбрионов-история разработки и составы
Среды для культивирования эмбрионов-история разработки и составы атомно-молекулярное учение (1)
атомно-молекулярное учение (1) Аллотропия кислорода. Состав воздуха
Аллотропия кислорода. Состав воздуха Электролитическая диссоциация (9 класс)
Электролитическая диссоциация (9 класс) Кислород
Кислород Атомы, вещества, молекулы
Атомы, вещества, молекулы Соединения азота
Соединения азота Химические структуры
Химические структуры Основания. Классификация, состав и номенклатура оснований
Основания. Классификация, состав и номенклатура оснований Классы неорганических веществ. Типы химических реакций Конкурс знаний
Классы неорганических веществ. Типы химических реакций Конкурс знаний Карбоновые кислоты
Карбоновые кислоты Поверхностные явления и дисперсные системы
Поверхностные явления и дисперсные системы 8-29 класс (1)
8-29 класс (1) Применение каучука
Применение каучука 3_Kislorodsoderzhaschie_kisloty_khlora
3_Kislorodsoderzhaschie_kisloty_khlora Презентация на тему Химия и сельское хозяйство
Презентация на тему Химия и сельское хозяйство  Pomalé a rýchle reakcie v bežnom živote
Pomalé a rýchle reakcie v bežnom živote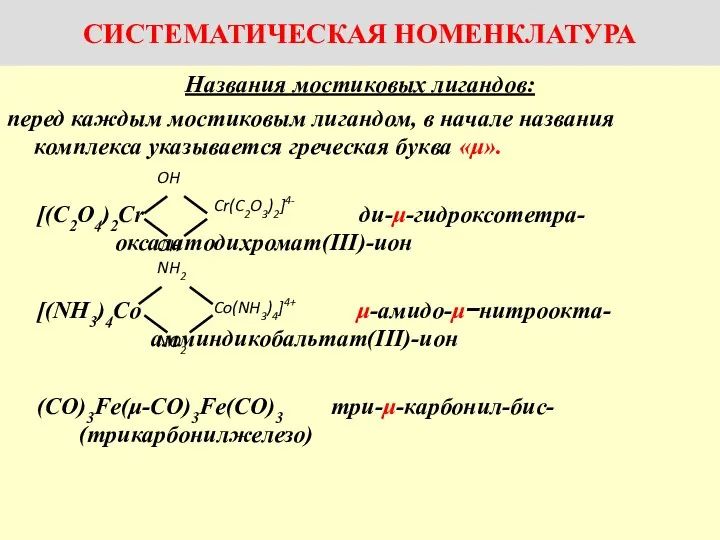 Названия комплексов с мостиковыми лигандами
Названия комплексов с мостиковыми лигандами Атомы, молекулы и ионы
Атомы, молекулы и ионы Опыт Пилатра де Розьера
Опыт Пилатра де Розьера