Содержание
- 2. Водород как элемент открыл Г.Кавендиш в 1766 и назвал его «горючим воздухом», а в 1781 он
- 3. Массовая доля водорода в земной коре составляет 1 % — это десятый по распространённости элемент. Водород
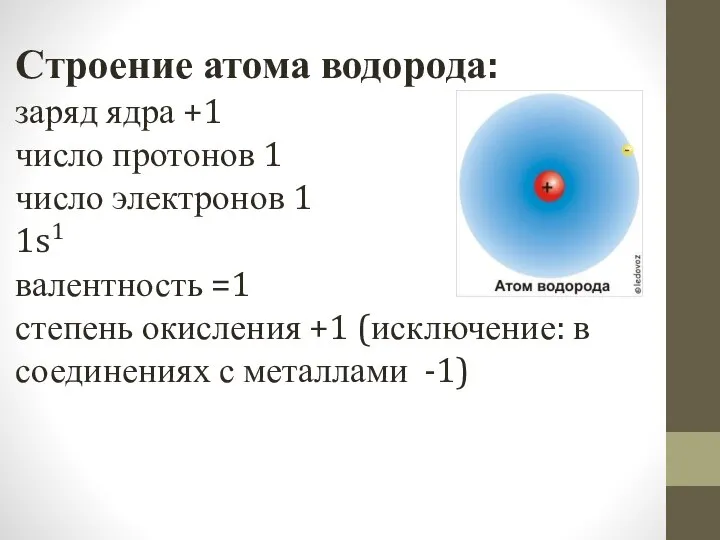
- 4. Строение атома водорода: заряд ядра +1 число протонов 1 число электронов 1 1s1 валентность =1 степень
- 5. Водород – простое вещество. Молекула водорода Н2 Водород — самый лёгкий газ, он легче воздуха в
- 6. С воздухом образует взрывоопасную смесь - гремучий газ. Наибольшую взрывоопасность этот газ имеет при объёмном отношении
- 7. Получение водорода В лаборатории: действие разбавленных кислот на металлы. Zn + 2HCl → ZnCl2+ H2↑ 2.
- 8. Химические свойства Взаимодействие с простыми веществами. При обычных температурах водород реагирует только со щелочными щелочно-земельными металлами,
- 9. С большинством же металлов и неметаллов водород реагирует при повышенной температуре: О2 + 2Н2 = 2Н2О
- 10. 2. Взаимодействие со сложными веществами. Взаимодействие с оксидами металлов (как правило, d-элементов). Оксиды восстанавливаются до металлов:
- 11. Применение водорода 1. Атомарный водород используется для атомно-водородной сварки. 2. При производстве аммиака, метанола, мыла и
- 12. 4. Водород очень лёгок и в воздухе всегда поднимается вверх. Когда-то дирижабли и воздушные шары наполняли
- 14. Скачать презентацию










 Ксантановая камедь
Ксантановая камедь Арены. Бензол
Арены. Бензол Электролиз. Законы Фарадея
Электролиз. Законы Фарадея Типы химических связей 8 класс
Типы химических связей 8 класс Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И. Менделеева Презентация Щелочные металлы
Презентация Щелочные металлы Asymmetric Total Synthesis of Lancifodilactone G Acetate
Asymmetric Total Synthesis of Lancifodilactone G Acetate Биосинтез фенольных соединений в растениях
Биосинтез фенольных соединений в растениях Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды)
Хромопротеиды (от. греч. chroma — цвет, окраска + протеиды) Изготовление слайма в домашних условиях
Изготовление слайма в домашних условиях задачи
задачи Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол
Электронное и пространственное строение молекулы метана Учитель химии МБОУ СОШ № 9 МО ЩР станица Новощербиновская Степучева Ол Презентация на тему Таблица Менделеева и строение атома
Презентация на тему Таблица Менделеева и строение атома  Презентация на тему Органическая химия. История развития
Презентация на тему Органическая химия. История развития  Ароматические и ненасыщенные альдегиды и кетоны
Ароматические и ненасыщенные альдегиды и кетоны Азотная кислота
Азотная кислота Практическая работа: Очистка загрязнённой поваренной соли
Практическая работа: Очистка загрязнённой поваренной соли Физико-химические методы анализа. Лекция 4
Физико-химические методы анализа. Лекция 4 Презентация на тему Химия в повседневной жизни человека
Презентация на тему Химия в повседневной жизни человека  Алюминий
Алюминий Презентация на тему Путешествие по континенту Химия
Презентация на тему Путешествие по континенту Химия  Периодическая система химических элементов. Им. Д.И. Менделеева
Периодическая система химических элементов. Им. Д.И. Менделеева Гидролиз солей
Гидролиз солей Физико-химические методы анализа. Лекция № 1
Физико-химические методы анализа. Лекция № 1 Вырсова И.Е.
Вырсова И.Е. Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Основы химической термодинамики
Основы химической термодинамики