Содержание
- 2. План занятия Основные понятия химии Состав веществ. Изменение веществ Основные законы химии. Обозначения, названия и единицы
- 3. !!!! Сделать краткий конспект основных понятий и законов Выполнить задания в конце презентации Для проверки скинуть
- 4. Основные понятия химии.
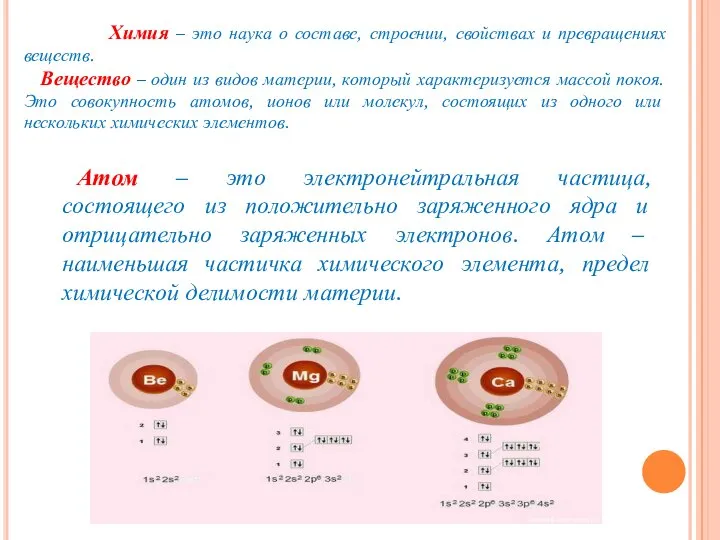
- 5. Атом – это электронейтральная частица, состоящего из положительно заряженного ядра и отрицательно заряженных электронов. Атом –
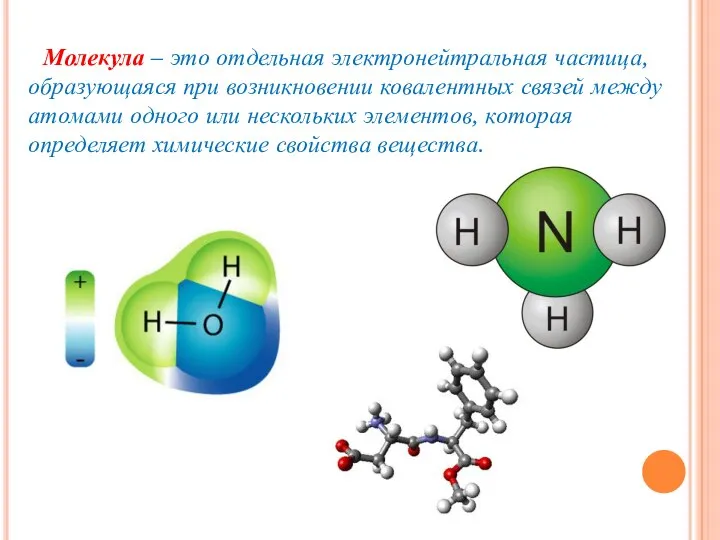
- 6. Молекула – это отдельная электронейтральная частица, образующаяся при возникновении ковалентных связей между атомами одного или нескольких
- 7. Химический элемент – это совокупность атомов с одинаковым зарядом ядра. Например: сера S, углерод C, кальций
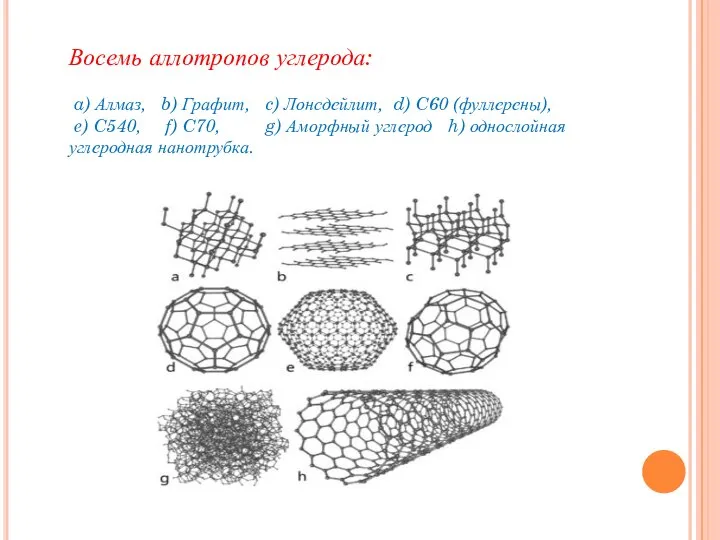
- 9. Восемь аллотропов углерода: a) Алмаз, b) Графит, c) Лонсдейлит, d) C60 (фуллерены), e) C540, f) C70,
- 10. Состав веществ. Изменение веществ.
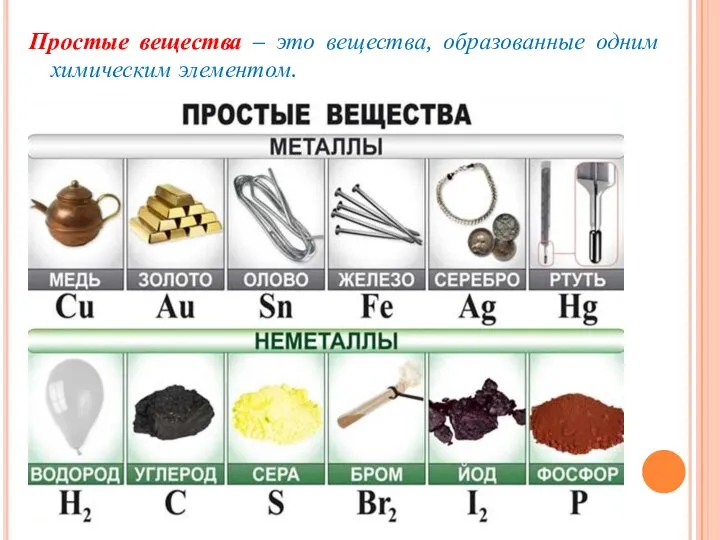
- 11. Простые вещества – это вещества, образованные одним химическим элементом.
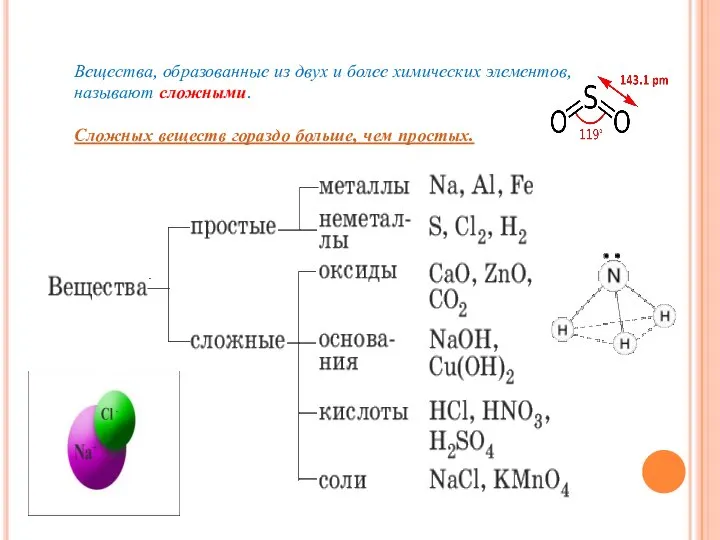
- 12. Вещества, образованные из двух и более химических элементов, называют сложными. Сложных веществ гораздо больше, чем простых.
- 13. Различают в качественный и количественный состав веществ. Качественный состав – это совокупность химических элементов и (или)
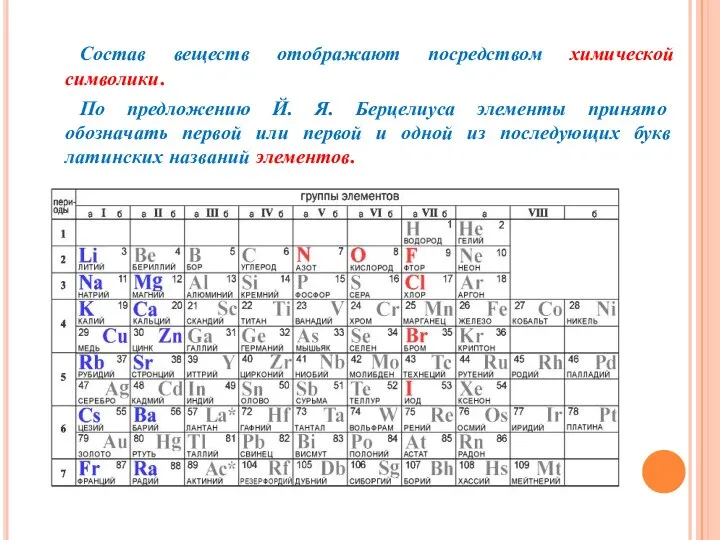
- 14. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или
- 15. Химический знак (символ) – несет значительную информацию. Он обозначает название элемента, один его атом, один моль
- 16. Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну молекулу его,
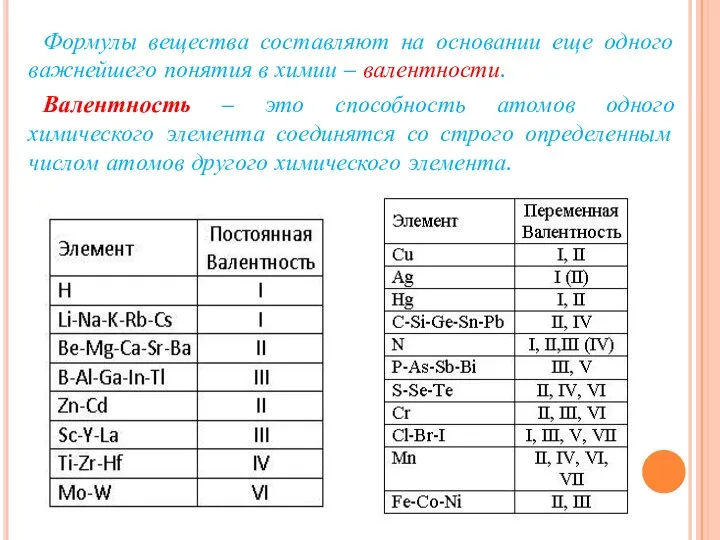
- 17. Формулы вещества составляют на основании еще одного важнейшего понятия в химии – валентности. Валентность – это
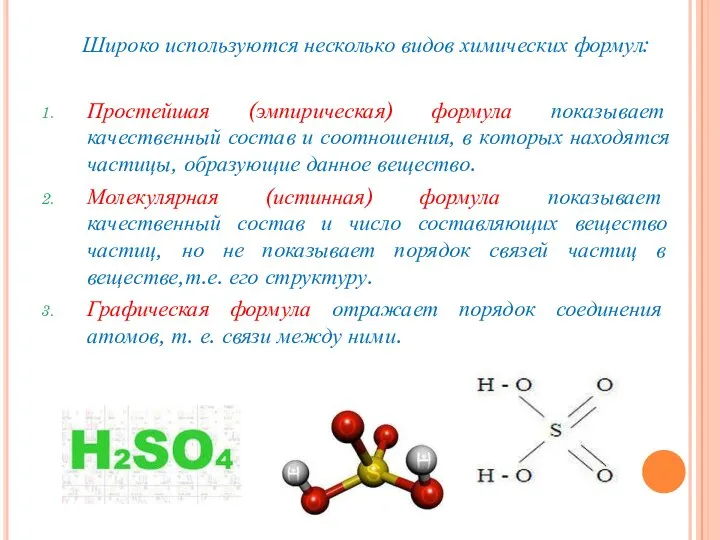
- 18. Широко используются несколько видов химических формул: Простейшая (эмпирическая) формула показывает качественный состав и соотношения, в которых
- 19. Относительная атомная масса ( ) химического элемента – это величина, показывающая отношение средней массы атома природной
- 20. Относительная атомная масса – одна из основных характеристик химического элемента. Относительная молекулярная масса ( ) равна
- 21. Количество вещества (n или v) характеризуют числом атомов, молекул или других формульных единиц данного вещества. В
- 22. Молярная масса может быть выражена через число молекул (или атомов) в одном моле вещества ( )
- 23. Из этого выражения можно определить число молекул или атомов, содержащихся в одном месте любого вещества, которое
- 24. Основные законы химии
- 25. Закон сохранения массы. Был открыт М. В. Ломоносовым (1748г.) и сформулирован А. Лавуазье (1789г.): Масса веществ,
- 26. Закон постоянства состава вещества. Сформулирован Ж.-Л. Прустом в 1799 г.: все индивидуальные вещества имеют постоянный качественный
- 27. Современная формулировка закона постоянства состава вещества таков: Состав соединений молекулярной структуры является постоянным независимо от способа
- 28. Из закона Авогадро вытекают 2 следствия: Один моль любого газа при одинаковых условиях занимает один и
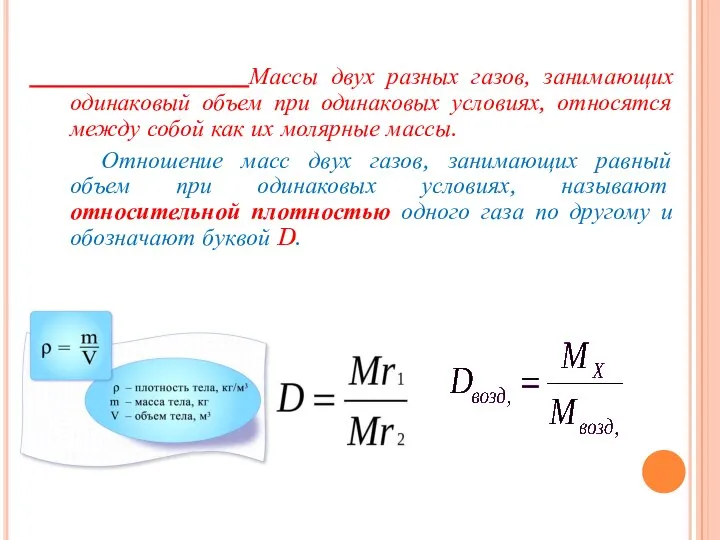
- 29. Массы двух разных газов, занимающих одинаковый объем при одинаковых условиях, относятся между собой как их молярные
- 30. Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона) или где p – давление; V – объем газа; m
- 31. Задания для закрепления: Тест по теме «Предмет химии. Вещества». 1) Что изучает наука химия? Это наука
- 32. 6) Вещество: 1. Медная проволока 2.Медная монета 3. Медная пластина 4.Медь 7) Простое вещество: 1.Водород 2.Углекислый
- 34. Скачать презентацию




















 Сложные эфиры. Жиры
Сложные эфиры. Жиры Презентация по Химии "Количество вещества. Моль"
Презентация по Химии "Количество вещества. Моль"  Классификация оксидов
Классификация оксидов Ионные уравнения
Ионные уравнения Технико-коммерческое предложение. Конструкции из композитного профиля и настилы
Технико-коммерческое предложение. Конструкции из композитного профиля и настилы Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 АТФ-синтаза
АТФ-синтаза Оксиды. Физические свойства
Оксиды. Физические свойства Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Алкены
Алкены Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Нитраты
Нитраты Разветвленные цепные реакции
Разветвленные цепные реакции КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс
КАРБОНОВЫЕ КИСЛОТЫ Органическая химия 11 класс Классы неорганических соединений
Классы неорганических соединений Калий. Общая информация
Калий. Общая информация Основные сведения о строении атома
Основные сведения о строении атома Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Нихром. Физические свойства
Нихром. Физические свойства Углерод и его свойства
Углерод и его свойства Биологическое окисление
Биологическое окисление Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания
Электролитическая диссоциация веществ Реакции ионного обмена и условия их протекания Основания. Классификация
Основания. Классификация Кислородные соединения углерода
Кислородные соединения углерода Энергетическая диаграмма орбиталей многоэлектронного атома
Энергетическая диаграмма орбиталей многоэлектронного атома Йод. Свойства
Йод. Свойства кислородосодерж. орг. соед. (1)
кислородосодерж. орг. соед. (1) Аминокислоты. Химические и физические свойства
Аминокислоты. Химические и физические свойства