Содержание
- 2. Оглавление: ВВЕДЕНИЕ КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ РЕАКЦИЙ: По числу и составу реагирующих веществ По изменению степеней окисления химических
- 3. ВВЕДЕНИЕ Химические реакции – химические процессы, в результате которых из одних веществ образуются другие отличающиеся от
- 4. По числу и составу реагирующих веществ: Реакции, идущие без изменения состава веществ В неорганической химии к
- 5. Аллотропия серы: S (ромбическая) S (пластическая) ОГЛАВЛЕНИЕ Классификация реакций
- 6. Аллотропия фосфора: Р (красный) Р (белый) ОГЛАВЛЕНИЕ
- 7. Реакции, идущие с изменением состава вещества Реакции соединения – это такие реакции, при которых из двух
- 8. Реакция соединения кислотного оксида фосфора(V) с водой: Р2 О5 + 3H2O = 2 H3PO4 ОГЛАВЛЕНИЕ Классификация
- 9. 2. Реакции разложения – это такие реакции, при которых из одного сложного вещества образуется несколько новых
- 10. Разложение перманганата калия при нагревании: Разгорание тлеющей лучины свидетельствует от том, что происходит выделение кислорода: 2KMnO4
- 11. 3. Реакции замещения – это такие реакции, в результате которых атомы простого вещества замещают атомы какого-нибудь
- 12. Взаимодействие щелочного металла натрия с водой: 2Na + 2H2O = 2NaOH + H2⭡ ОГЛАВЛЕНИЕ Классификация реакций
- 13. Взаимодействие щелочного металла кальция с водой: Са + 2Н2О = Са(ОН)2 + H2⭡ ОГЛАВЛЕНИЕ Классификация реакций
- 14. 4. Реакции обмена – это такие реакции, при которых два сложных вещества обмениваются своими составными частями
- 15. Взаимодействие сульфата хрома(III) с гидроксидом калия: Cr2(SO4)3 + 6KOH = 2Cr(OH)3 + 3K2SO4 ОГЛАВЛЕНИЕ Классификация реакций
- 16. 2. По изменению степеней окисления химических элементов, образующих вещества: Окислительно-восстановительные реакции: Окислительно-восстановительные реакции – реакции, идущие
- 17. Окислительно-восстановительная реакция: горение магния Сложные окислительно-восстановительные реакции составляются с помощью метода электронного баланса ОГЛАВЛЕНИЕ 0 0
- 18. Не окислительно-восстановительные реакции: К ним относятся все реакции ионного обмена, например: Na2CO3 + 2HCl = 2NaCl
- 19. 3. По участию катализатора: Катализаторы – это вещества, участвующие в химической реакции и изменяющие ее скорость
- 20. Каталитическая реакция взаимодействия алюминия с йодом: H2O 4Al + 3I2 ⭢ 2AlI3 ОГЛАВЛЕНИЕ Классификация реакций
- 21. 4. По агрегатному состоянию реагирующих веществ (фазовому составу): Гетерогенные реакции: Гетерогенные реакции – реакции, в которых
- 22. 5. По тепловому эффекту: Экзотермические реакции: Экзотермические реакции – реакции, протекающие с выделением энергии во внешнюю
- 23. Эндотермические реакции: Эндотермические реакции – реакции, протекающие с поглощением энергии во внешнюю среду. К ним относятся
- 24. 6. По направлению: Необратимые реакции: Необратимые реакции протекают в данных условиях только в одном направлении. К
- 25. Обратимые реакции: Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях. Таких реакций подавляющее
- 26. 3. НАИБОЛЕЕ ИНТЕРЕСНЫЕ ХИМИЧЕСКИЕ РЕАКЦИИ, ПРОВОДИМЫЕ В ШКОЛЬНЫХ ЛАБОРАТОРИЯХ Наиболее интересными реакциями, проводимыми в школьных лабораториях
- 27. Реакция горения кальция на воздухе: Реакции горения протекают очень бурно ОГЛАВЛЕНИЕ Интересные реакции
- 28. Реакция горения лития: ОГЛАВЛЕНИЕ
- 29. Реакция взаимодействия бумаги с серной кислотой : ОГЛАВЛЕНИЕ Интересные реакции
- 30. Реакция взаимодействия фосфора с азотной кислотой: ОГЛАВЛЕНИЕ Интересные реакции
- 32. Скачать презентацию





























 Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Химические волокна. Урок 1-2
Химические волокна. Урок 1-2 Оксиды в свете ТЭД
Оксиды в свете ТЭД Пищевые добавки: вред и польза
Пищевые добавки: вред и польза Силумины. Виды силуминов
Силумины. Виды силуминов Альдегиды и кетоны
Альдегиды и кетоны Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Реакции окисления-восстановления в химическом анализе. (Лекция 7.2)
Реакции окисления-восстановления в химическом анализе. (Лекция 7.2)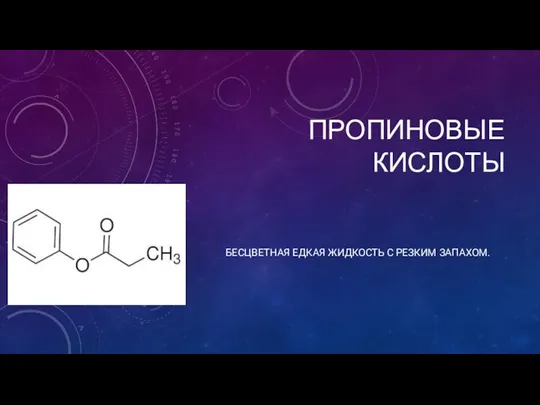 Пропиновые кислоты
Пропиновые кислоты Химия. Наука о веществах
Химия. Наука о веществах Комплексные соединения
Комплексные соединения Химическая связь. Урок-упражнение
Химическая связь. Урок-упражнение Газообразные дисперсные системы (Аэрозоли)
Газообразные дисперсные системы (Аэрозоли) Жидкое состояние вещества
Жидкое состояние вещества Пластмассы
Пластмассы Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Окислительно-восстановительные реакции
Окислительно-восстановительные реакции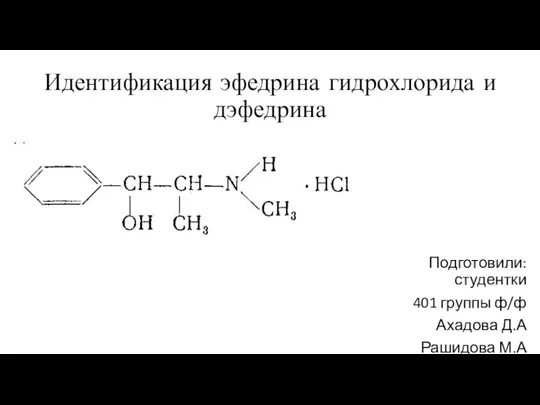 Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Презентация на тему Основания
Презентация на тему Основания  Бикомпонентные покрытия
Бикомпонентные покрытия Особенности строения электронных оболочек атомов элементов больших периодов
Особенности строения электронных оболочек атомов элементов больших периодов 1666603286718__4v20ts
1666603286718__4v20ts Строение вещества. Молекулы
Строение вещества. Молекулы ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ
ИЗМЕНЕНИЕ СВОЙСТВ В ПЕРИОДАХ И ГРУППАХ Липиды. Источники
Липиды. Источники Строение и свойства циклоалканов
Строение и свойства циклоалканов Таблица Менделеева
Таблица Менделеева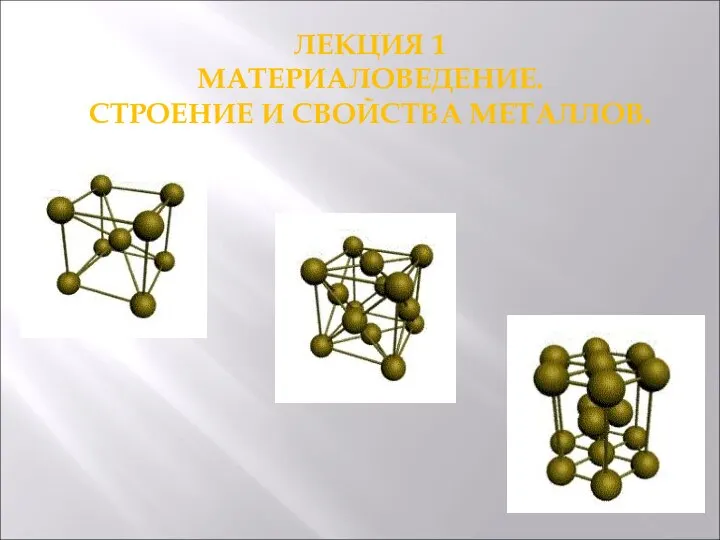 Строение и свойства металлов. Материаловедение. Лекция 1
Строение и свойства металлов. Материаловедение. Лекция 1