Содержание
- 2. Химияның негізгі заңдары Масса сақталу заңы; энергия сақталу заңы; құрам тұрақтылық заңы; еселік және көлемдік қатынастар
- 3. Атом құрылысы туралы жалпы түсінік Атом – бұл химиялық элементтің химиялық қасиеттерін тасымалдаушы және одан әрі
- 4. Нейтрон санын табу: Аr – атомдық масса N – нейтрон саны Z – реттік нөмірі(протон саны)
- 5. Тізбек: Атом – молекула – зат – дене – материя - планета
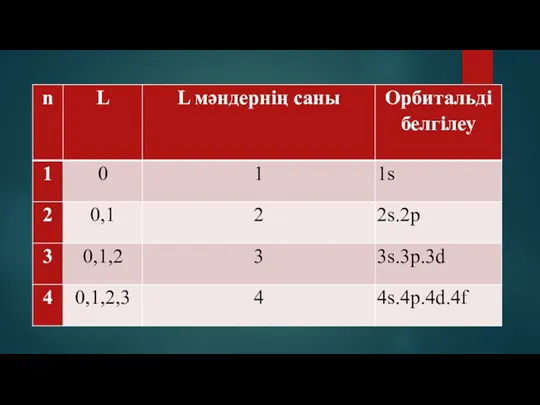
- 6. Кванттық сандар: N – бас квант саны L – орбиталь квант саны M – магнит квант
- 7. Бас квант саны: n электрон энергиясын және электрон қабатының өлшемін анықтайды. Берілген энергетикалық деңгейде электрондардың орналасуын
- 8. Орбиталь квант саны: І Электрон бұлттарының пішіні мен электронның энергетикалық жағдайын сипаттайды. S,p,d,f,g,h электронды деңгейшелерге сәйкес
- 10. Сәйкес келетін электрондар: L = 0, s – электрондар деп аталады. L = 1, p –
- 11. Магнит квант саны: m Орбитальдардың жалпы санын және олардың атом кеңістігінде орналасу ретін көрсетеді. m =
- 13. Спин квант саны: s Электронның өз осі бойынша айналу қозғалысын сипаттайды. Сағат тілі және сағат тіліне
- 14. Энергетикалық деңгейшедегі электрондардың максималды саны: S – деңгейшесінде s2 P – деңгейшесінде p6 D – деңгейшесінде
- 15. Атомды орбитальдарды электрондармен толтыру принциптері: Паули принципі. Клечковский ережесі. Гунд(Хунд) ережесі.
- 16. Паули принципі: Атомда барлық квант сандарының мәндері бірдей болуы мүмкін емес.Екі электрон кем дегенде бір квант
- 17. Клячковский ережесі: аз деңгейшелер бірінші толтырылады. 4s – деңгейше N+l=4+0=4 3d – деңгейше N+l=3+2=5 5s –
- 19. Скачать презентацию















 Лекция 1
Лекция 1 Учебный курс_Политех_1
Учебный курс_Политех_1 Наш девиз: «Каждому сердцу ребёнка – свой ключик!»
Наш девиз: «Каждому сердцу ребёнка – свой ключик!» Обучение Microsoft Access 2010
Обучение Microsoft Access 2010 Сценарий театрализованного представления. Структура и форма записи
Сценарий театрализованного представления. Структура и форма записи А.С.Пушкин «Барышня-крестьянка»
А.С.Пушкин «Барышня-крестьянка» Презентация к уроку обучения грамоте (чтение) в 1 «В» классе«Праздник в первый школьный день!»
Презентация к уроку обучения грамоте (чтение) в 1 «В» классе«Праздник в первый школьный день!»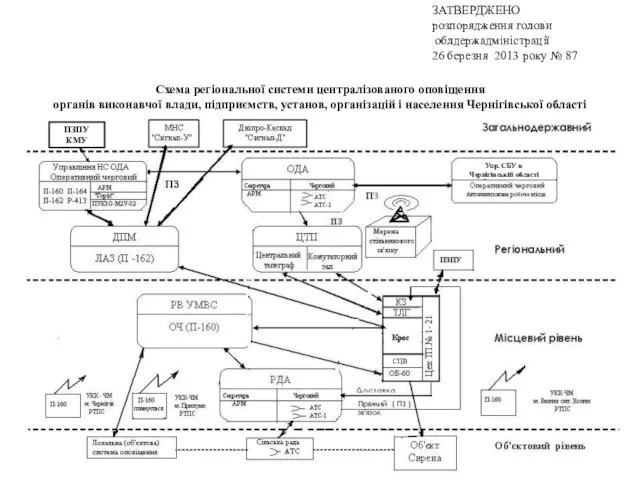 Схема регіональної системи централізованого оповіщення органів виконавчої влади, підприємств, установ
Схема регіональної системи централізованого оповіщення органів виконавчої влади, підприємств, установ Безударные гласные в корне слова (1 класс)
Безударные гласные в корне слова (1 класс) Сандро Боттичелли (1475-1510)
Сандро Боттичелли (1475-1510) Сложение в пределах 10
Сложение в пределах 10 Презентация на тему Топологии компьютерных сетей
Презентация на тему Топологии компьютерных сетей  Основные понятия изобразительного искусства
Основные понятия изобразительного искусства Marvel Comics
Marvel Comics Философия жизни С.А. Новгородова как способ формирования жизнеспособного поколения
Философия жизни С.А. Новгородова как способ формирования жизнеспособного поколения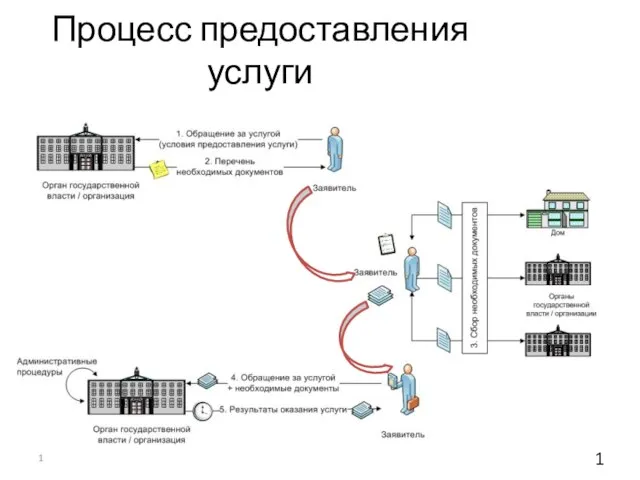 Процесс предоставления услугидо 1.10.2011 г.
Процесс предоставления услугидо 1.10.2011 г. Презентация на тему Творчество А.И Куприна
Презентация на тему Творчество А.И Куприна Предупреждение преступлений и административных правонарушений органами внутренних дел
Предупреждение преступлений и административных правонарушений органами внутренних дел Ювелирное искусство Древнего Египта
Ювелирное искусство Древнего Египта Весёлая таблица умножения (числа 1 – 4)
Весёлая таблица умножения (числа 1 – 4) Синтез наночастиц серебра
Синтез наночастиц серебра Презентация на тему Электролиты
Презентация на тему Электролиты Стандартизация образования: проблемы и перспективы их решения
Стандартизация образования: проблемы и перспективы их решения Что представляет собой моногибридное скрещивание? Скрещивание особей отличающихся по двум признакам. Скрещивание особей отличаю
Что представляет собой моногибридное скрещивание? Скрещивание особей отличающихся по двум признакам. Скрещивание особей отличаю Положительный опыт влияния совершенствования управления на повышение инвестиционной привлекательности предприятия на примере Г
Положительный опыт влияния совершенствования управления на повышение инвестиционной привлекательности предприятия на примере Г Физические качества: сила, быстрота, выносливость, гибкость, координация
Физические качества: сила, быстрота, выносливость, гибкость, координация Технология таможенного контроля товаров, перемещаемых физическими лицами
Технология таможенного контроля товаров, перемещаемых физическими лицами Рамада
Рамада