Содержание
- 2. План Классификация соединительной ткани Функции соединительной ткани. Химический состав соединительной ткани Морфологическая и биохимическая характеристика компонентов
- 3. КЛАССИФИКАЦИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ 1. волокнистая ткань: а). рыхлая неоформленная (образует строму многих органов, адвентициальная оболочка сосудов,
- 4. ФУНКЦИИ СОЕДИНИТЕЛЬНОЙ ТКАНИ опорная — кости, хрящи, связки и сухожилия; транспортная — кровь и лимфа; защитная
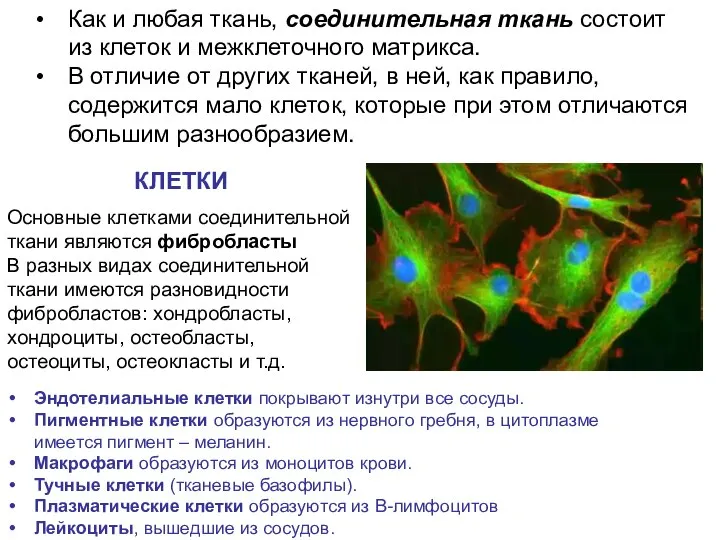
- 5. Как и любая ткань, соединительная ткань состоит из клеток и межклеточного матрикса. В отличие от других
- 6. МЕЖКЛЕТОЧНЫЙ МАТРИКС В отличие от других тканей, в соединительной ткани, как правило, преобладает межклеточный матрикс. Межклеточный
- 7. Функция межклеточного матрикса образует каркас органов и тканей; является универсальным «биологическим» клеем; участвует в регуляции водно-солевого
- 8. Химический состав межклеточного матрикса 1). Коллагеновые и эластиновые волокна. Они придают ткани механическую прочность, препятствуя ее
- 9. Химический состав соединительной ткани вода (63%.) плотные вещества (37%), из них: коллаген 85% эластин 4,4% ретикулин
- 10. Особенности обмена соединительной ткани Разные виды соединительной ткани существенно отличаются по выполняемым функциям и имеют заметные
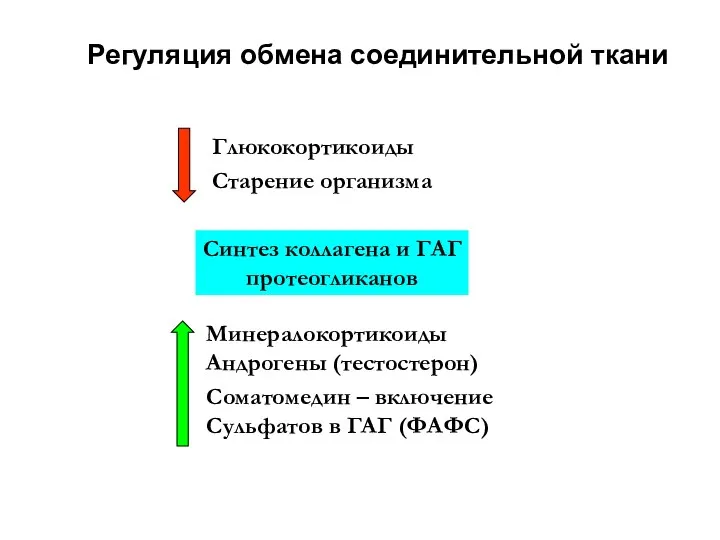
- 11. Регуляция обмена соединительной ткани Синтез коллагена и ГАГ протеогликанов Глюкокортикоиды Старение организма Минералокортикоиды Андрогены (тестостерон) Соматомедин
- 12. Старение соединительной ткани уменьшение содержания Н2О и отношения основное вещество/волокна снижение содержания гиалуроновой кислоты изменение соотношение
- 13. Свойства 1. высокая эластичность (эластин), 2. высокая прочность (коллаген), 3. волокнистость, 4. плохая растворимость в воде,
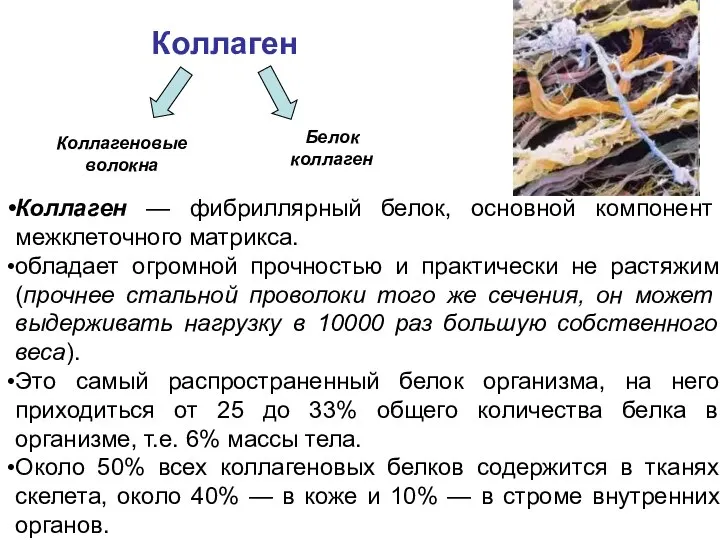
- 14. Коллаген — фибриллярный белок, основной компонент межклеточного матрикса. обладает огромной прочностью и практически не растяжим (прочнее
- 15. Под коллагеном-белком понимают два вещества: тропоколлаген и проколлаген. тропоколлаген состоит из 3 α-цепей. Известно около 30
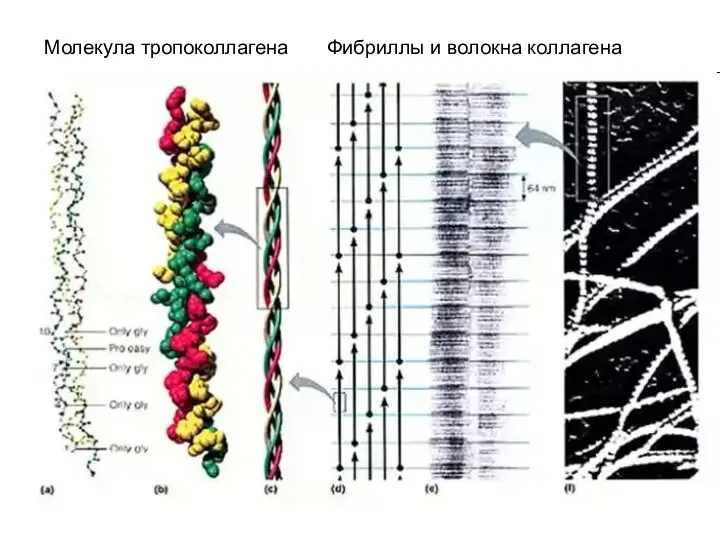
- 16. Молекула тропоколлагена Фибриллы и волокна коллагена
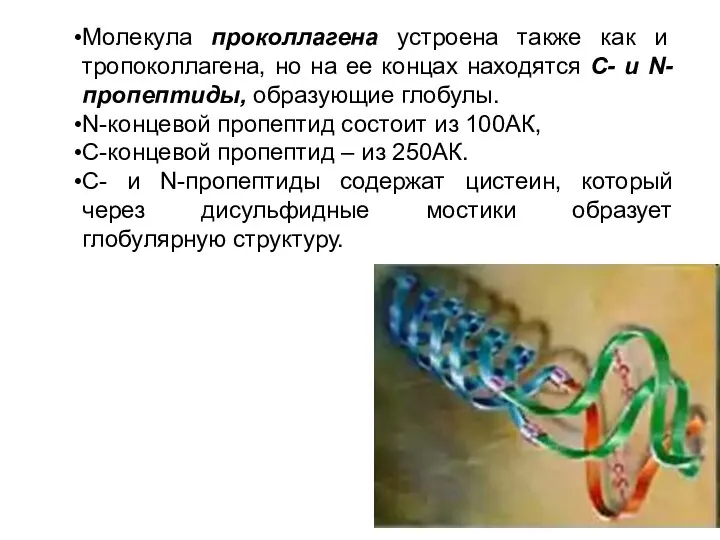
- 17. Молекула проколлагена устроена также как и тропоколлагена, но на ее концах находятся С- и N-пропептиды, образующие
- 18. Виды коллагена Известно 19 типов коллагена, которые отличаются по первичной структуре цепей, функциям и локализации в
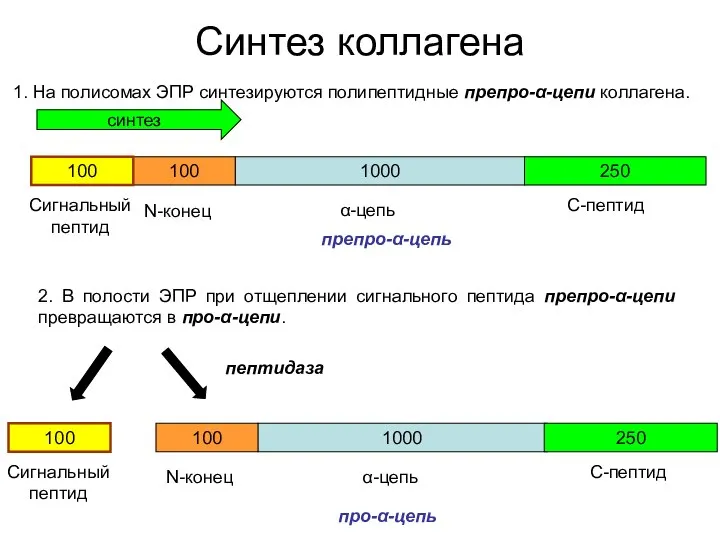
- 19. Синтез коллагена 1. На полисомах ЭПР синтезируются полипептидные препро-α-цепи коллагена. 1000 100 100 250 Сигнальный пептид
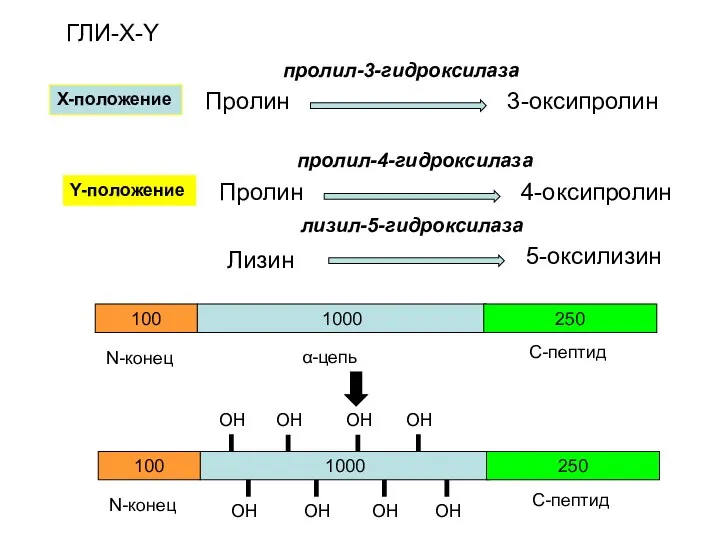
- 20. 1000 100 250 N-конец α-цепь С-пептид 1000 100 250 N-конец С-пептид ОН ОН ОН ОН ОН
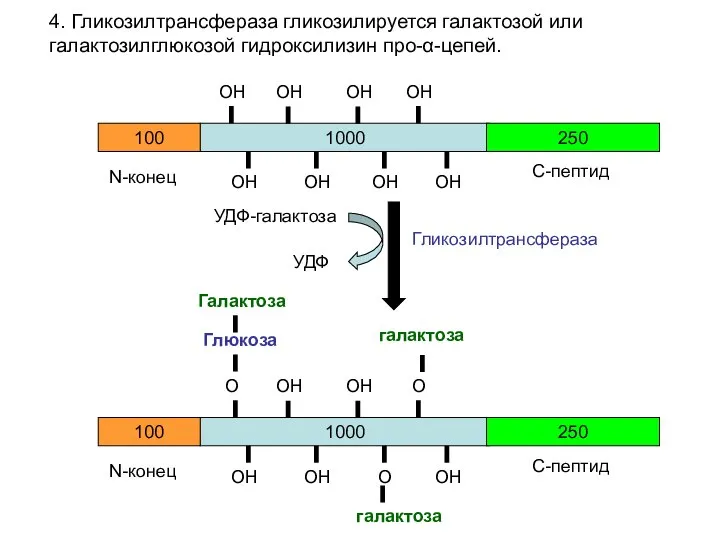
- 22. 4. Гликозилтрансфераза гликозилируется галактозой или галактозилглюкозой гидроксилизин про-α-цепей. 1000 100 250 N-конец С-пептид ОН ОН ОН
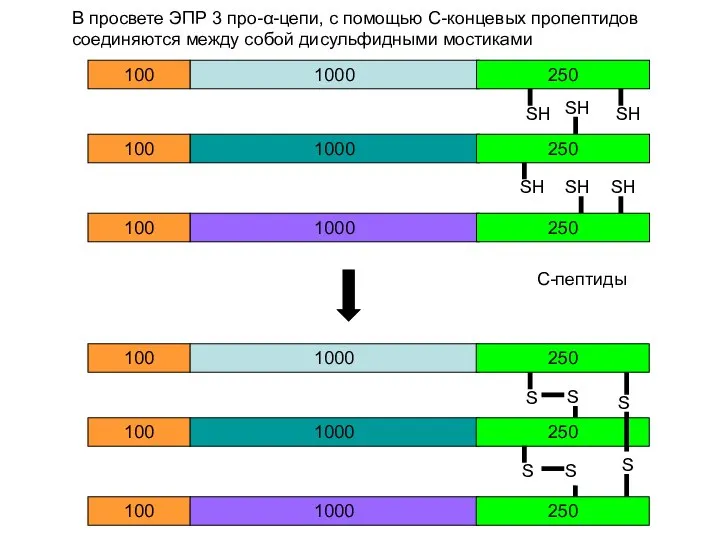
- 23. 1000 100 250 1000 100 250 1000 100 250 SH SH SH SH 1000 100 250
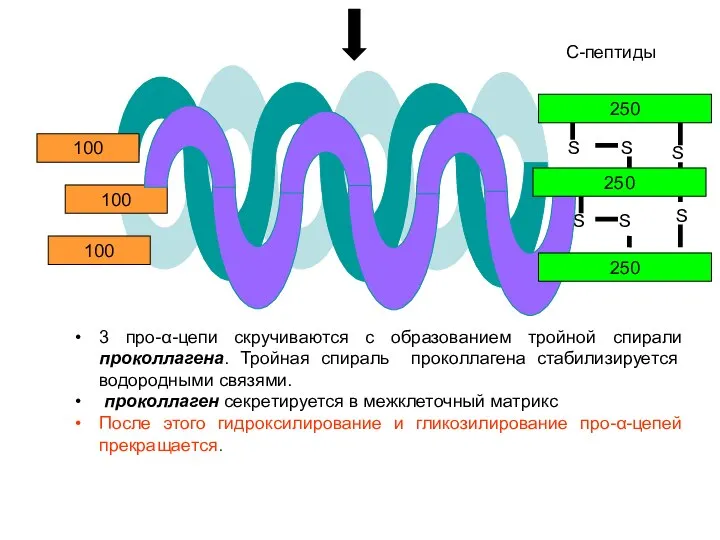
- 24. S S S S S S 250 100 100 100 3 про-α-цепи скручиваются с образованием тройной
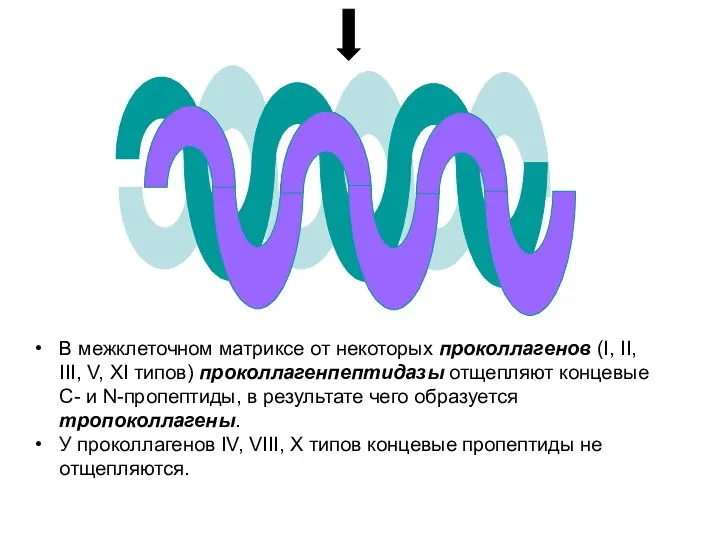
- 25. В межклеточном матриксе от некоторых проколлагенов (I, II, III, V, XI типов) проколлагенпептидазы отщепляют концевые С-
- 27. Катаболизм коллагена Время полужизни (Т1/2) – недели –месяцы. Скорость биосинтеза и деградации сбалансированы. Распад – специальный
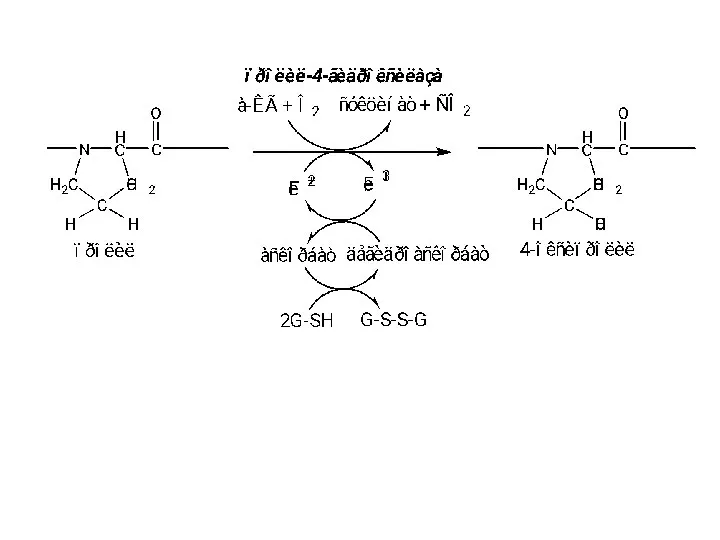
- 28. нарушение процесса гидроксилирования коллаген при цинге Коллаген, синтезированный при дефиците аскорбиновой кислоты, недогидроксилирован и имеет пониженную
- 29. Старение коллагена увеличение числа и прочности внутри- и межмолекулярных поперечных связей, снижение эластичности и способности к
- 30. Эластин — основной белок эластических волокон в больших количествах содержится в межклеточном веществе кожи, стенок кровеносных
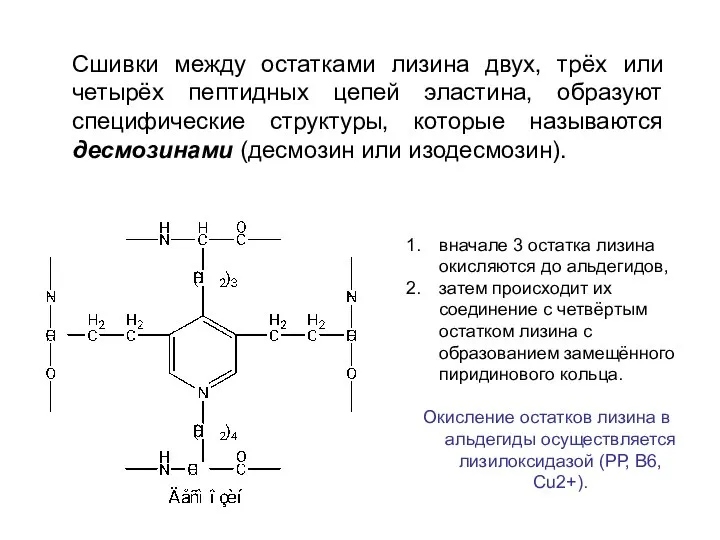
- 31. вначале 3 остатка лизина окисляются до альдегидов, затем происходит их соединение с четвёртым остатком лизина с
- 32. Катаболизм эластина происходит при участии очень активной эластазы нейтрофилов. Особое значение это имеет в лёгких, поскольку
- 33. Патология эластина Снижение активности лизилоксидазы наследственное или приобретенное (дефицит меди, пиридоксина), приводит к снижению или прекращению
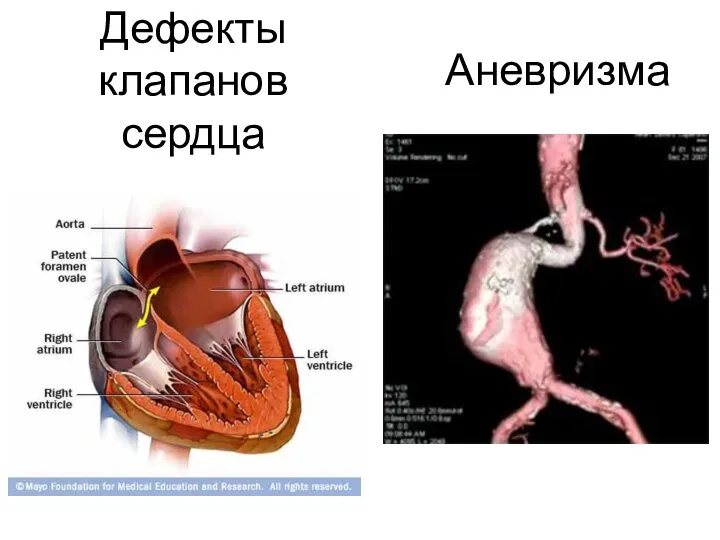
- 34. Аневризма Дефекты клапанов сердца
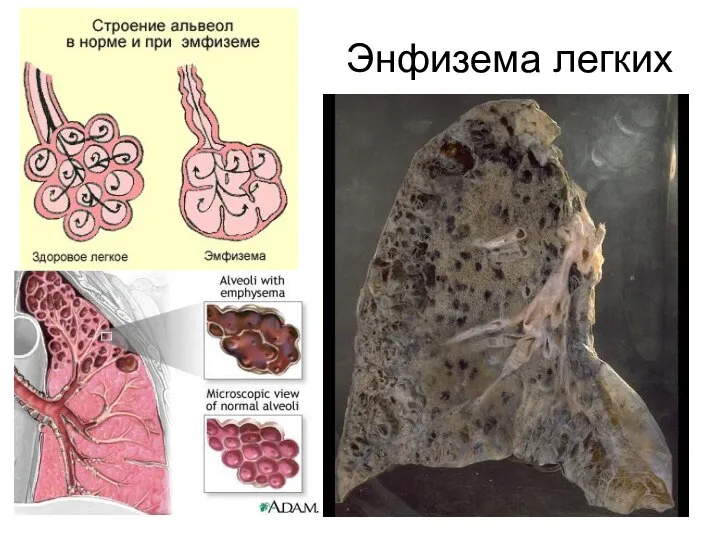
- 35. Энфизема легких
- 36. Линейные гетерополисахариды, состоят из повторяющиеся димеров, могут связывать большие количества воды, в результате чего межклеточное вещество
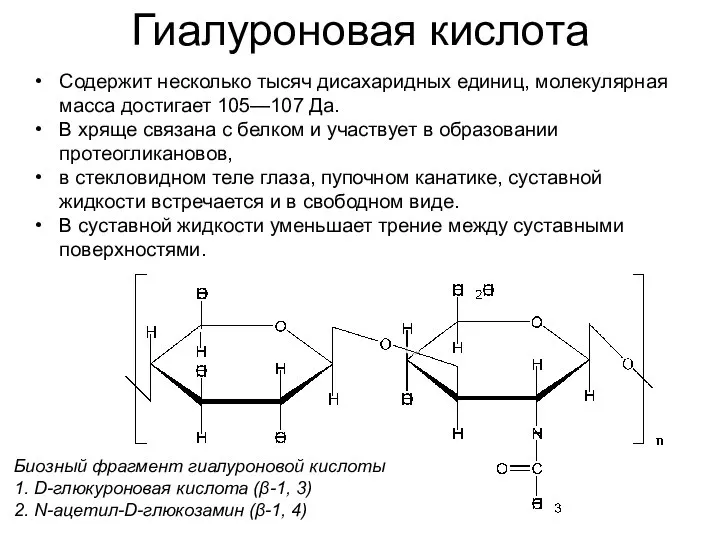
- 37. Гиалуроновая кислота Биозный фрагмент гиалуроновой кислоты 1. D-глюкуроновая кислота (β-1, 3) 2. N-ацетил-D-глюкозамин (β-1, 4) Содержит
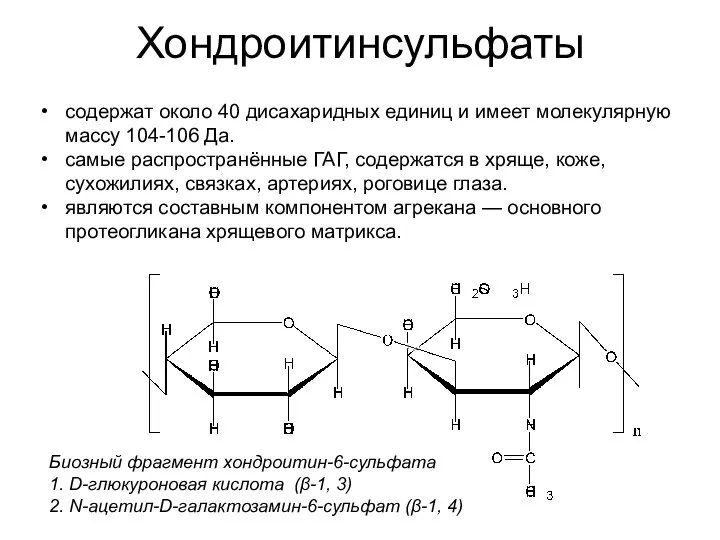
- 38. Хондроитинсульфаты Биозный фрагмент хондроитин-6-сульфата 1. D-глюкуроновая кислота (β-1, 3) 2. N-ацетил-D-галактозамин-6-сульфат (β-1, 4) содержат около 40
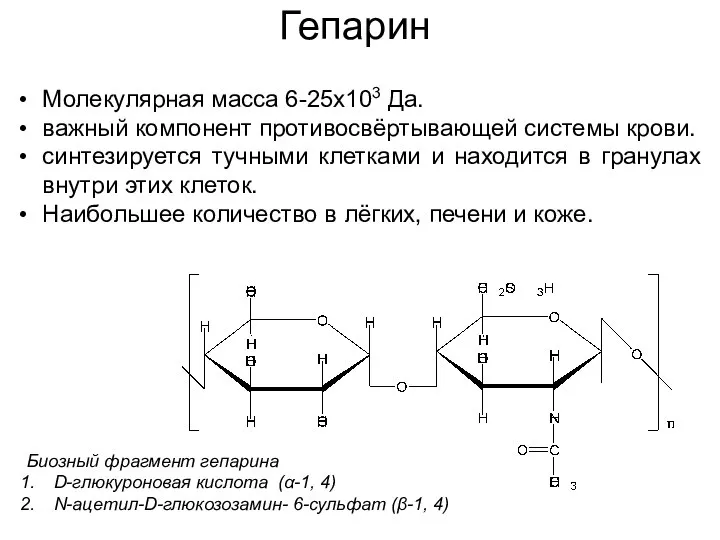
- 39. Гепарин Биозный фрагмент гепарина D-глюкуроновая кислота (α-1, 4) N-ацетил-D-глюкозозамин- 6-сульфат (β-1, 4) Молекулярная масса 6-25х103 Да.
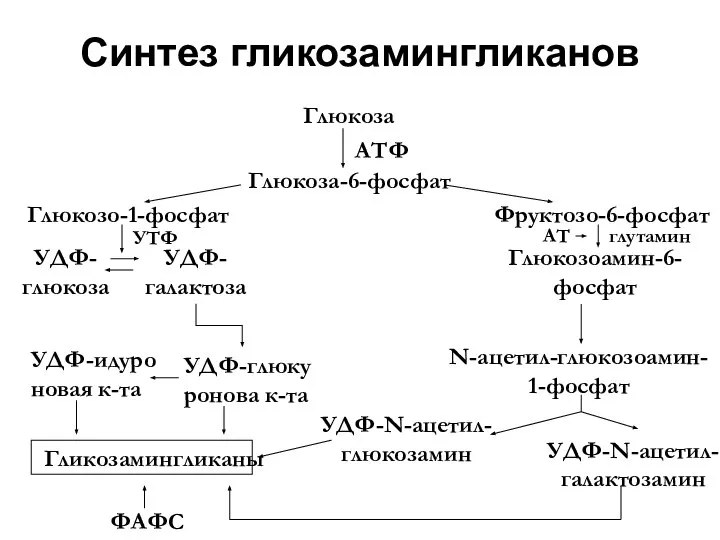
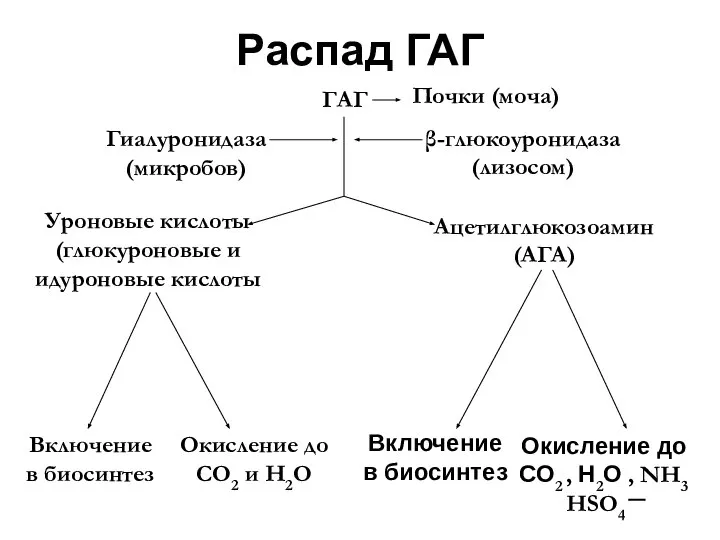
- 40. Синтез осуществляется в ЭПР фибробластов с участием: УТФ, ацетил КоА, ФАФС и других метаболитов. Распад ГАГ
- 41. Синтез гликозамингликанов
- 42. Распад ГАГ
- 43. Протеогликаны - белки промежуточного вещества состав гликозоаминогликаны (ГАГ-95%) и белки - альбумины и глобулины (5%)
- 44. Заболевания соединительной ткани (Коллагенозы) Системная красная волчанка (СКВ). Системная склеродермия. Дерматомиозиты. Болезнь Шегрена. Синдром Рейтера. Ревматизм.
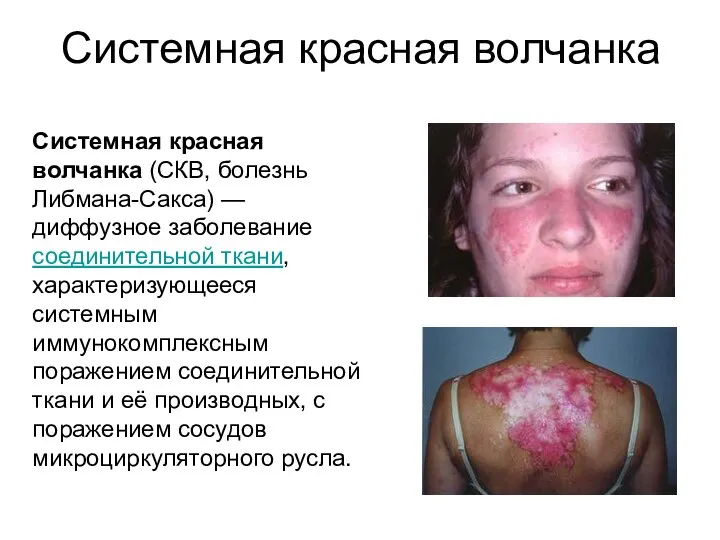
- 45. Системная красная волчанка Системная красная волчанка (СКВ, болезнь Либмана-Сакса) — диффузное заболевание соединительной ткани, характеризующееся системным
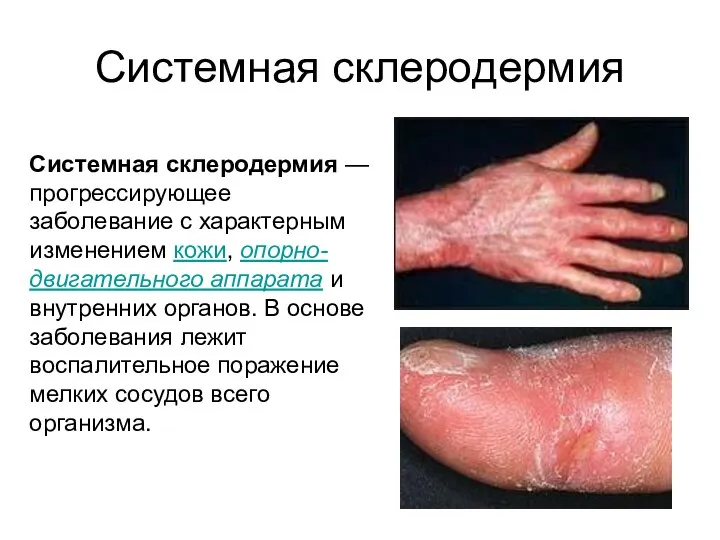
- 46. Системная склеродермия Системная склеродермия — прогрессирующее заболевание с характерным изменением кожи, опорно-двигательного аппарата и внутренних органов.
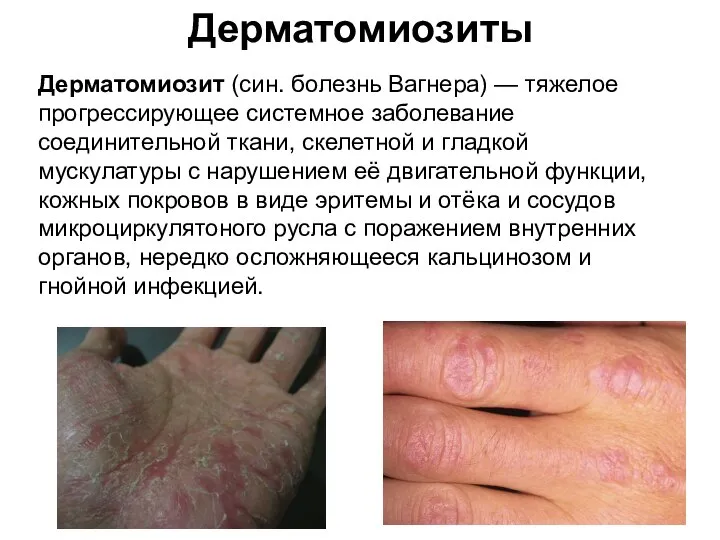
- 47. Дерматомиозиты Дерматомиозит (син. болезнь Вагнера) — тяжелое прогрессирующее системное заболевание соединительной ткани, скелетной и гладкой мускулатуры
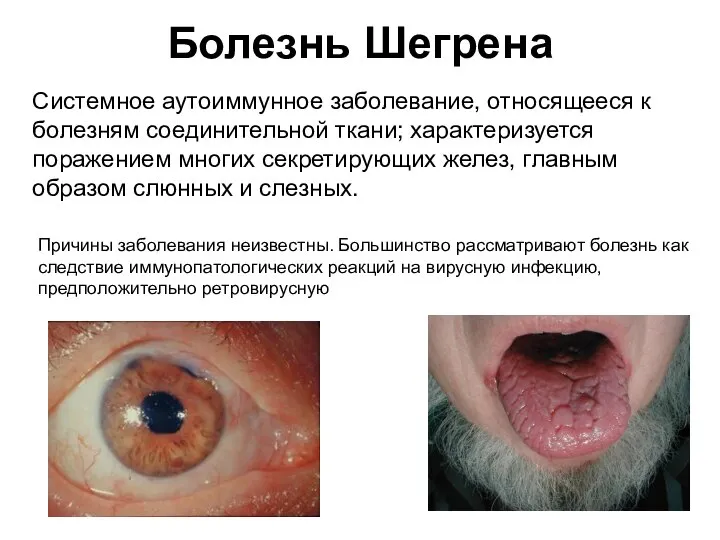
- 48. Болезнь Шегрена Системное аутоиммунное заболевание, относящееся к болезням соединительной ткани; характеризуется поражением многих секретирующих желез, главным
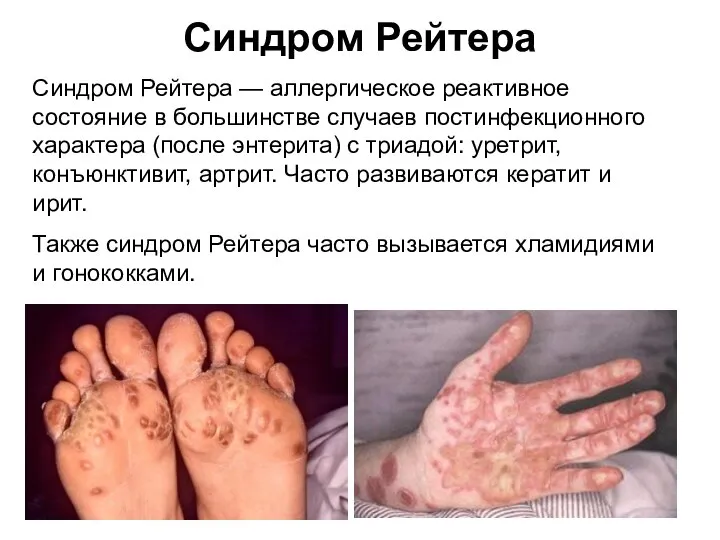
- 49. Синдром Рейтера Синдром Рейтера — аллергическое реактивное состояние в большинстве случаев постинфекционного характера (после энтерита) с
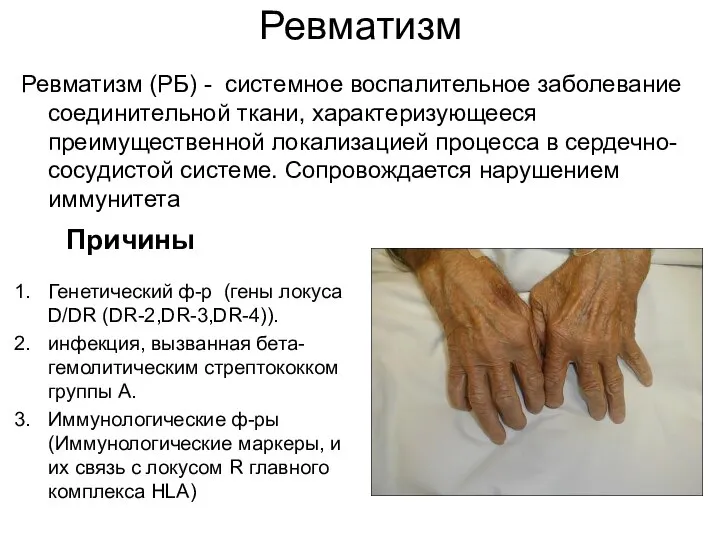
- 50. Ревматизм Ревматизм (РБ) - системное воспалительное заболевание соединительной ткани, характеризующееся преимущественной локализацией процесса в сердечно-сосудистой системе.
- 51. Клиника ревматизма Большие критерии: кардит, полиартрит, малая хорея, кольцевидная эритема, ревматические узелки. Малые критерии: наличие в
- 52. Наследственные болезни соединительной ткани - «лизосомные болезни» - энзимопатии лизосомных ферментов, ответственных за распад гликозоамингликанов (ГАГ)
- 53. Наследственные коллагенозы
- 54. Тесты лабораторной диагностики при заболеваниях соединительной ткани СОЭ ↑; эритроциты (гиперхромная анемия), ↑,↓; лейкоциты (N,↑,↓ );
- 55. СРБ ( альфа- глобулин )↑; Fе ↓ ; Сu↑ ; комплемент (в большинстве случаев)↑; LЕ -
- 56. В суставной жидкости: белок ↑ ; ревматоидный фактор↑; лейкоциты↑; фагоциты ↑; коллагеназа суставной жидкости и крови
- 57. Эритроциты ↓; Лейкоциты ↑(сдвиг влево); СОЭ ↑ ; α2 глобулин (СРБ, церуллоплазмин, гаптоглобин) ↑; α1 серомукоид
- 58. атистрептолизин-О ↑; антистрептогиалуронидаза ↑; антистрептокиназа ↑; оксипролин крови и мочи ↑; трансаминазы (АСТ, АЛТ) ↑; КФК
- 59. Хондропротекторы
- 60. 1. препараты, содержащие хондроитинсульфат. Участвует в образовании основного вещества соединительной ткани. Из хрящей крупного рогатого скота
- 62. Скачать презентацию

































 Презентация на тему Скелет строение и состав костей
Презентация на тему Скелет строение и состав костей  Физиологические механизмы регуляции вегетативных функций и инстинктивного поведения
Физиологические механизмы регуляции вегетативных функций и инстинктивного поведения Сцепленное наследование генов. ЕГЭ по биологии, 28 задача
Сцепленное наследование генов. ЕГЭ по биологии, 28 задача Кровеносная система. Движение крови и лимфы в организме
Кровеносная система. Движение крови и лимфы в организме Биосоциальная сущность человека
Биосоциальная сущность человека Красная книга Самарской области. Боярышник волжский
Красная книга Самарской области. Боярышник волжский Гербарий
Гербарий Защита сельскохозяйственных культур от колорадского жука
Защита сельскохозяйственных культур от колорадского жука Тип членистоногие. Класс ракообразные
Тип членистоногие. Класс ракообразные Физиология питания
Физиология питания Сравнительная характеристика вкусовых качеств брюквы старых и новых сортов
Сравнительная характеристика вкусовых качеств брюквы старых и новых сортов Позвоночные животные
Позвоночные животные Необычные растения материка Евразия
Необычные растения материка Евразия Фитогормональная регуляция
Фитогормональная регуляция ePVrDio9nVaPfLAnvMvOYQ_pptx
ePVrDio9nVaPfLAnvMvOYQ_pptx Мутации в природе
Мутации в природе Скрининг перспективных пробиотических штаммов бактерий Bacillus spp., выделенных из микробиоты здоровых кур
Скрининг перспективных пробиотических штаммов бактерий Bacillus spp., выделенных из микробиоты здоровых кур Техническая энтомология
Техническая энтомология Lektsia_6_7_PsGen
Lektsia_6_7_PsGen Популяция как эколого-генетическая система
Популяция как эколого-генетическая система Биологическое действие радиации
Биологическое действие радиации Муравьи. Виды муравьёв
Муравьи. Виды муравьёв Породы кошек
Породы кошек Менингиомы передней черепной ямки
Менингиомы передней черепной ямки Внекишечное пищеварение: важные закономерности
Внекишечное пищеварение: важные закономерности Насекомые
Насекомые Головной мозг
Головной мозг Голо- и Покрытосеменные
Голо- и Покрытосеменные