Содержание
- 2. Cодержание Синтез и катаболизм коллагена. Заболевания, связанные с нарушением синтеза и созревания коллагена Синтез и катаболизм
- 3. ЭТАПЫ СИНТЕЗА И СОЗРЕВАНИЯ КОЛЛАГЕНА Коллаген синтезируют и поставляют в межклеточный матрикс почти все клетки (фибробласты,
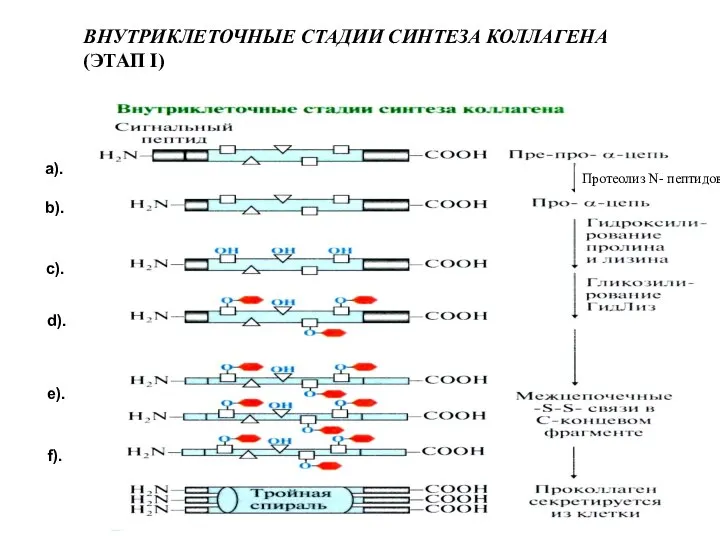
- 4. ВНУТРИКЛЕТОЧНЫЕ СТАДИИ СИНТЕЗА КОЛЛАГЕНА (ЭТАП I) Протеолиз N- пептидов а). b). c). d). e). f).
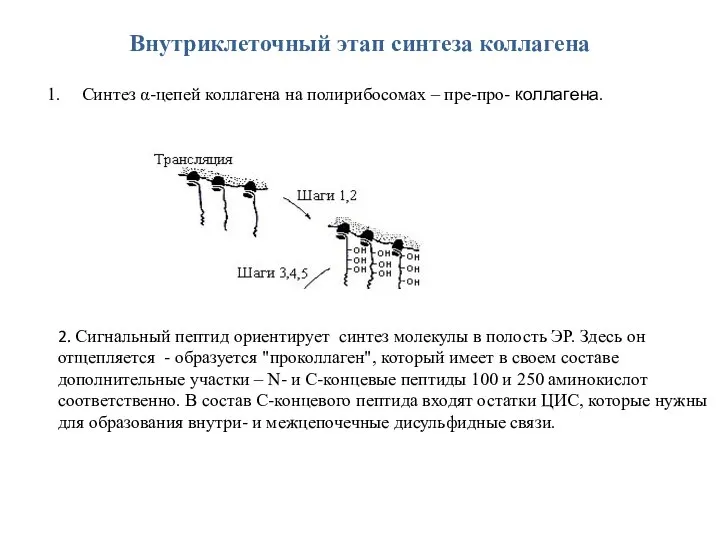
- 5. Внутриклеточный этап синтеза коллагена Синтез α-цепей коллагена на полирибосомах – пре-про- коллагена. 2. Сигнальный пептид ориентирует
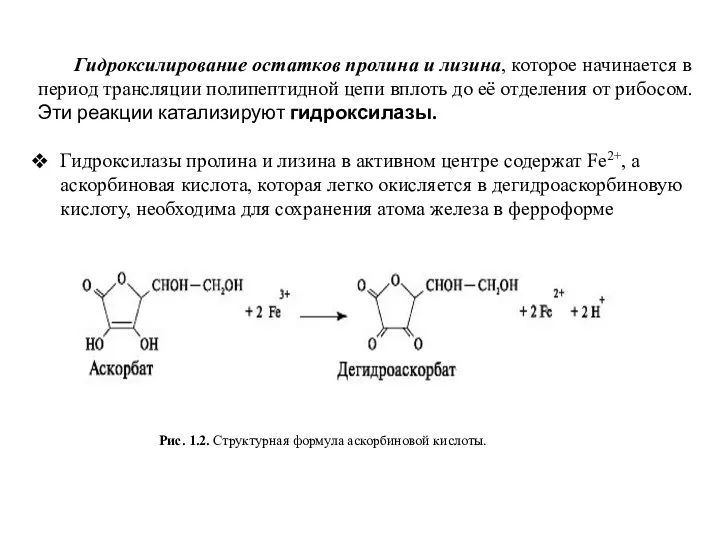
- 6. Рис. 1.2. Структурная формула аскорбиновой кислоты. Гидроксилирование остатков пролина и лизина, которое начинается в период трансляции
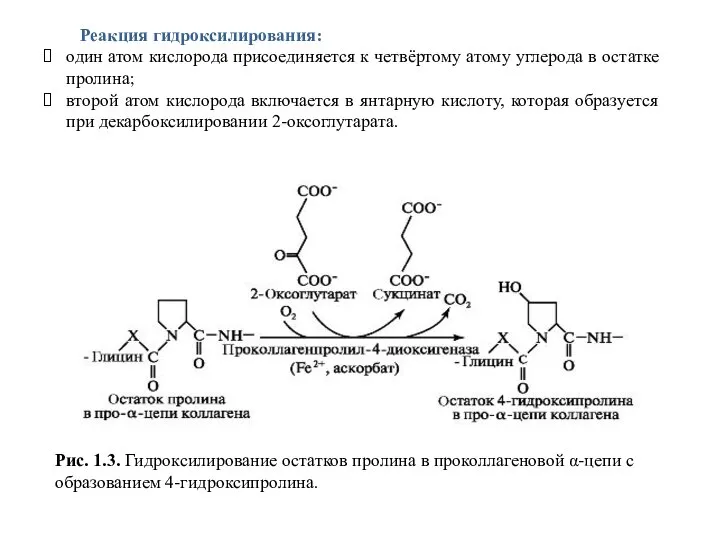
- 7. Рис. 1.3. Гидроксилирование остатков пролина в проколлагеновой α-цепи с образованием 4-гидроксипролина. Реакция гидроксилирования: один атом кислорода
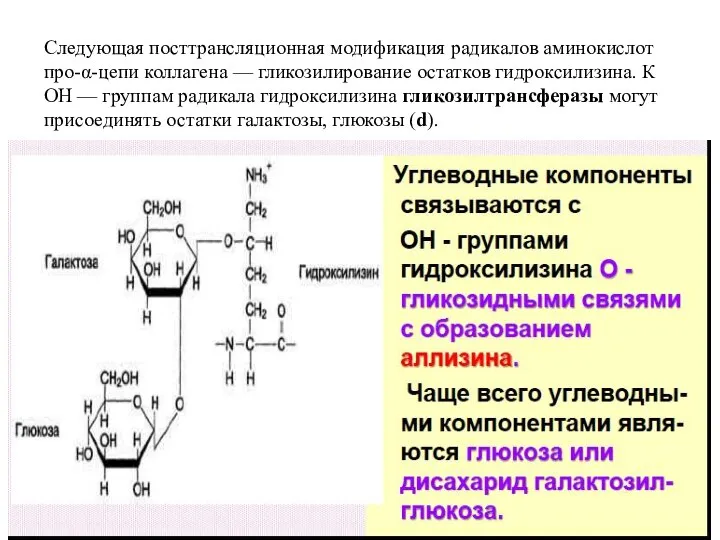
- 9. Следующая посттрансляционная модификация радикалов аминокислот про-α-цепи коллагена — гликозилирование остатков гидроксилизина. К ОН — группам радикала
- 10. По окончании гидроксилирования и гликозилирования три про-α-цепи коллагена соединяются между собой водородными связями, в С- концевых
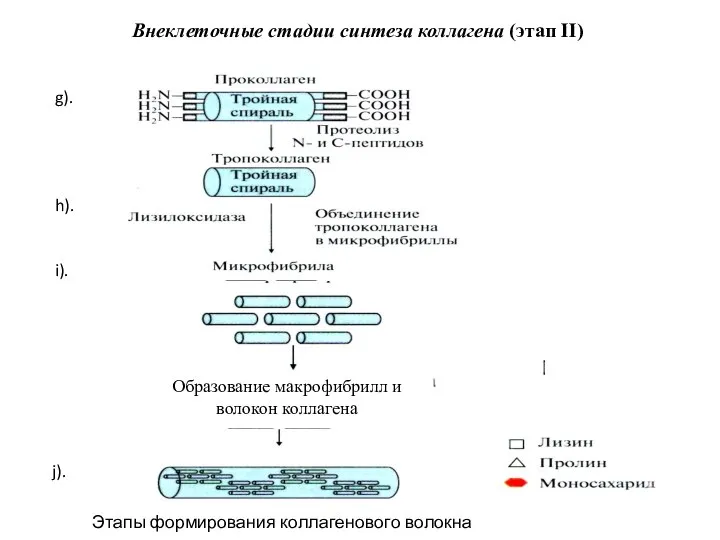
- 11. Внеклеточные стадии синтеза коллагена (этап II) g). h). i). Микрофибриллы Образование макрофибрилл и волокон коллагена j).
- 12. Первой модификацией внеклеточного этапа является частичный протеолиз. Под действием аминопептидазы и карбоксипептидазы отщепляются N- и С-концевые
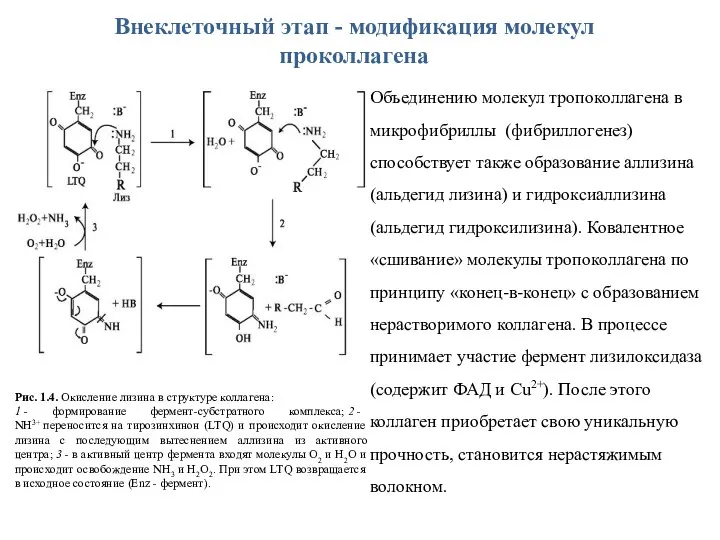
- 13. Внеклеточный этап - модификация молекул проколлагена Рис. 1.4. Окисление лизина в структуре коллагена: 1 - формирование
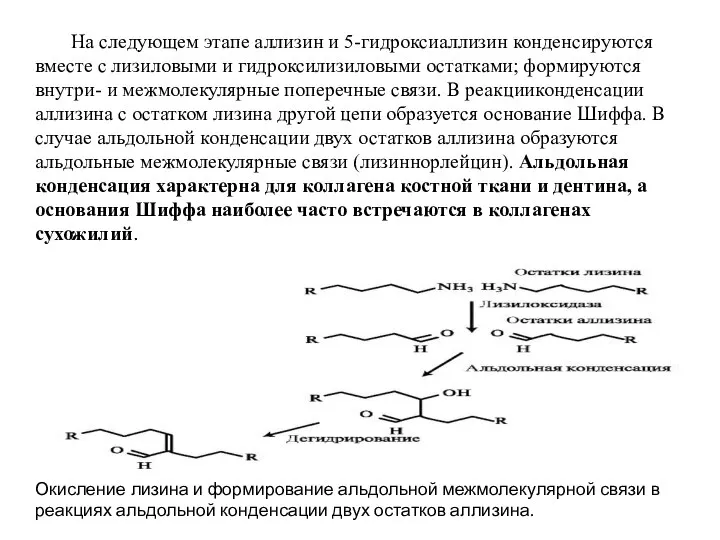
- 14. На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и
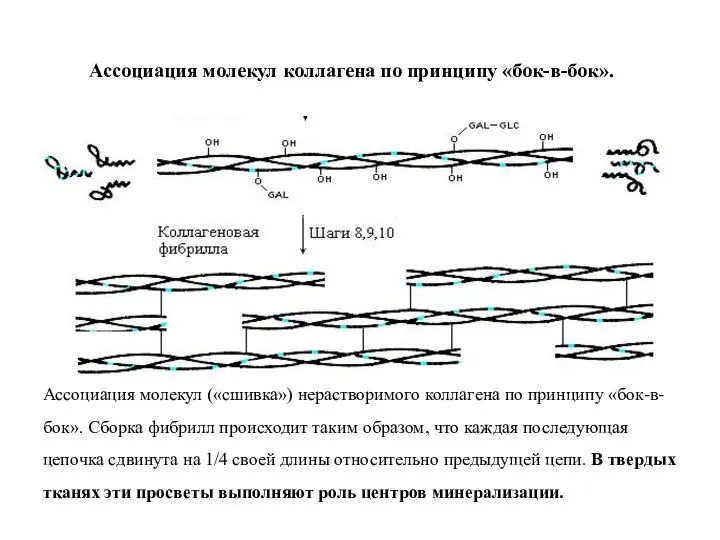
- 15. Ассоциация молекул коллагена по принципу «бок-в-бок». Ассоциация молекул («сшивка») нерастворимого коллагена по принципу «бок-в-бок». Сборка фибрилл
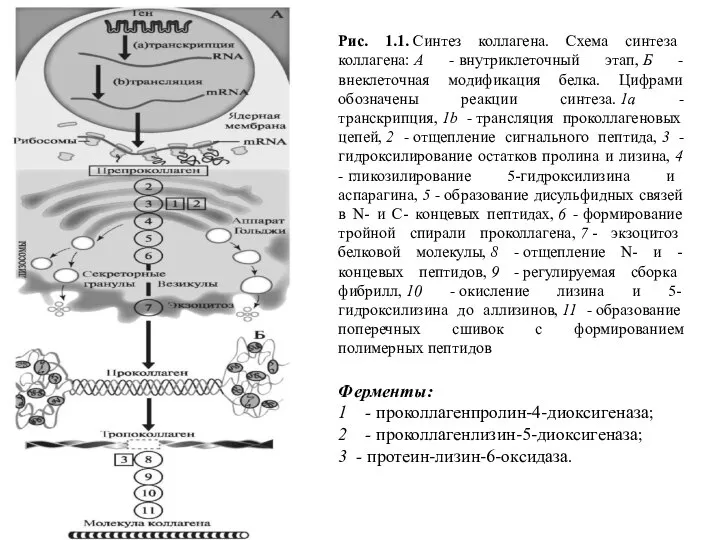
- 16. Ферменты: 1 - проколлагенпролин-4-диоксигеназа; 2 - проколлагенлизин-5-диоксигеназа; 3 - протеин-лизин-6-оксидаза. Рис. 1.1. Синтез коллагена. Схема синтеза
- 17. Прочность соединения молекул тропоколлагена в микрофибриллах обеспечивается поперечными ковалентными сшивками, которые образуются между радикалами аминокислот —
- 18. Все типы коллагенов в зависимости от структуры делят на несколько групп: фибриллообразующие, ассоциированные с фибриллами коллагена,
- 19. Типы коллагеновых белков в тканях полости рта Таблица 1.1 Локализация основных типов коллагеновых белков в тканях
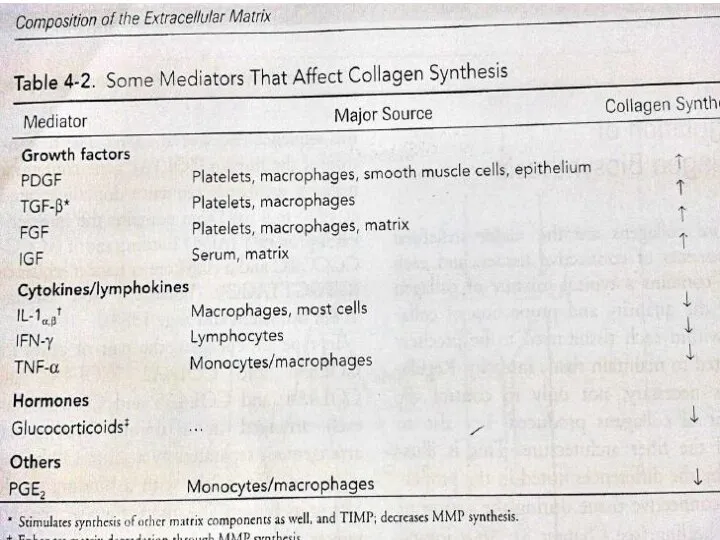
- 20. Регуляция обмена коллагена Синтез коллагена регулируется разными способами. Сам коллаген и N-npo-пептиды после своего отщепления тормозят
- 24. Нарушение синтеза коллагеновых белков у человека Любые нарушения в синтезе коллагеновых белков клинически проявляются, в первую
- 25. Структура коллагена при сахарном диабете При сахарном диабете вследствие неспособности клеток захватывать глюкозу из плазмы крови
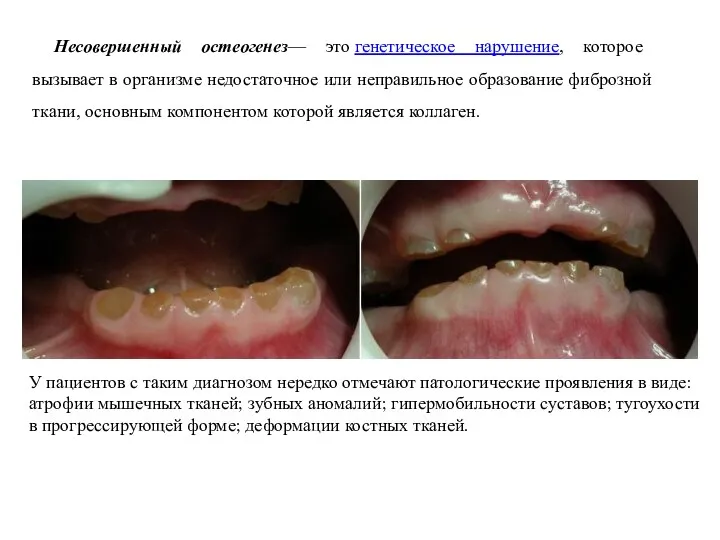
- 26. Несовершенный остеогенез— это генетическое нарушение, которое вызывает в организме недостаточное или неправильное образование фиброзной ткани, основным
- 27. МЕТАБОЛИЗМ ЭЛАСТИНА Синтез эластина: Синтез и созревание белка эластина состоит из двух этапов: внутриклеточный и внеклеточный.
- 28. I. Внутриклеточный этап. Мономерная форма эластина синтезируется на рибосомах, связанных с ЭПР, и называется тропоэластином. В
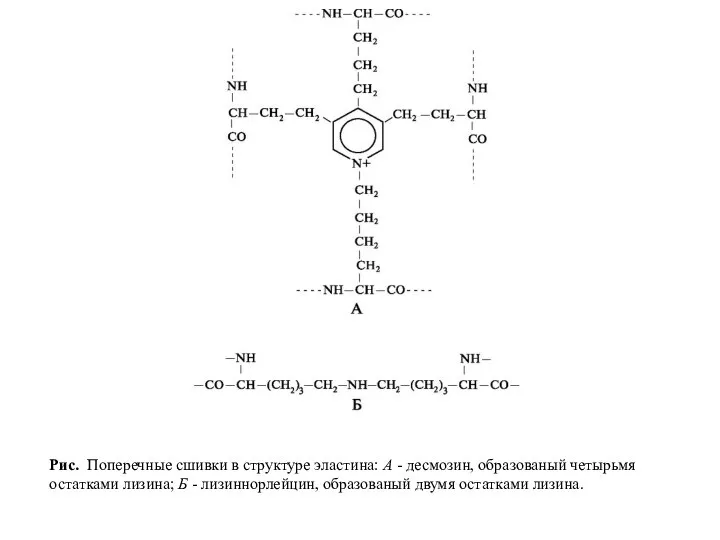
- 29. Рис. Поперечные сшивки в структуре эластина: А - десмозин, образованый четырьмя остатками лизина; Б - лизиннорлейцин,
- 30. Аминокислотный состав эластина: - 27% глицина; - 19% аланина; - 10% валина; - 4,7% лейцина. Благодаря
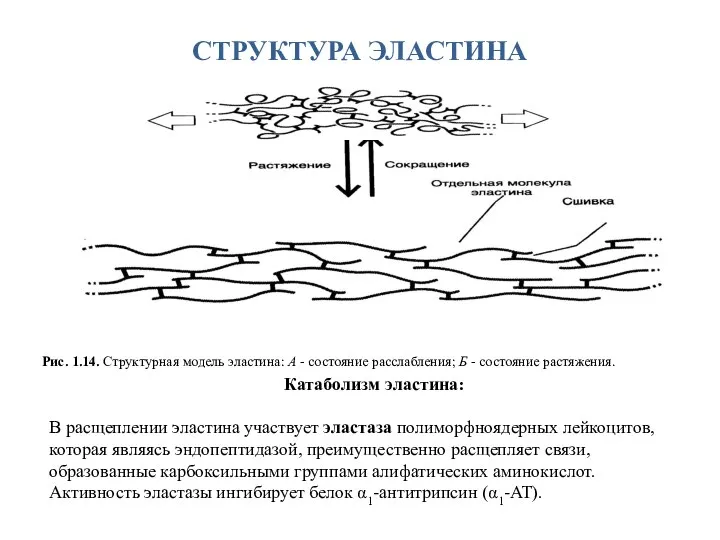
- 31. СТРУКТУРА ЭЛАСТИНА Рис. 1.14. Структурная модель эластина: А - состояние расслабления; Б - состояние растяжения. Катаболизм
- 32. НАРУШЕНИЯ СТРУКТУРЫ ЭЛАСТИНА При снижении образования десмозинов (или их отсутствии) поперечные сшивки образуются в недостаточном количестве
- 33. Состав и строение муцинов (от анг. mucus – слизь) Гликопротеины, в которых много остатков пролина (до
- 34. Синтез муцинов Высокоспециализированные клетки поднижнечелюстных и подъязычных слюнных желез синтезируют белок муцин. В этих клетках хорошо
- 35. Присоединения GalNAc к остаткам серина и треонина обеспечивается GalNAс-трансферазой , происходит в цис-цистернах аппарата Гольджи. После
- 36. В слюне присутствует муцин-1 (Mr 250 кДа) и муцин-2 (Mr 100 кДа). Внутренние поверхности ротовой полости,
- 37. Муцины выполняют специфические функции: Основные белки, обеспечивающие вязкость слюны. Муцины участвуют в образовании мицелл слюны, (помогают
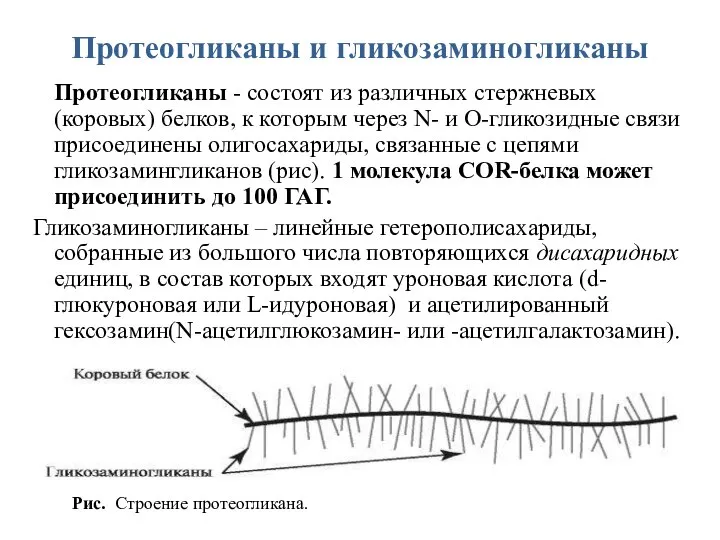
- 38. Протеогликаны и гликозаминогликаны Протеогликаны - состоят из различных стержневых (коровых) белков, к которым через N- и
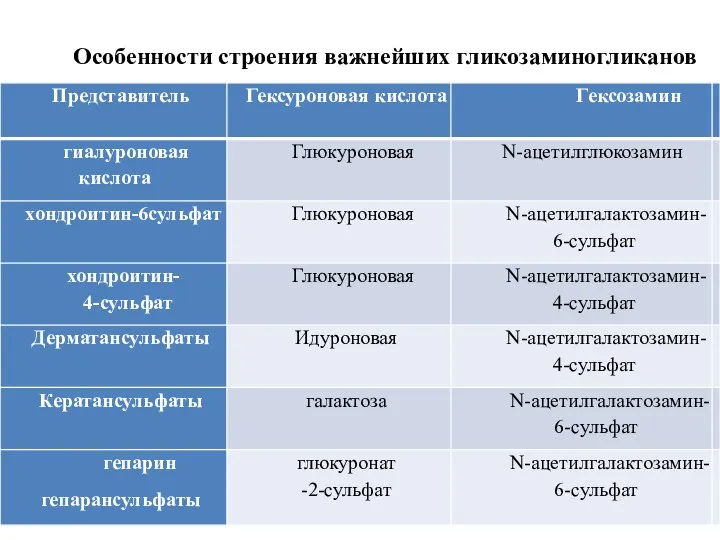
- 39. Особенности строения важнейших гликозаминогликанов
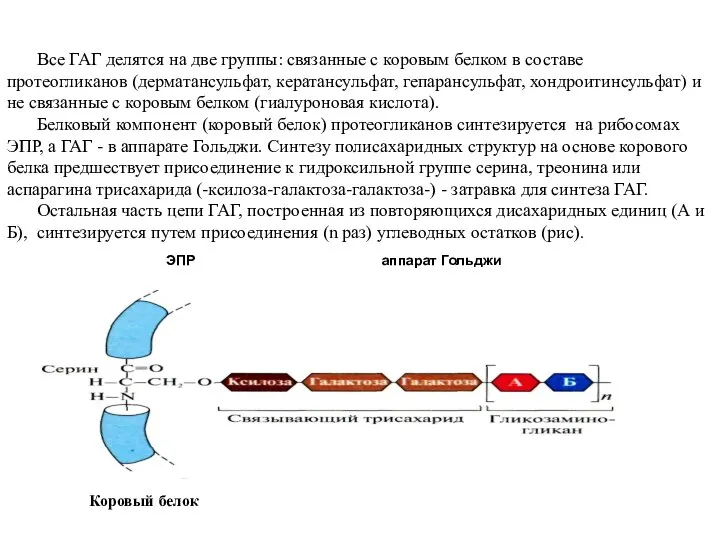
- 40. Все ГАГ делятся на две группы: связанные с коровым белком в составе протеогликанов (дерматансульфат, кератансульфат, гепарансульфат,
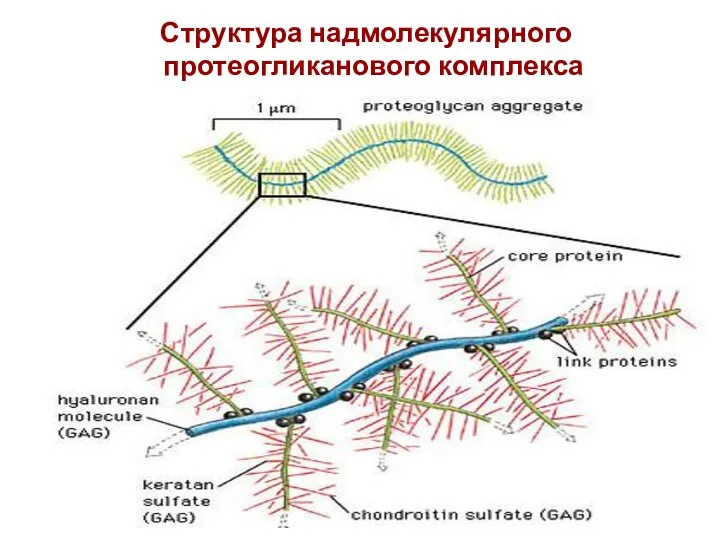
- 41. Структура надмолекулярного протеогликанового комплекса
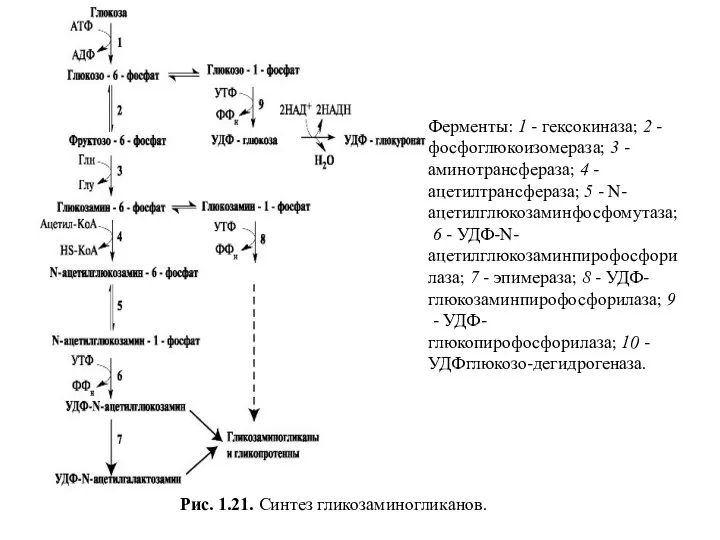
- 44. Аминосахара и гексуроновые кислоты синтезируются из глюкозы. Непосредственным же предшественником N-ацетилглюкозамина и N-ацетилгалактозамина является фруктозо-6-фосфат. Источником
- 45. Рис. 1.21. Синтез гликозаминогликанов. Ферменты: 1 - гексокиназа; 2 - фосфоглюкоизомераза; 3 - аминотрансфераза; 4 -
- 46. Разные протеогликаны отличаются размерами молекул, относительным содержанием белка и набором гликозаминогликанов. Протеогликаны в больших количествах представлены:
- 47. Распад протеогликанов Распад протеогликанов - физиологический процесс, заключающийся в регулярном обновлении внеклеточных и внутриклеточных макромолекул. В
- 48. 2. Распад гликозаминогликанов Гликозаминогликаны отличаются высокой скоростью обмена: полупериод жизни (Т 1/2 ) многих из них
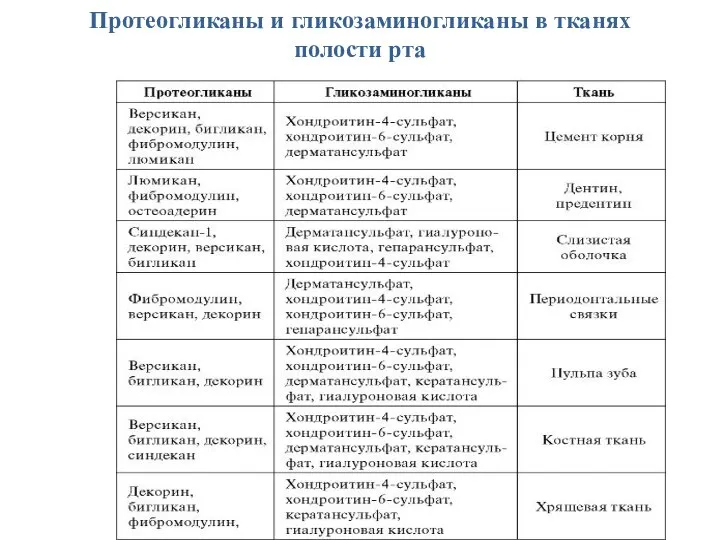
- 49. Протеогликаны и гликозаминогликаны в тканях полости рта
- 50. ФУНКЦИИ ПРОТЕОГЛИКАНОВ И ГЛИКОЗАМИНОГЛИКАНОВ они являются структурными компонентами межклеточного матрикса; протеогликаны и гликозаминогликаны специфически взаимодействуют с
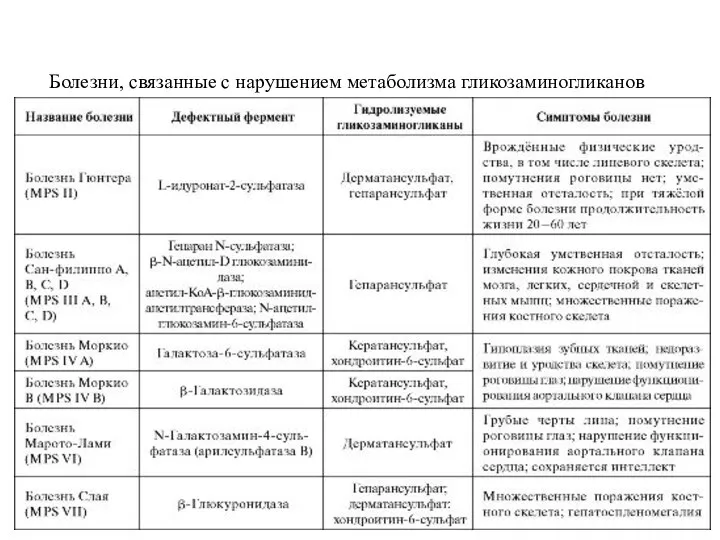
- 51. Мукополисахаридозы - тяжёлые наследственные заболевания, обусловленые дефектами гидролаз, участвующих в катаболизме гликозаминогликанов. В лизосомах тканей, для
- 52. Болезни, связанные с нарушением метаболизма гликозаминогликанов
- 54. Скачать презентацию






























 Клеточное строение организма 8 класс Учитель биологии Кожевникова Маргарита Михайловна МКОУ ХМР СОШ д.Согом
Клеточное строение организма 8 класс Учитель биологии Кожевникова Маргарита Михайловна МКОУ ХМР СОШ д.Согом Функция легких в организме человека. Дыхательные движения. Забота о здоровье
Функция легких в организме человека. Дыхательные движения. Забота о здоровье Викторина Грызуны
Викторина Грызуны Внешнее строение моллюсков
Внешнее строение моллюсков Презентация на тему ИНДИВИДУАЛЬНОЕ РАЗВИТИЕ ЧЕЛОВЕКА ИЛИ ОНТОГЕНЕЗ
Презентация на тему ИНДИВИДУАЛЬНОЕ РАЗВИТИЕ ЧЕЛОВЕКА ИЛИ ОНТОГЕНЕЗ  Неарктическая фаунистическая область
Неарктическая фаунистическая область Физиология слухового и вестибулярного анализаторов
Физиология слухового и вестибулярного анализаторов Многообразие живого и наука систематика
Многообразие живого и наука систематика Насекомые Крыма
Насекомые Крыма Комнатные растения
Комнатные растения Практикум по гистологии
Практикум по гистологии Урбопопуляции птиц
Урбопопуляции птиц Мой друг пудель
Мой друг пудель Когда были открыты витамины
Когда были открыты витамины Живая вода. Акция: Вода в природе и в жизни человека
Живая вода. Акция: Вода в природе и в жизни человека Осенние цветы
Осенние цветы Лес - аптека человека
Лес - аптека человека Вегетативная функция ЦНС
Вегетативная функция ЦНС Нервная система
Нервная система Amur Tiger
Amur Tiger Экология фотосинтеза
Экология фотосинтеза Обитатели Тайги
Обитатели Тайги Urok_01_Lamark
Urok_01_Lamark Отряд бесчелюстных. Миноги
Отряд бесчелюстных. Миноги Происхождение человека
Происхождение человека Дисахариды. Полисахариды
Дисахариды. Полисахариды Иммобилизацияланған ферменттер
Иммобилизацияланған ферменттер Класс Однодольные
Класс Однодольные