Слайд 2В нормальном гиалиновом хряще имеется только один тип клеток – это высокоспециализированные

хондроциты, составляющие около 1% от объема всей ткани. Хондроциты синтезируют такие макромолекулы, как коллагены, их которых 90 – 95% составляет коллаген II типа, протеогликаны и неколлагенновые белки, собирая и организуя их затем в высокоупорядоченную трехмерную структуру- матрикс.
Слайд 3Протеогликаны представлены в виде мономеров, так и агрегатов,, соединенных с макромолекулами гиалуроновой

кислоты посредством специальных белков. Мономер протеогликана состоит из центрального белка , связанного с сульфатированными гликозаминогликанами. Цепочки гликозааминогликанов заряжены отрицательно, вследствии чего легко связывают катионы и являются высоко гидрофильными.
Слайд 4Кроме того, из-за одинакового заряда они отталкиваются друг от друга, что заставляет

молекулы находится в раздктом состоянии. В гиалиновом хряще протеогликаны сжаты коллагеновым каркасом и гидратированы лишь частично, тем не менее вода составляет от 60 до 80% от массы нативной ткани. Это определяет механические свойства ткани – прочность и эластичность.
Слайд 5Основным патологическим механизмом, вызывающим разрушение хряща, считается нарушение обмена протеогликанов – белков,

составляющих матрикс – основное вещество, которое вместе с хондроцитами- хрящевыми клетками образует хрящевую ткань ( Цветкова Е.С.,1997).
Слайд 6Хондроциты запрограммированны на ответ, на то, чтобы направить биомеханическое возмущение и действуют

как «механорецепторы» с помощью специальных чувствительных рецепторов, многие из которых связаны с компонентами внеклеточного матрикса(Кветной И.М.,2009).Наиболее изучены интегрины, которые выступают в качестве рецепторов для фибронектина и фрагментов коллагена типа II.
Слайд 7Активация этих рецепторов может стимулировать продуцирование воспалительных цитокинов, хемокинов и разрушающих матрикс

протеиназ, в основном металлопротеиназ.
В физиологических условиях интегрины модулируют клеточно – матриксную сигнализацию, которая имеет важное значение в регуляции роста и дифференцировки, а также в поддержании гомеостаза хряща.
Слайд 8Аномальная экспрессия интегрина во время острой стадии заболевания может изменить клеточно –

матриксную сигнализацию и изменить активность хондроцитов с последующим дисбалансным синтезом разрушительных катаболических цитокинов или регуляторных факторов и/или противовоспалительных или анаболических цитокинов.
Слайд 9«Ненормальная» механическая нагрузка стимулирует истощение протеогликанов, повреждение коллагена и снижает синтез белков

хрящевого матрикса. В ответ на травматическое повреждение активируется глобальная экспрессия генов, что приводит к повышенной экспрессии медиаторов воспаления, включая цитокины и протеиназы.
Слайд 10Клинические проявления ОА обусловлены биохимическими и морфологическими изменениями тканевых компонентов сустава, которые

возникают не одновременно.
Так на I стадии ОА в суставном хряще биохимически выявлено снижение содержания протеогликанов. Морфологически же изменения касались лишь бесклеточной пластинки на поверхности хряща и отмечалось появление признаков остеофитов. При этом наблюдалась общая сохранность суставного хряща. Очевидно, источником болей могли быть синовиальная оболочка и/или фиброзная капсула, в которой имеются нервные окончания, отвечающие за болевую чувствительность.
Слайд 11На 2 стадии ОА определялось дальнейшее уменьшение содержания протеогликанов в хряще, обнаруживались

дегенерация части хондроцитов, локальная деструкция поверхностной зоны, появление остеофитов.
Эти изменения уже могли повлиять на амортизационные свойства суставного хряща, что в свою очередь способствовало развитию болевой симптоматики, причем патологическая импульсация, по некоторым данным , могла исходить от остеофитов и деформированных участков хряща(Fortier L.A.,Nixon A.J.1997)/










 Лабораторная диагностика. Гормональные исследования
Лабораторная диагностика. Гормональные исследования Клеточное строение эукариот
Клеточное строение эукариот Органические соединения аминокислоты
Органические соединения аминокислоты Управление на основе математической модели процесса культивирования, заложенной в памяти ЭВМ
Управление на основе математической модели процесса культивирования, заложенной в памяти ЭВМ Насекомые. Общая характеристика, многообразие, значение
Насекомые. Общая характеристика, многообразие, значение Законы наследственности
Законы наследственности Влияние внешних факторов на транспорт веществ по флоэме: температуры, влажности, света
Влияние внешних факторов на транспорт веществ по флоэме: температуры, влажности, света Топырақта тіршілік ететін организмдер
Топырақта тіршілік ететін организмдер Лесной доктор - дятел
Лесной доктор - дятел Клеточный уровень. Клеточная теория. 9 класс
Клеточный уровень. Клеточная теория. 9 класс Как живут растения
Как живут растения Взаимодействие природы и общества
Взаимодействие природы и общества Ткани растений и их виды
Ткани растений и их виды Гистологические исследования тканей здорового и больного человека. Их отличия
Гистологические исследования тканей здорового и больного человека. Их отличия Химический состав клетки. Неорганические соединения
Химический состав клетки. Неорганические соединения Аксиальные плоскости сканирования
Аксиальные плоскости сканирования КРУГОВОРОТ АЗОТА В ПРИРОДЕ
КРУГОВОРОТ АЗОТА В ПРИРОДЕ Мой питомец — декоративный кролик
Мой питомец — декоративный кролик Какие бывают животные окружающий мир. 2 класс
Какие бывают животные окружающий мир. 2 класс Периоды онтогенеза человека
Периоды онтогенеза человека Животные тундры
Животные тундры Эволю́ция - необратимое историческое развитие живой природы. Вводная 11 класс
Эволю́ция - необратимое историческое развитие живой природы. Вводная 11 класс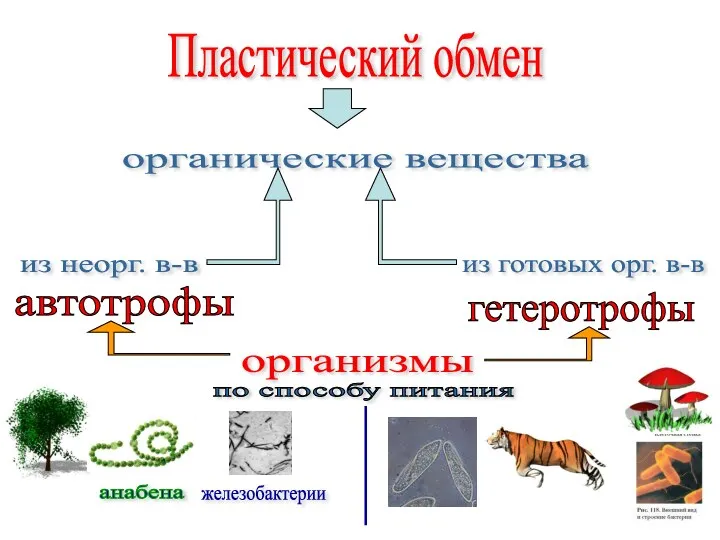 Пластический обмен у автотрофов
Пластический обмен у автотрофов Практическая работа по биофизике
Практическая работа по биофизике Презентация на тему Микроорганизмы: друзья или враги
Презентация на тему Микроорганизмы: друзья или враги 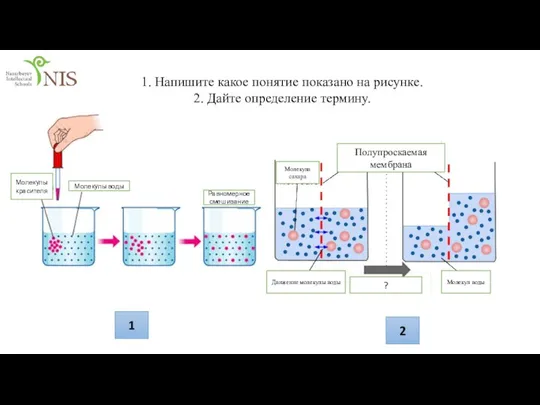 презен транспорт рус (Мырзаханулы Асан)
презен транспорт рус (Мырзаханулы Асан) Чарльз Роберт Дарвин и теория эволюции
Чарльз Роберт Дарвин и теория эволюции Водоросли
Водоросли