Содержание
- 2. План лекции: Основные понятия и теоретические основы; Условия смещения гетерогенного равновесия; Условия образования и растворения осадков;
- 3. Что такое гетерогенные системы? Гетерогенные системы – это системы, состоящие из нескольких фаз, имеющих границу раздела
- 4. Примеры гетерогенных процессов и равновесий в организме Минерализация и деминерализация неорганического компонента костной ткани и зубов;
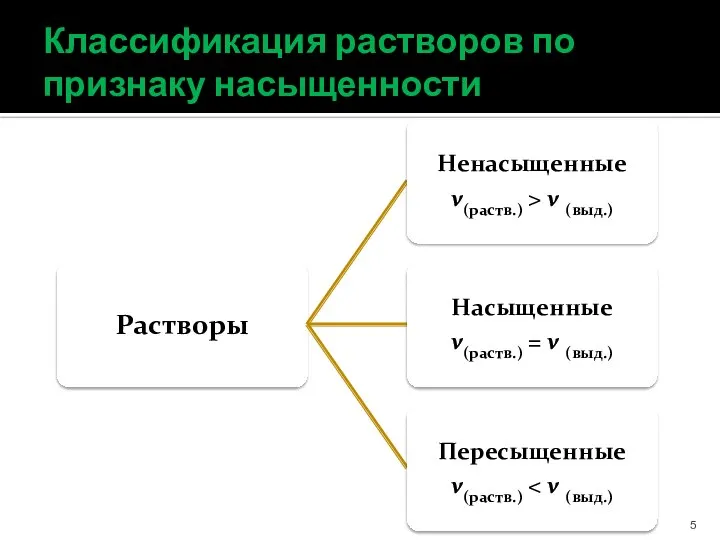
- 5. Классификация растворов по признаку насыщенности
- 6. Константа растворимости малорастворимого электролита
- 7. Константа растворимости малорастворимого электролита Ks (solubility – растворимость) – константа растворимости или произведение растворимости, иногда обозначается
- 8. Константа растворимости малорастворимого электролита Константа растворимости является безразмерной величиной, и не зависит от концентрации ионов (она
- 9. Константы растворимости – измеряются для малорастворимых электролитов в стандартных условиях (при 298 К); они являются табличными
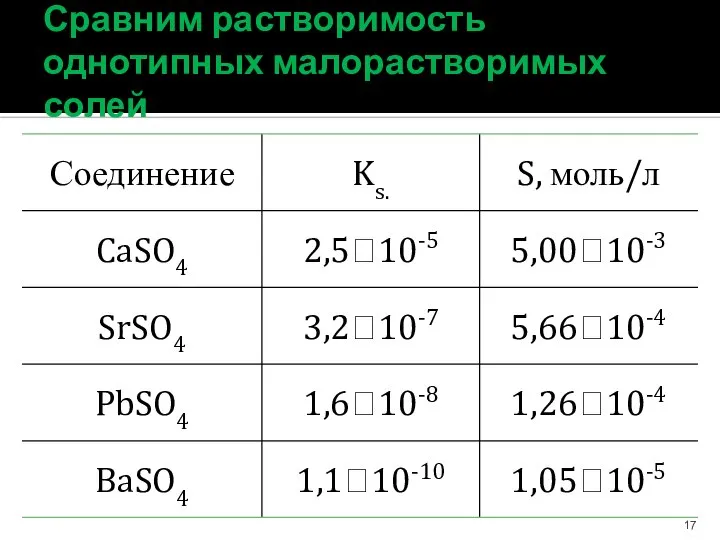
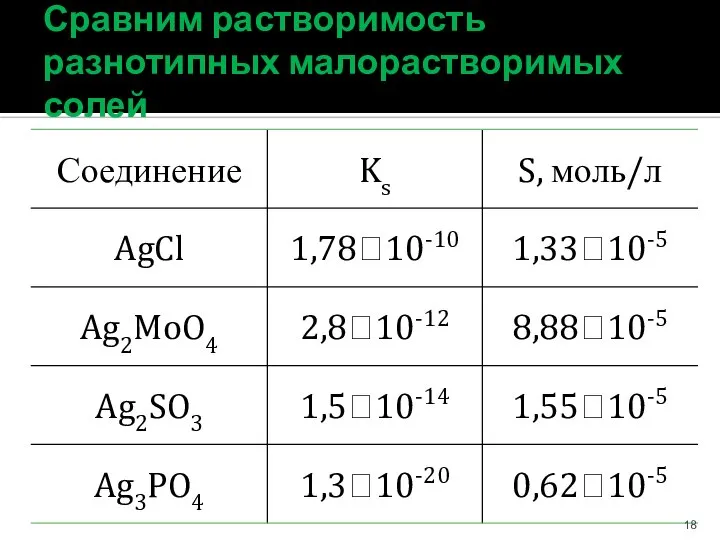
- 10. Константы растворимости позволяют сравнивать растворимость однотипных солей между собой. Чем меньше Ks, тем менее растворимой является
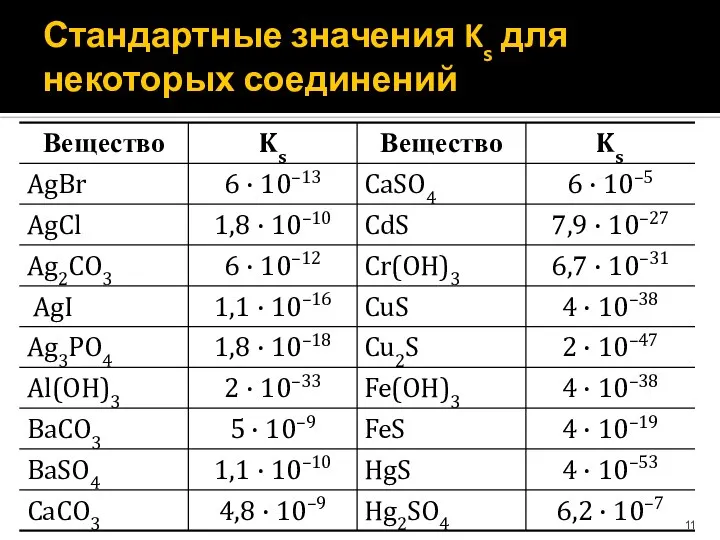
- 11. Стандартные значения Ks для некоторых соединений
- 12. Можно ли сравнивать растворимость для малорастворимых электролитов, если их ионы отличаются количеством зарядов? Для соединений имеющих
- 13. Для соединений имеющих разные формульные единицы этого делать нельзя: CaCO3 CaF2 Ca3(PO4)2 Ks 3,8·10-9 4,0·10-11 2,0·10-29
- 14. Примеры выражения констант растворимости Для ионов с эквивалентными зарядами ионов: CaCO3 (тв.) ⇄ Ca2+(р-р) + CO32-(р-р)
- 15. Примеры выражения констант растворимости Для малорастворимых соединений, с неравными зарядами: Ag3PO4(тв.) ⇄ 3Ag+(водн.) + PO43-(водн.) Ks
- 16. Молярная растворимость
- 17. Сравним растворимость однотипных малорастворимых солей
- 18. Сравним растворимость разнотипных малорастворимых солей
- 19. Пример расчёта молярной растворимости Ks = [Ag+] ∙ [Cl-] = 1,7810-10 AgCl ⇄ Ag+ + Cl-
- 20. Пример расчёта молярной растворимости для электролита с разной концентрацией ионов ‒13
- 21. Равновесие «осадок-раствор» Осадок Раствор Растворение Осаждение CaCO3 (тв.) ⇄ Ca2+ (р-р) + CO32- (р-р) v (растворения)
- 22. Условия образования и растворения осадков
- 23. Условия образования осадков Если ПК > Ks ⇒ осадок выпадает. Процесс образования кристаллов малорастворимого электролита будет
- 24. Условия растворения осадка Если ПК
- 25. Условия образования и растворения осадков Реакции осаждения являются квазимгновенными процессами, т.е. процесс образования (или растворения) осадка
- 26. Пересыщенный раствор ацетата натрия
- 27. Условия образования и растворения осадков Лимитирующей стадией гетерогенного процесса чаще всего оказывается формирование центров кристаллизации. Этот
- 28. Влияние одноименного иона Растворимость малорастворимого электролита уменьшается при введении в раствор сильных электролитов, содержащих одноименные ионы.
- 29. Солевой эффект Солевой эффект: растворимость осадков увеличивается при введении в раствор сильных электролитов, не имеющих с
- 30. Условия растворения осадка Изменение рН: CaCO3 + 2H+ = Ca2+ + CO2↑ + H2O 2. Комплексообразование:
- 31. Условия образования и растворения осадка гидроксида меди (II) CuSO4 Cu(OH)2 [Cu(NH3)4]2-
- 32. Задача 1 на осаждение Для обнаружения иона Са2+ смешали равные объемы 0,01 М растворов CaCl2 и
- 33. Задача 2 на осаждение Для обнаружения иона Са2+ смешали равные объемы 0,1 М раствора CaCl2 и
- 34. Гетерогенные процессы в живых организмах Общая концентрация Ca2+ - 2,5·10-3 моль/л (плазма крови) 46 % ионов
- 35. Гетерогенные процессы в живых организмах Свободного Ca2+ в плазме 1,1 - 1,3·10-3 моль/л, НРО42- (при рН
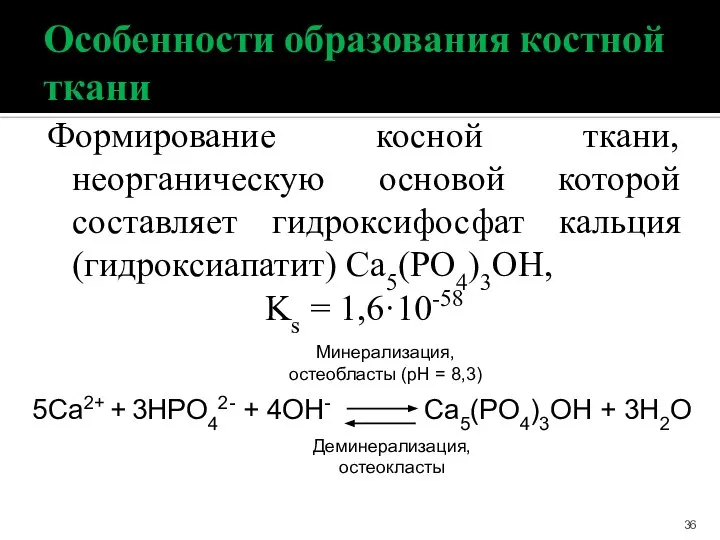
- 36. Особенности образования костной ткани Формирование косной ткани, неорганическую основой которой составляет гидроксифосфат кальция (гидроксиапатит) Ca5(PO4)3OH, Ks
- 37. Разрушение костной ткани: При небольшом повышении концентрации Н+ : Ca5(PO4)3OH + Н+ ⮀ Са4Н(РО4)3 + Са2+
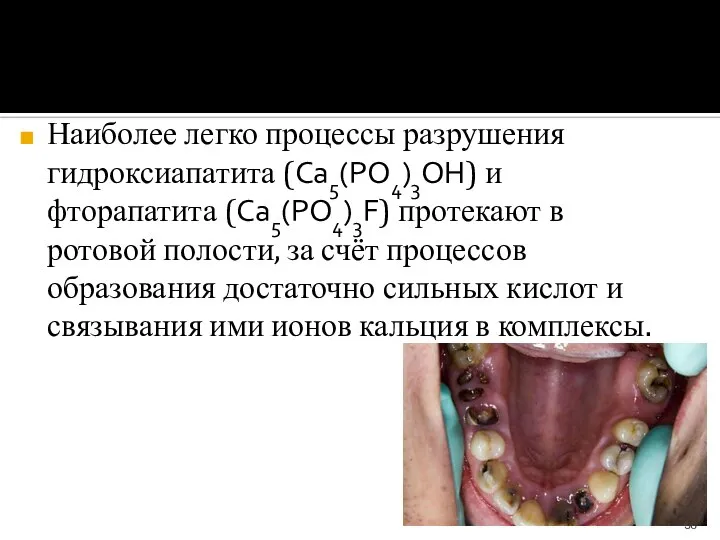
- 38. Наиболее легко процессы разрушения гидроксиапатита (Ca5(PO4)3ОН) и фторапатита (Ca5(PO4)3F) протекают в ротовой полости, за счёт процессов
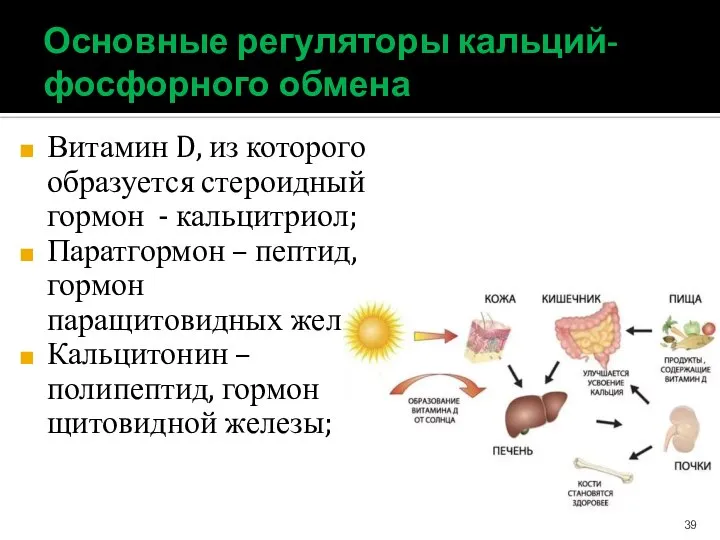
- 39. Основные регуляторы кальций-фосфорного обмена Витамин D, из которого образуется стероидный гормон - кальцитриол; Паратгормон – пептид,
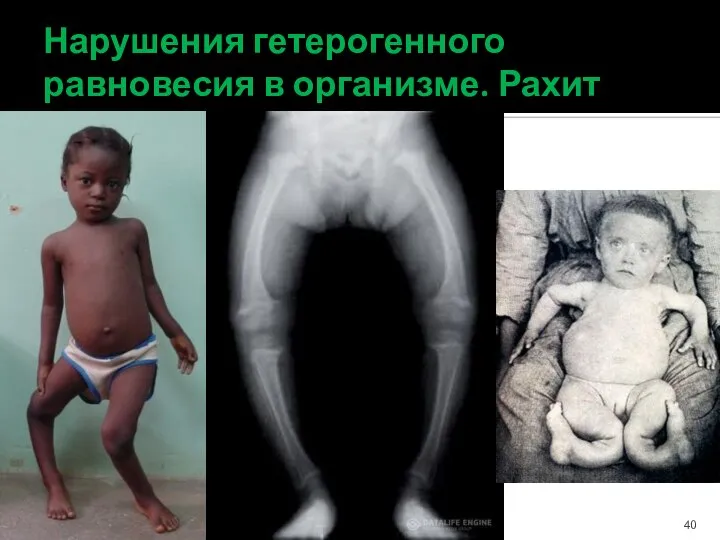
- 40. Нарушения гетерогенного равновесия в организме. Рахит
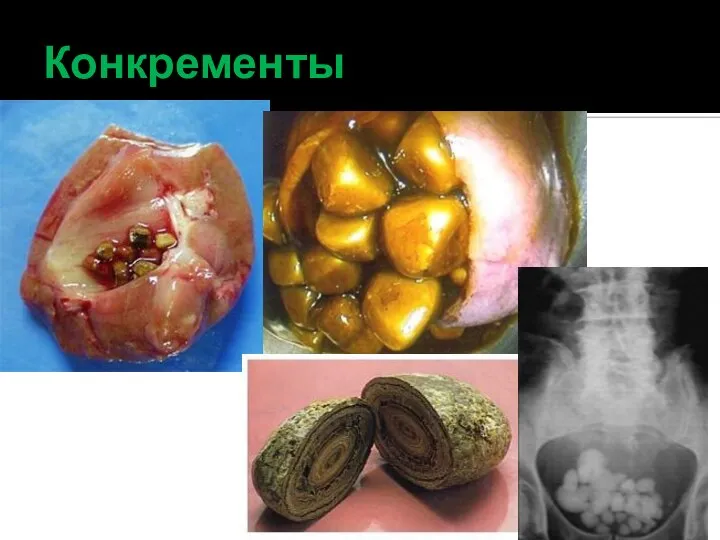
- 41. Конкременты
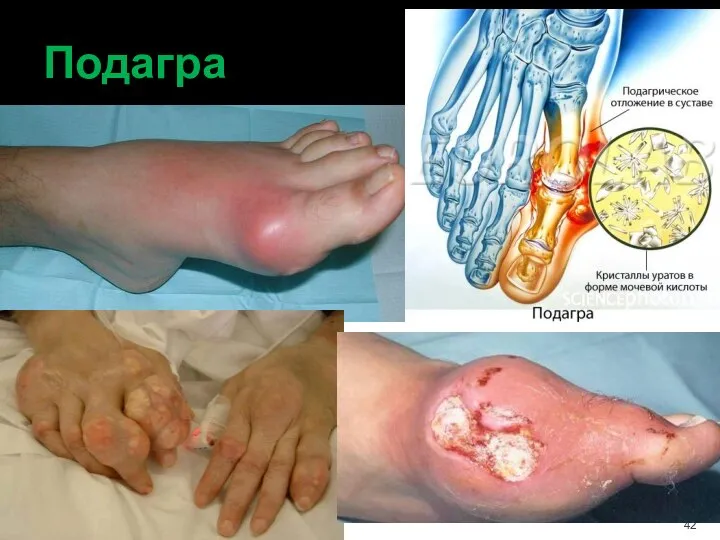
- 42. Подагра
- 43. Гетерогенное равновесие в анестезии Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»).
- 45. Скачать презентацию













![Пример расчёта молярной растворимости Ks = [Ag+] ∙ [Cl-] = 1,7810-10 AgCl](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/936949/slide-18.jpg)











![Условия образования и растворения осадка гидроксида меди (II) CuSO4 Cu(OH)2 [Cu(NH3)4]2-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/936949/slide-30.jpg)






 Цветоводство : виды и значение
Цветоводство : виды и значение Водоросли
Водоросли Дигибридное скрещивание. Первый закон Г. Менделя
Дигибридное скрещивание. Первый закон Г. Менделя История первых великих путешествий
История первых великих путешествий Презентация на тему Разнообразие животных
Презентация на тему Разнообразие животных  Функции и виды тканей
Функции и виды тканей Класс насекомые
Класс насекомые Миші. Умови виживання
Миші. Умови виживання Тюлень Уэдделла
Тюлень Уэдделла Кузнечик. Анатомия
Кузнечик. Анатомия Презентация на тему Строение скелета человека (8 класс)
Презентация на тему Строение скелета человека (8 класс)  Задание, схемы (продолжение)
Задание, схемы (продолжение) Рекомбинантные антитела
Рекомбинантные антитела Внешнее строение листа
Внешнее строение листа Что такое систематика
Что такое систематика Кислотно-основное состояние крови
Кислотно-основное состояние крови Функциональная анатомия черепа
Функциональная анатомия черепа Всё о кошках и моей Муси…
Всё о кошках и моей Муси… Цепи питания. 5 класс
Цепи питания. 5 класс Весна в мире насекомых
Весна в мире насекомых Олень марал
Олень марал Энергетический обмен
Энергетический обмен Наследственность и среда в межиндивидуальной вариативности ЭЭГ. Метод исследования головного мозга
Наследственность и среда в межиндивидуальной вариативности ЭЭГ. Метод исследования головного мозга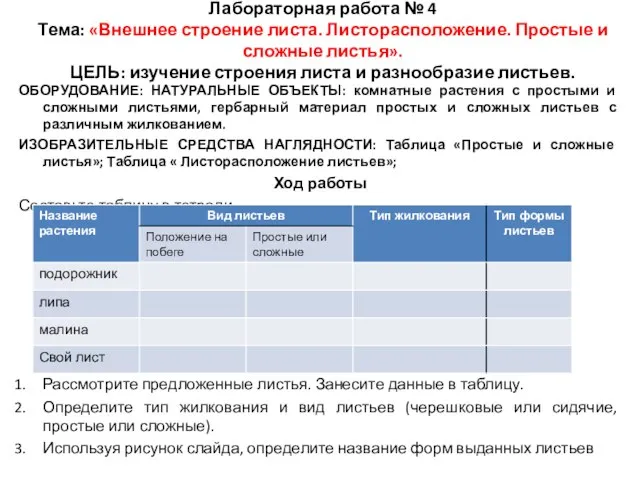 Внешнее строение листа. Листорасположение. Простые и сложные листья
Внешнее строение листа. Листорасположение. Простые и сложные листья Критерии вида
Критерии вида Класс Ракообразные (Crustacea)
Класс Ракообразные (Crustacea) Побег, его строение
Побег, его строение Жемчуг
Жемчуг