Содержание
- 4. «Все перемены, в натуре случающиеся, такого суть состояния, что, сколько чего у одного тела отнимется, столько
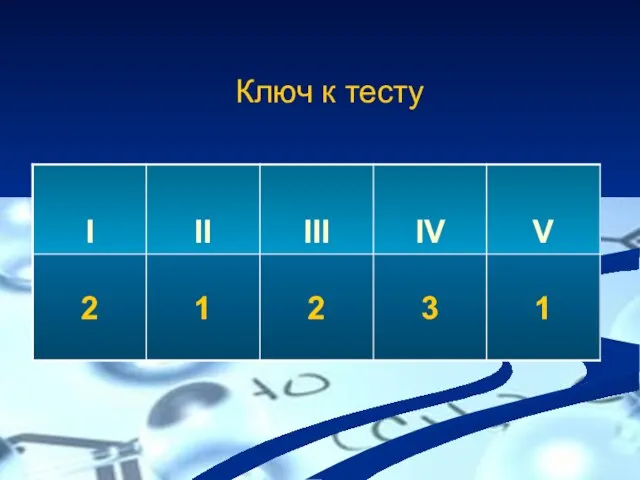
- 5. Ключ к тесту
- 6. Цель урока помочь обучающимся сформировать знания о химическом уравнении как об условной записи химической реакции с
- 7. Химические реакции. Составление уравнений химических реакций Тема урока
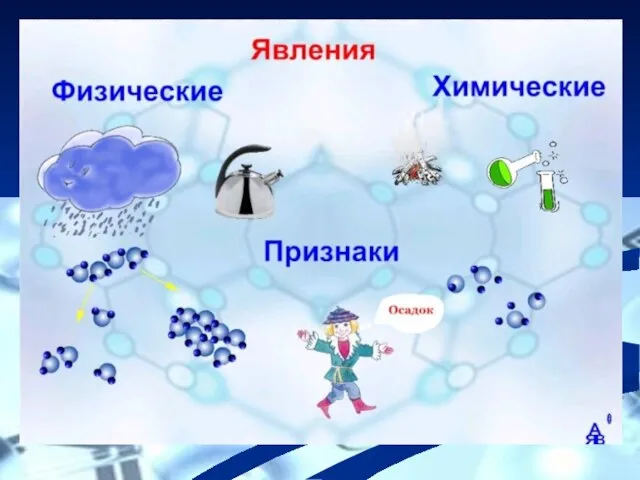
- 8. Проблема Является ли закон сохранения массы веществ основой для составления уравнений химических реакций
- 10. Железо + сера → сульфид железа (II ) Fe + S → FeS
- 12. Al + O2 → Al O Al + O2 → Al+3 O-2 Al + O2 →
- 14. Fe(OH)3→ Fe2O3 + H2O 2Fe(OH)3 → Fe2O3 + H2O 2Fe(OH)3 → Fe2O3 + 3H2O 2Fe(OH)3 =
- 15. Алгоритмом расстановки коэффициентов в уравнениях химических реакций Подсчитать количество атомов каждого элемента в правой и левой
- 17. 2P + 5Cl2 →2PCl5 2Na + S → Na2S 2HCl + Mg →MgCl2 + H2 N2
- 18. Проблема Является ли закон сохранения массы веществ основой для составления уравнений химических реакций
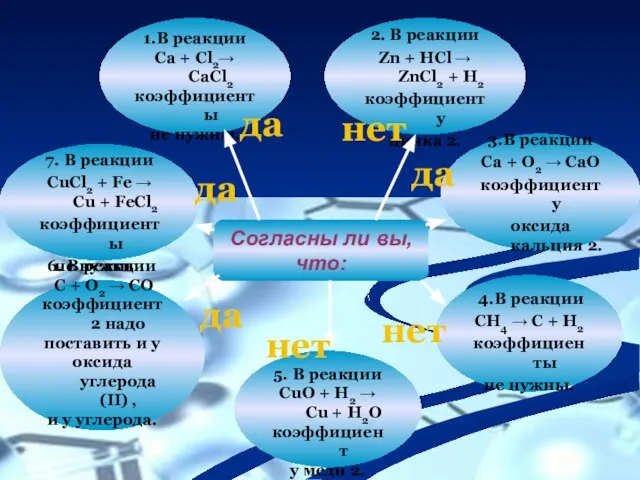
- 19. Согласны ли вы, что: 1.В реакции Ca + Cl2→ CaCl2 коэффициенты не нужны. 2. В реакции
- 20. Оценка за урок Если вы набрали: 20-21 балл – оценка«5» 17-19 баллов – оценка«4» 13-16 баллов
- 21. Домашнее задание §14, упр. 1 – для тех, кто получил оценку «3» упр. 2,4– для тех,
- 23. Скачать презентацию

















 Разработка информационной системы “Авиаучасток” для службы обеспечения авиаперевозок ОАО “Томскнефть” ВНК
Разработка информационной системы “Авиаучасток” для службы обеспечения авиаперевозок ОАО “Томскнефть” ВНК Анализ заявок и программ развития школ
Анализ заявок и программ развития школ Разработка способа и устройства для испепеления неугодных в крупных масштабах
Разработка способа и устройства для испепеления неугодных в крупных масштабах открытый урок 15 ноября
открытый урок 15 ноября Религиозные верования и традиции древних египтян
Религиозные верования и традиции древних египтян Датчики
Датчики Стратегия дистрибуции компании Rolsen: управляемость, стабильность, эффективность.
Стратегия дистрибуции компании Rolsen: управляемость, стабильность, эффективность. ЦЕНТР ОБРАЗОВАНИЯ №2045
ЦЕНТР ОБРАЗОВАНИЯ №2045 Искусство Фландрии
Искусство Фландрии Семья и школа как партнеры
Семья и школа как партнеры ВНИМАНИЕ !!!!
ВНИМАНИЕ !!!! История создания ИНКОТЕРМС и применение ИНКОТЕРМС в контракте купли-продажи Сударкина Анастасия, ДС.01
История создания ИНКОТЕРМС и применение ИНКОТЕРМС в контракте купли-продажи Сударкина Анастасия, ДС.01 Назначение ПТЭ. Общие обязанности работников железнодорожного транспорта
Назначение ПТЭ. Общие обязанности работников железнодорожного транспорта 14 Марта день рек
14 Марта день рек Storony_v_grazhdanskom_protsesse
Storony_v_grazhdanskom_protsesse 28 января – Международный день защиты персональных данных
28 января – Международный день защиты персональных данных Система диспетчеризации Plant Visor
Система диспетчеризации Plant Visor Insurance of International Trade Risks
Insurance of International Trade Risks  Открытая лига мини-футбола г. Вологды
Открытая лига мини-футбола г. Вологды История создания фартука
История создания фартука Антигитлеровская коалиция и итоги Второй мировой войны
Антигитлеровская коалиция и итоги Второй мировой войны "Учиться надо весело, чтоб хорошо учиться…"
"Учиться надо весело, чтоб хорошо учиться…" Кодекс ГТС. Принципи взаємодії з прямим споживачем
Кодекс ГТС. Принципи взаємодії з прямим споживачем С юбилеем! 55 лет
С юбилеем! 55 лет Saint Valentine’s day
Saint Valentine’s day Невидимый мир. Тема 3
Невидимый мир. Тема 3 Аварийные конструкции зданий
Аварийные конструкции зданий Имя существительное: кто? что?
Имя существительное: кто? что?