Содержание
- 2. История открытия. Азот (англ. Nitrogen, франц. Azote, нем. Stickstoff) был открыт почти одновременно несколькими исследователями. Кавендиш
- 3. Строение азота Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра
- 4. Физические свойства азота. При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) =
- 5. Химические свойства азота. Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях
- 6. Получение и использование азота. Способ получения элементного азота зависит от требуемой его чистоты. В промышленности: сжижение
- 7. Степени окисления и соединения азота.
- 8. Оксиды азота. Оксид азота(V) N2O5 – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида
- 9. Оксиды азота. Оксид азота(IV) (Бурый газ) Ядовитый газ красно-коричневого цвета с резким запахом. Получается: 1) в
- 10. Оксиды азота. Получение концентрированной азотной кислоты: 4NO2 + 2H2O + O2 = 4HNO3 Димеризуется: 2NO2 N2O4
- 11. Оксиды азота. Оксид азота(III) Ангидрид азотистой кислоты: N2O3 + H2O = 2HNO2 Чистый N2O3 может быть
- 12. Азотная кислота. Получение: 4NH3 + 5O2 = 4NO + 6H2O (катализатор Pt) 2NO + O2 =
- 13. Азотная кислота. Реагирует с Me: Если кислота концентрированная: С малоактивными металлами: Cu + 4HNO3(K) = Cu(NO3)2
- 14. Азотная кислота. Если кислота разбавленная: С малоактивными металлами: 3Cu + 8HNO3(р) = 3Cu(NO3)2 + 4H2O +
- 15. Оксиды азота. Оксид азота(II) Бесцветный газ, плохо растворяется в воде, немного тяжелее воздуха. Получение: 1) в
- 16. Азотная кислота. Азотная кислота пассивирует с Fe, Al, Cr, Co. Золото и платина не реагируют с
- 17. Оксиды азота. В соединения с кислородом азот проявляет все свои положительные степени: N2O, NO, N2O3, NO2
- 18. Нахождение в природе. В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и
- 20. Скачать презентацию

















 Презентация на тему Паспортизация комнатных растений
Презентация на тему Паспортизация комнатных растений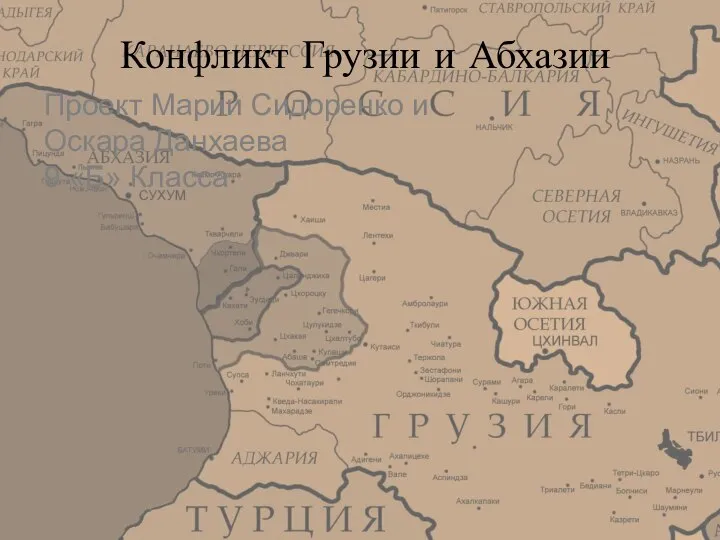 Конфликт Грузии и Абхазии
Конфликт Грузии и Абхазии НОУ ВПО «Волгоградский институт бизнеса» ЦЕНТР БЕСПЛАТНОЙ ЮРИДИЧЕСКОЙ ПОМОЩИ ВОЛОНТЕРСКАЯ ОРГАНИЗАЦИЯ
НОУ ВПО «Волгоградский институт бизнеса» ЦЕНТР БЕСПЛАТНОЙ ЮРИДИЧЕСКОЙ ПОМОЩИ ВОЛОНТЕРСКАЯ ОРГАНИЗАЦИЯ Основы конституционного права Великобритании. Правительство и кабинет
Основы конституционного права Великобритании. Правительство и кабинет Рациональная структура источников средств
Рациональная структура источников средств Золотое сечение: правда или миф
Золотое сечение: правда или миф В кафе. Логотип
В кафе. Логотип Банк «Первомайский»(ЗАО)
Банк «Первомайский»(ЗАО) Правильные выпуклые многогранники
Правильные выпуклые многогранники  Искусство управления государством. 9 класс
Искусство управления государством. 9 класс Презентация Принцип разделения властей
Презентация Принцип разделения властей Научная статья
Научная статья Презентация Трудовые ресурсы, персонал организации
Презентация Трудовые ресурсы, персонал организации 20170126_1
20170126_1 Некрасов Дмитрий Александрович Учитель истории и обществознания МОУ гимназия №1 городского округа - город Галич
Некрасов Дмитрий Александрович Учитель истории и обществознания МОУ гимназия №1 городского округа - город Галич Научно – практическая конференция«Информационные и коммуникационные технологии в школе»
Научно – практическая конференция«Информационные и коммуникационные технологии в школе» Henry Mintzberg. Школа Конфигурации
Henry Mintzberg. Школа Конфигурации Юридическая наука как форма общественного сознания
Юридическая наука как форма общественного сознания Страна рукоделия
Страна рукоделия Гельминтология. Паразитические черви и борьба с очагами вызываемых ими болезней
Гельминтология. Паразитические черви и борьба с очагами вызываемых ими болезней ВОЗМОЖНОСТЬ ЭКОНОМИИ НА ЛОГИСТИКЕ В ПЕРИОД КРИЗИСА03 апреля 2009 года
ВОЗМОЖНОСТЬ ЭКОНОМИИ НА ЛОГИСТИКЕ В ПЕРИОД КРИЗИСА03 апреля 2009 года Семейство Лилейные
Семейство Лилейные Знаки больше, меньше, равно (1 класс)
Знаки больше, меньше, равно (1 класс) Технология социального проектирования
Технология социального проектирования Цели преподавания курса Теория электросвязи
Цели преподавания курса Теория электросвязи МОУ СОШ№1р.п.Лысые Горы Саратовской области
МОУ СОШ№1р.п.Лысые Горы Саратовской области Турфирма Зимняя сказка (горнолыжный туризм). Проект
Турфирма Зимняя сказка (горнолыжный туризм). Проект Решение уравнений с модулем
Решение уравнений с модулем