Содержание
- 2. Содержание : 1. Определение сущности процесса электролиза 2. Электролиз в расплавах: а) процессы на катоде б)
- 3. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах в растворах или расплавах электролитов при пропускании электрического
- 4. Электролиз в расплавах На катоде происходит процесс восстановления • В расплавах катионы металла восстанавливаются до свободного
- 5. Электролиз в расплавах На аноде происходит процесс окисления • В расплавах анионы бескислородных кислот (кроме фторидов)
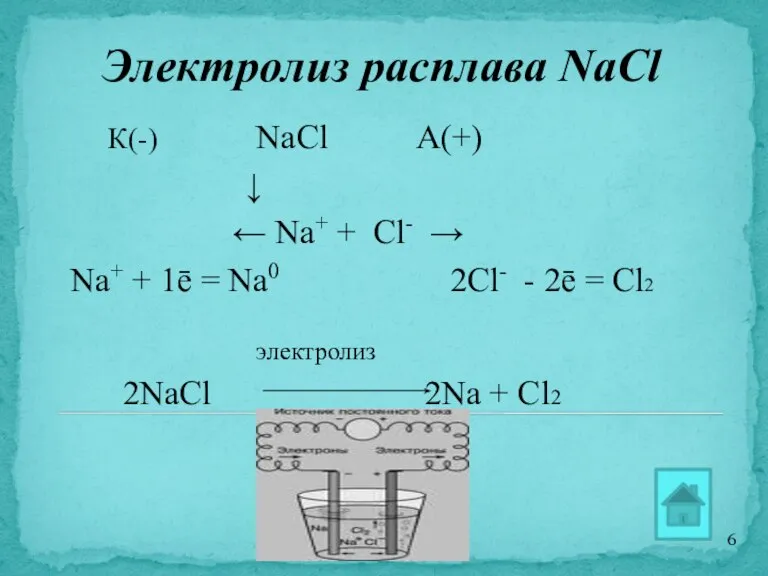
- 6. Электролиз расплава NaCl К(-) NaCl А(+) ↓ ← Na+ + Cl- → Na+ + 1ē =
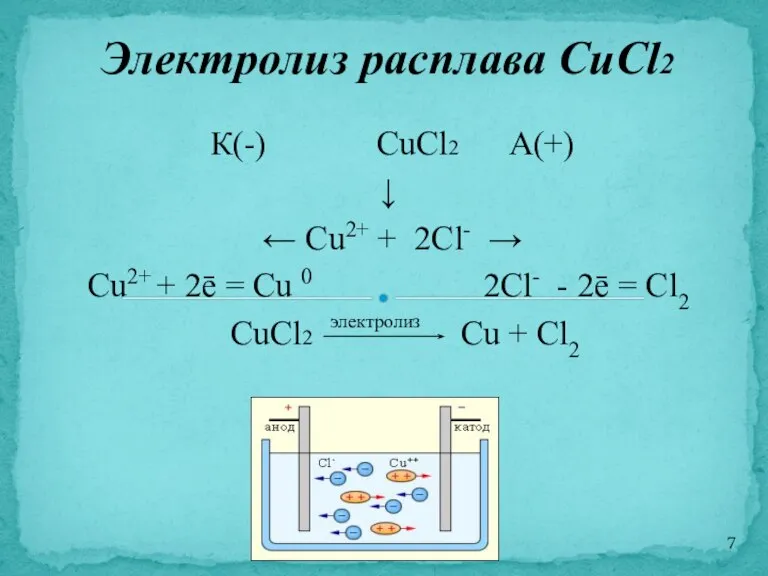
- 7. К(-) CuCl2 А(+) ↓ ← Cu2+ + 2Cl- → Cu2+ + 2ē = Cu 0 2Cl-
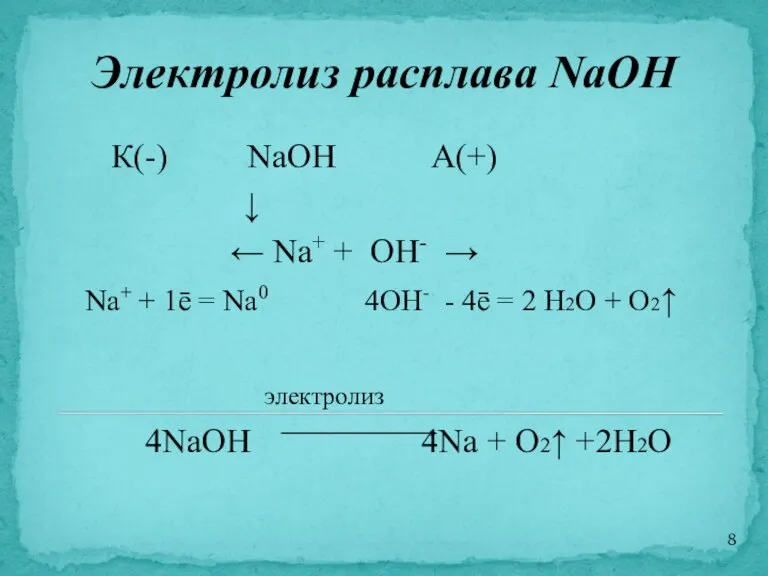
- 8. Электролиз расплава NaOH К(-) NaOH А(+) ↓ ← Na+ + OH- → Na+ + 1ē =
- 9. Электролиз в растворах (процесс на катоде) В растворах процесс на катоде не зависит от материала катода,
- 10. Электролиз в растворах (процесс на катоде) б) Если металл расположен в ряду напряжений между Al и
- 11. Процесс на аноде В растворах процесс на аноде зависит от материала анода и от природы аниона.
- 12. Процесс на аноде б) Если анод инертный, то в случае бескислородных анионов (кроме фторидов) идет окисление
- 13. Электролиз раствора NaCl на инертном аноде К(-) NaCl А(+) ↓ ← Na+ + Cl- → 2Н2О
- 14. Электролиз раствора CuSO4 на инертном аноде К(-) CuSO4 А(+) ↓ ← Cu2+ + SO42- → Cu2+
- 15. Электролиз раствора NaCl на растворимом аноде К(-) NaCl А(+) ↓ (Cu) ← Na+ + Cl- →
- 16. Применение электролиза: получение чистых металлов (Алюминий, магний, натрий, кадмий получают только электролизом)
- 17. очистка металлов
- 18. получение щелочей, хлора, водорода
- 19. защита металлов от коррозии (При этом на поверхности металлических изделий электрохимическим методом наносят тонкий слой другого
- 20. копирование рельефных изделий из металлов и других материалов. Гальванопластика позволяет создавать документально точные копии барельефов, монет,
- 21. применение электролиза в косметологии для электроэпиляции (при удалении волос этим методом используются очень тонкие иголочки, которыми
- 22. Тест по теме "Электролиз" 1. При электролизе раствора сульфата цинка с инертными электродами на аноде выделяется:
- 23. 3. При электролизе расплава гидроксида натрия на аноде выделяется: а) натрий; б) водород; в) кислород; г)
- 24. 5. Процесс на катоде при электролизе растворов солей зависит от: а) природы катода; б) активности металла;
- 25. 7. При электролизе 240 г 15%-го раствора гидроксида натрия на аноде выделилось 89,6 л (н.у.) кислорода.
- 26. А теперь проверим ваши ответы! 1-б 2-б 3-в, г 4-а, г 5-б 6- в 7- в
- 27. Домашнее задание: Учебник О.С.Габриеляна Химия 11 класс § 18 (стр.217 - 222), упр. 22,23,25.
- 28. Список использованной литературы: 1. О.С.Габриелян Учебник химии для 11 класса, М., Дрофа, 2004г. Интернет – ресурсы:
- 30. Скачать презентацию























 Технология точения декоративных изделий, имеющих внутренние полости
Технология точения декоративных изделий, имеющих внутренние полости Украшаем новогодний стол. Декор для несладких блюд
Украшаем новогодний стол. Декор для несладких блюд Qatar airways
Qatar airways Евсеева Юлия, 7в класс
Евсеева Юлия, 7в класс Инфляция и антиинфляционная политика
Инфляция и антиинфляционная политика Долгосрочные прогнозы выбросов парниковых газов
Долгосрочные прогнозы выбросов парниковых газов КП 28.09
КП 28.09 Крымская война 1853-1856 гг. Оборона Севастополя
Крымская война 1853-1856 гг. Оборона Севастополя Презентация "Язычество древних славян. Духи" - скачать презентации по МХК
Презентация "Язычество древних славян. Духи" - скачать презентации по МХК Внеклассное мероприятие
Внеклассное мероприятие Проект "Школьная газета"
Проект "Школьная газета" Norwegian University of Science and Technology
Norwegian University of Science and Technology Історія, стан і перспективи розвитку виробництва виробів з деревини. Тема 12
Історія, стан і перспективи розвитку виробництва виробів з деревини. Тема 12 О подготовке к проведению государственной (итоговой) аттестации обучающихся, освоивших основные общеобразовательные программы с
О подготовке к проведению государственной (итоговой) аттестации обучающихся, освоивших основные общеобразовательные программы с Элементы таблицы Менделеева
Элементы таблицы Менделеева СРС на тему: Острая задержка мочи у детей
СРС на тему: Острая задержка мочи у детей I ВСЕМИРНЫЙ РЕКЛАМНЫЙ ФОРУМ
I ВСЕМИРНЫЙ РЕКЛАМНЫЙ ФОРУМ Предварительная подготовка к выезду
Предварительная подготовка к выезду Книжная и промышленная графика
Книжная и промышленная графика Утро четвертого дня - собираемся на онлайн-подключение
Утро четвертого дня - собираемся на онлайн-подключение ПРОГНОЗ ПОГОДЫ И ГРАФИКИ
ПРОГНОЗ ПОГОДЫ И ГРАФИКИ Комфортность и дискомфортность климатических условий
Комфортность и дискомфортность климатических условий Unit 1 Speaking about seasons and weather
Unit 1 Speaking about seasons and weather Устройство ПК и его характеристики
Устройство ПК и его характеристики Платформа Net
Платформа Net Алиментные обязательства супругов и бывших супругов (глава 14 СК).
Алиментные обязательства супругов и бывших супругов (глава 14 СК). Презентация на тему Изображение рельефа на планах и картах
Презентация на тему Изображение рельефа на планах и картах  Презентация на тему Подготовка к ЕГЭ по математике
Презентация на тему Подготовка к ЕГЭ по математике