Содержание
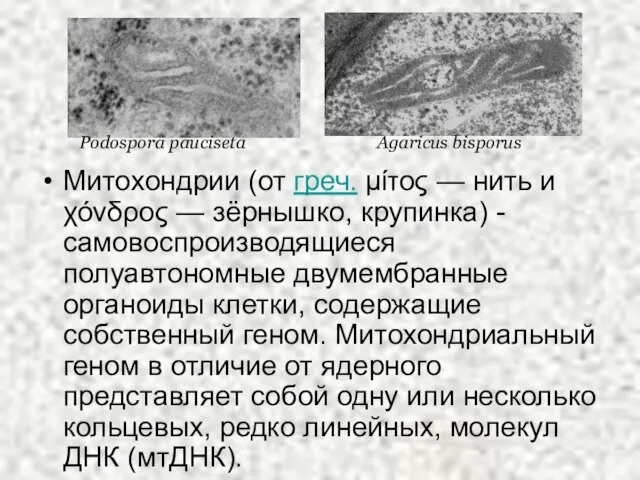
- 2. Митохондрии (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) - самовоспроизводящиеся полуавтономные двумембранные органоиды
- 3. Митохондрии характерны за малым исключением для всех эукариотических клеток, как аутотрофных (фотосинтезирующие растения), так и гетеротрофных
- 4. Митохондрии это мультифункциональные полиморфные органеллы, выполняющие функции обеспечения жизнедеятельности клетки. Динамика изменения морфологии митохондрий позволяет адаптировать
- 5. Функции митохондрий Основная функция митохондрий связана с окислением органических соединений и использованием освобождающейся при распаде этих
- 6. Биосинтез эргостерола у дрожжей Биосинтез эргостерола у дрожжей
- 7. Субкомпартменты внутренней мембраны митохондрий Митохондрии содержат около 800 белков/1500 у человека Субкомпартментализация внутренней мембраны митохондрий. Распространение
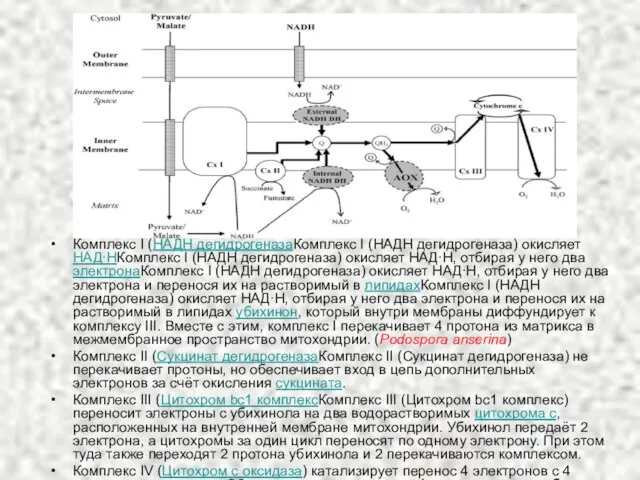
- 8. Комплекс I (НАДН дегидрогеназаКомплекс I (НАДН дегидрогеназа) окисляет НАД∙НКомплекс I (НАДН дегидрогеназа) окисляет НАД∙Н, отбирая у
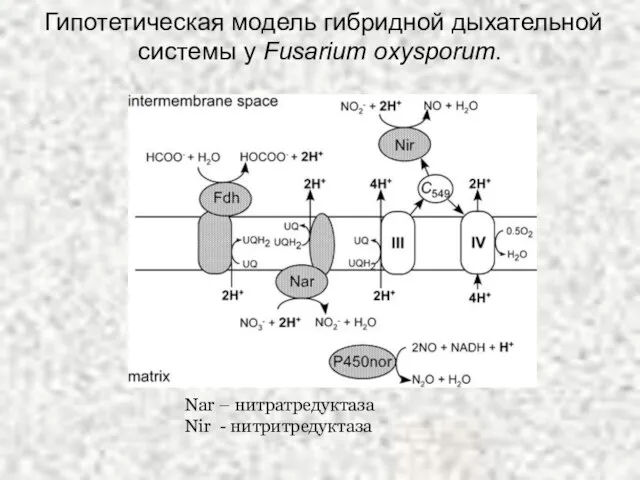
- 9. Гипотетическая модель гибридной дыхательной системы у Fusarium oxysporum. Nar – нитратредуктаза Nir - нитритредуктаза
- 10. Первые наблюдения митохондрий у гриба Pustularia versispora (Tarzetta catinus) относятся к 1911 году, несколько позже описаны
- 11. Методы наблюдения митохондрий у грибов Флуоресцентные (потенциалзависимые красители или встраивание GFP плазмиды в геном митохондрий) Методы
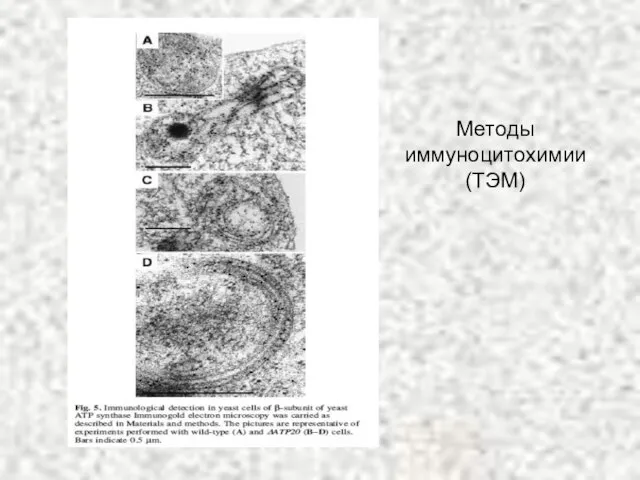
- 12. Методы иммуноцитохимии (ТЭМ)
- 13. Морфология и распределение хондриома в клетке определяется следующими факторами: - положением клеток в колонии - условиями
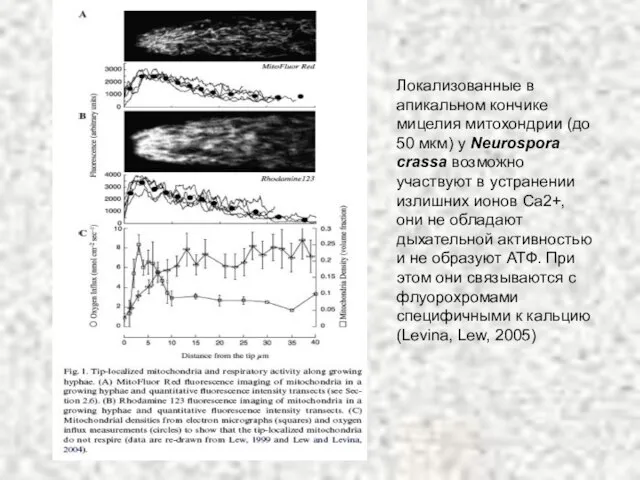
- 14. Локализованные в апикальном кончике мицелия митохондрии (до 50 мкм) у Neurospora crassa возможно участвуют в устранении
- 15. Распределение и морфология митохондрий у мицелиальных грибов
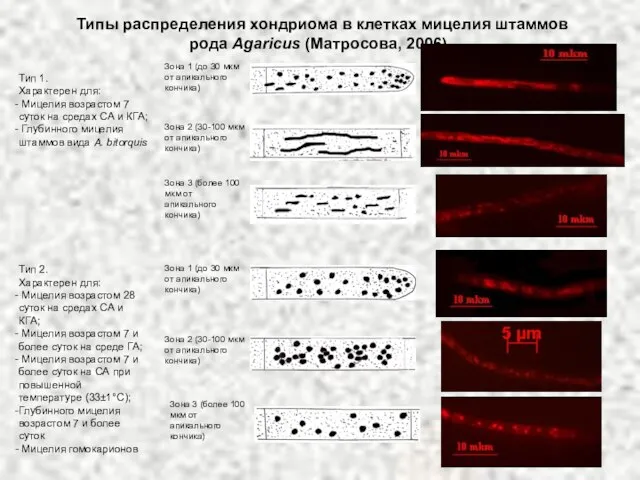
- 16. Типы распределения хондриома в клетках мицелия штаммов рода Agaricus (Матросова, 2006) . Тип 1. Характерен для:
- 17. Базидии шампиньона двуспорового
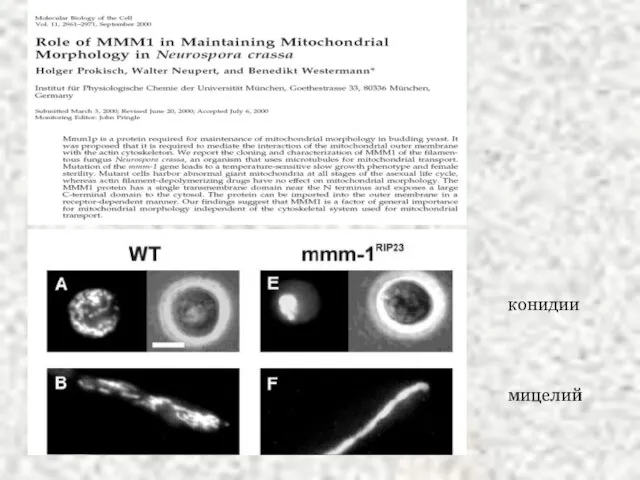
- 18. конидии мицелий
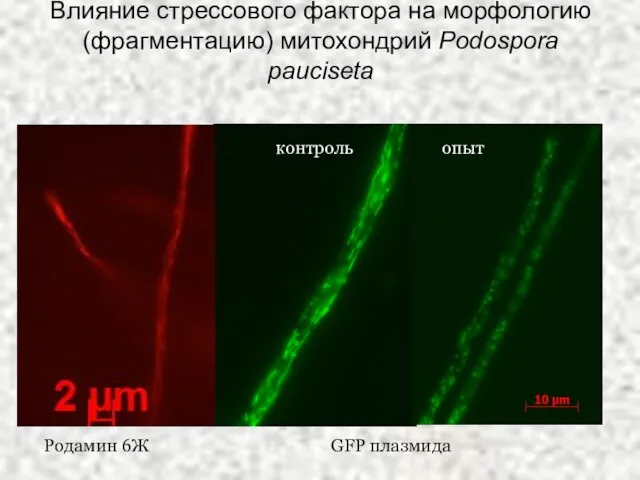
- 19. Влияние стрессового фактора на морфологию (фрагментацию) митохондрий Podospora pauciseta Родамин 6Ж GFP плазмида контроль опыт
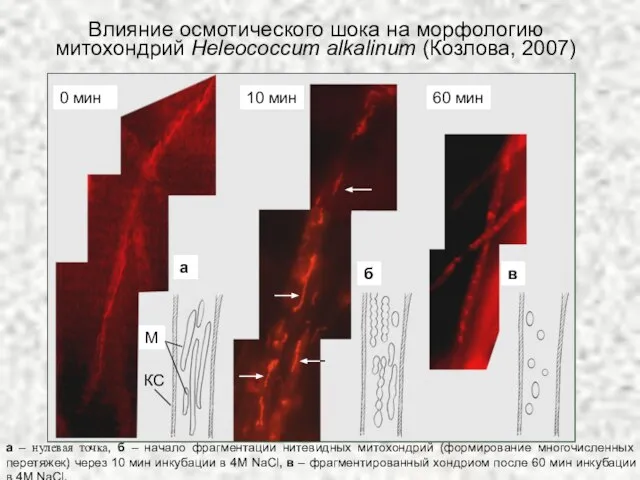
- 20. а – нулевая точка, б – начало фрагментации нитевидных митохондрий (формирование многочисленных перетяжек) через 10 мин
- 21. Распределение и морфология митохондрий у одноклеточных грибов
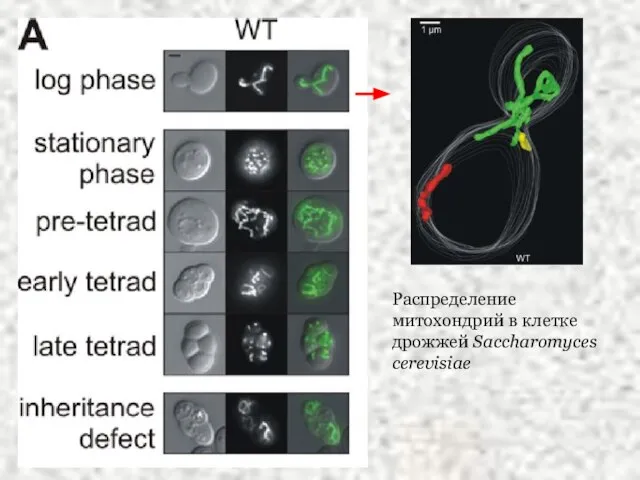
- 22. Распределение митохондрий в клетке дрожжей Saccharomyces cerevisiae
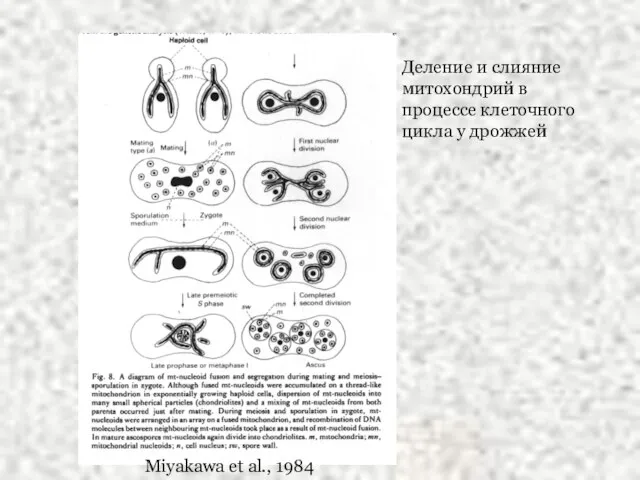
- 23. Miyakawa et al., 1984 Деление и слияние митохондрий в процессе клеточного цикла у дрожжей
- 25. Размеры митохондрий Размеры митохондрий непостоянны у разных видов. Обычно митохондрии представляют собой мелкие (длина 0.5-3 мкм,
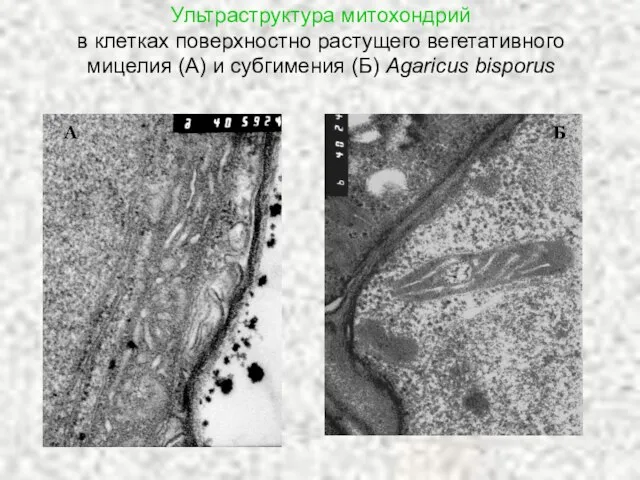
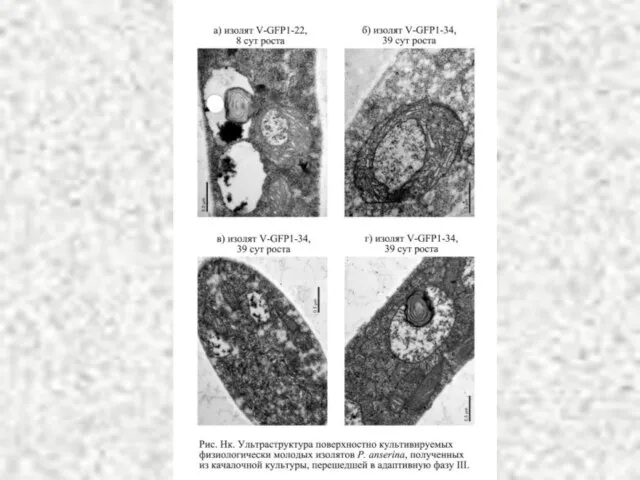
- 26. Ультраструктура митохондрий в клетках поверхностно растущего вегетативного мицелия (А) и субгимения (Б) Agaricus bisporus А Б
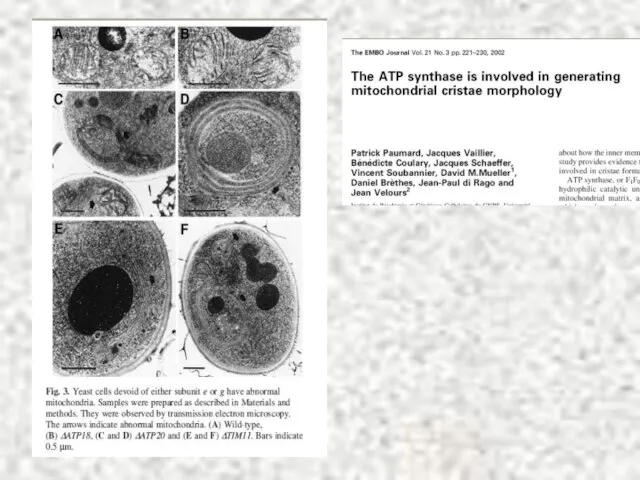
- 28. Морфология крист у дрожжей Внутренняя митохондриальная мембрана способна в зависимости от напряженности энергетического обмена образовывать большее
- 30. Геном митохондрий грибов ДНК в митохондриях представлена циклическими молекулами, не образующими связь с гистонными белками. Митохондриальная
- 31. Наследование митохондрий Сохранение целостности митохондриального генома в процессе наследования очень важно для дыхательной функции. Факторы, контролирующие
- 32. Движение митохондрий В клетках Saccharomyces cerevisiae, как и в клетках Aspergillus nidulans в транспорте митохондрий большую
- 33. Связь митохондрий с другими органеллами: ядра и пероксисомы (клетки мицелия Agaricus bisporus, связь митохондрий и пероксисомы)
- 34. Слияние (англ. fusion) и деление (англ.fission или division) митохондрий Морфология митохондрий и количество копий зависит от
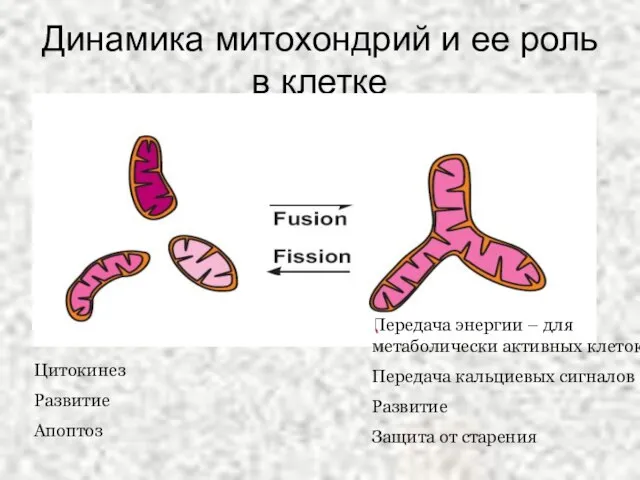
- 35. Динамика митохондрий и ее роль в клетке Цитокинез Развитие Апоптоз Передача энергии – для метаболически активных
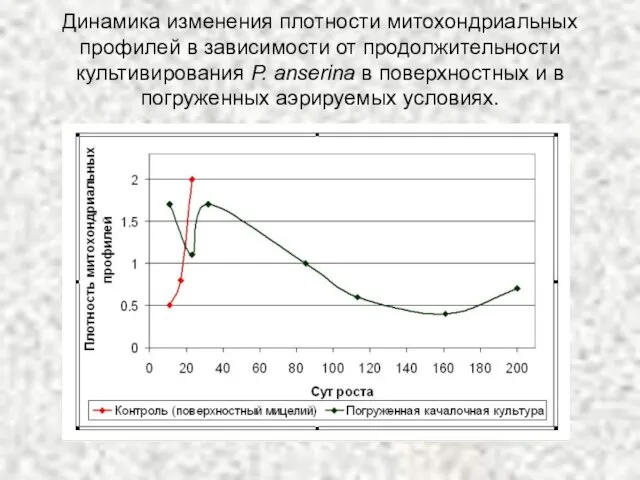
- 36. Динамика изменения плотности митохондриальных профилей в зависимости от продолжительности культивирования P. anserina в поверхностных и в
- 37. Westermann, 2008 Westermann, 2008
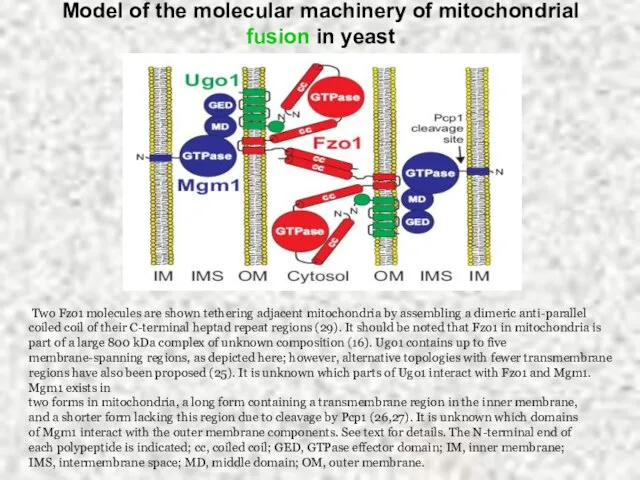
- 38. Model of the molecular machinery of mitochondrial fusion in yeast Two Fzo1 molecules are shown tethering
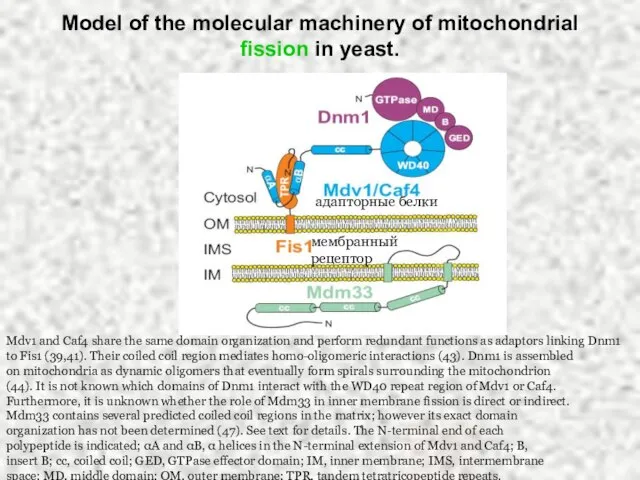
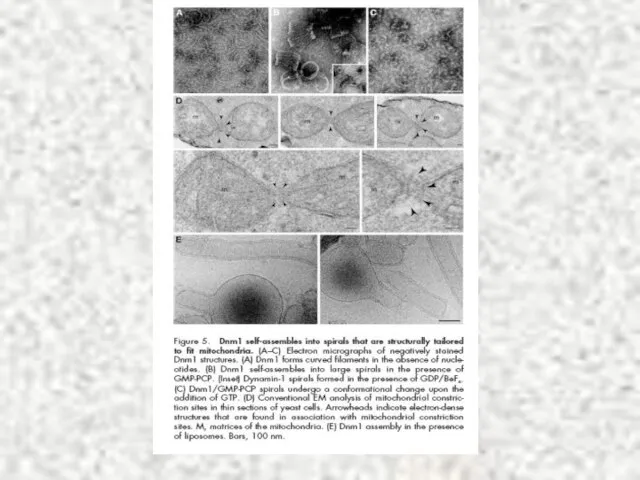
- 39. Model of the molecular machinery of mitochondrial fission in yeast. Mdv1 and Caf4 share the same
- 42. Продолжительность жизни, старение и смерть грибов
- 43. Долгоживущий мицелий базидиомицетов
- 44. Armillaria bulbosa (Smith , M., J. Bruhn and J. Anderson, 1992. The fungus Armillaria bulbosa is
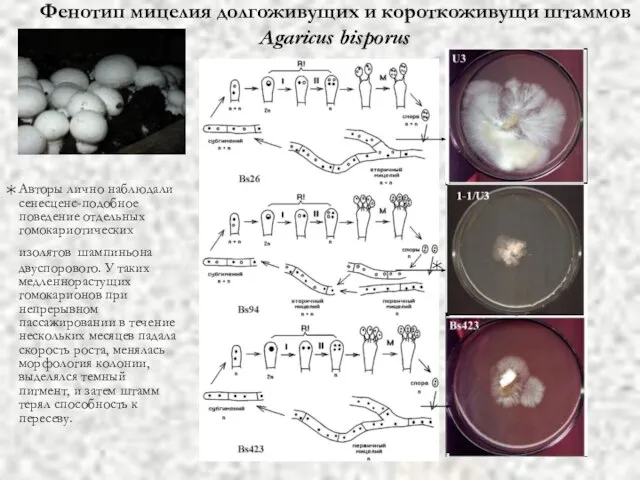
- 45. Фенотип мицелия долгоживущих и короткоживущи штаммов Agaricus bisporus Авторы лично наблюдали сенесценс-подобное поведение отдельных гомокариотических изолятов
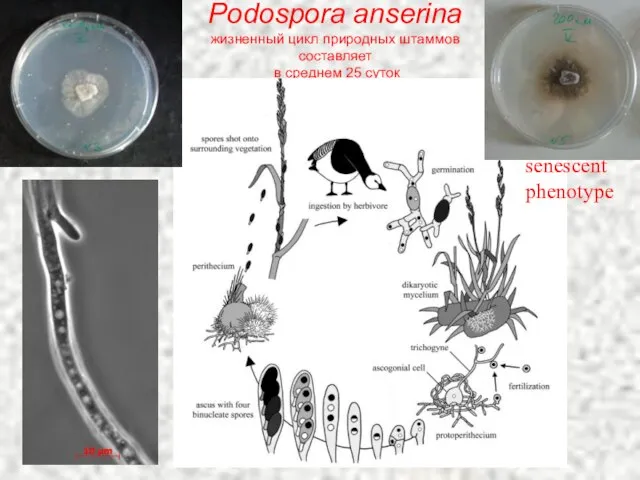
- 46. Podospora anserina жизненный цикл природных штаммов составляет в среднем 25 суток senescent phenotype
- 47. Продолжительность жизни Saccharomyces cerevisiae Средняя продолжительность жизни клетки лабораторных штаммов дрожжей Saccharomyces cerevisiae составляет в среднем
- 48. Какие факторы влияют на продолжительность жизни модельных объектов Podospora anserina и Saccharomyces cerevisiae ? Источник и
- 49. На продолжительность жизни оказывают влияние не только факторы окружающей среды и доступность питательных веществ, но и
- 50. Старение (англ. аging) это фундаментальный процесс обнаруженный почти у всех биологических систем и может быть определен
- 51. Признаки старения Podospora anserina and Neurospora crassa (senescent strains) (Griffiths, 1992, Osiewacz and Hamman, 2006), которые
- 52. У грибов процесс старения включает несколько возможных базисных механизмов (Мажейка и сотр., 2011): хронологическое старение репликативное
- 53. Хронологическое и репликативное (митотическое) старение Хронологическое старение - потеря жизнеспособности индивидуальных клеток дрожжей при культивировании в
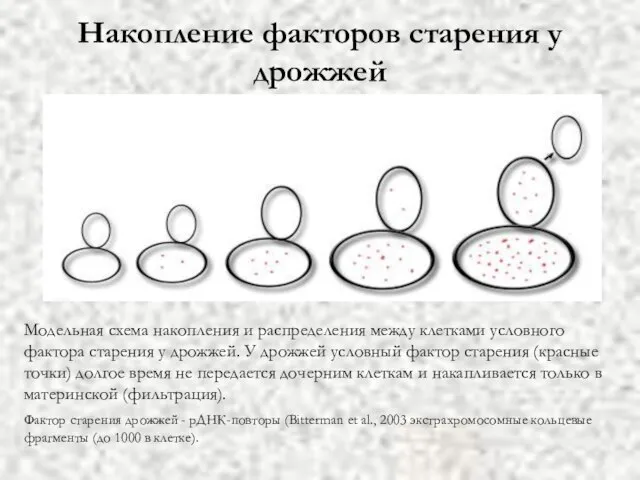
- 54. Накопление факторов старения у дрожжей Модельная схема накопления и распределения между клетками условного фактора старения у
- 55. Накопление факторов старения у Рodospora anserina Модельная схема накопления и распределения между клеток условного фактора старения.
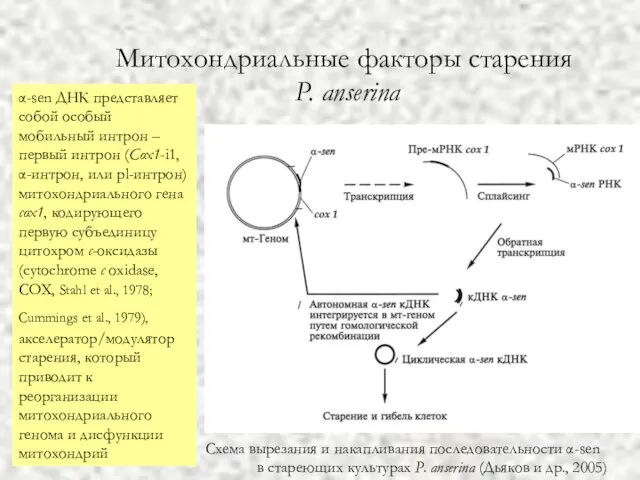
- 56. Митохондриальные факторы старения P. anserina Схема вырезания и накапливания последовательности α-sen в стареющих культурах P. anserina
- 57. Какие факторы влияют на продление или сокращение продолжительности жизни у грибов? Рассмотрим один фактор - условия
- 58. Культивирование мицелия Podospora anserina в глубинных условиях (Turker, Cummings, 1987; Кудрявцева с сотр., 2011) Культивирование в
- 59. Культивирование мицелия Agaricus bisporus в глубинных условиях Культивирование в жидкой среде вызывает гибель клеток мицелия через
- 60. Роль митохондрий в апоптозе клетки
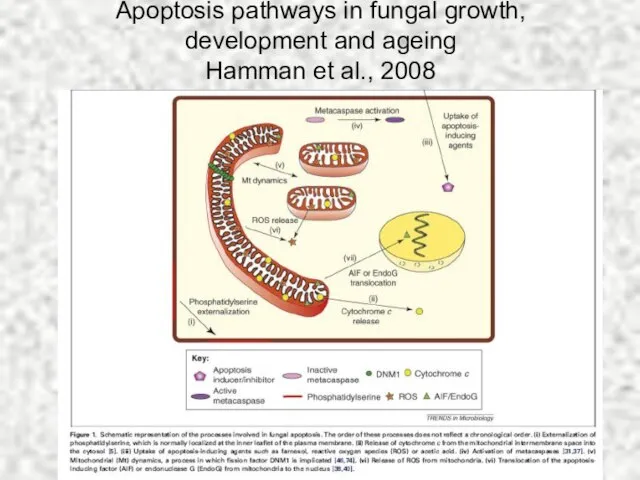
- 61. Apoptosis pathways in fungal growth, development and ageing Hamman et al., 2008
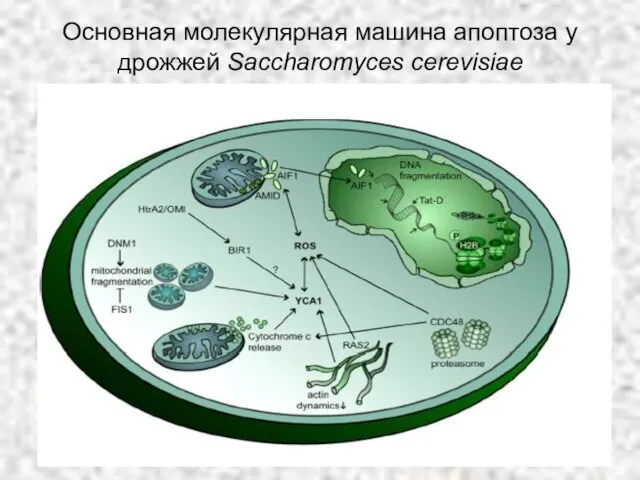
- 62. Основная молекулярная машина апоптоза у дрожжей Saccharomyces cerevisiae
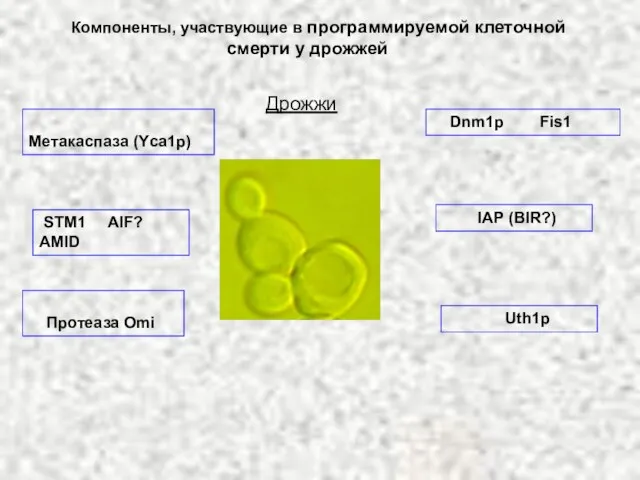
- 63. Дрожжи Метакаспаза (Yca1p) Uth1p Dnm1p Fis1 Компоненты, участвующие в программируемой клеточной смерти у дрожжей STM1 AIF?
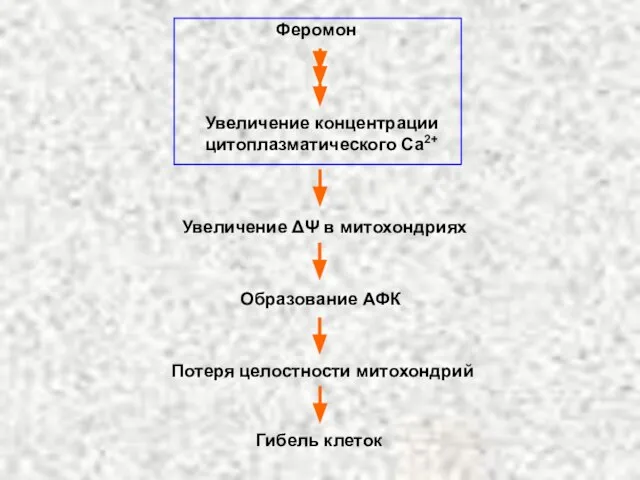
- 64. Феромон Увеличение концентрации цитоплазматического Ca2+ Увеличение ΔΨ в митохондриях Образование АФК Потеря целостности митохондрий Гибель клеток
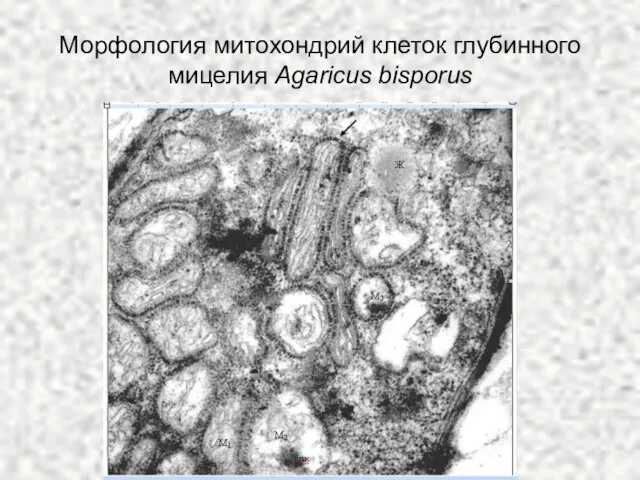
- 65. Морфология митохондрий клеток глубинного мицелия Agaricus bisporus
- 66. Ультраструктура клетки глубинного мицелия Agaricus bisporus после длительного культивирования
- 68. Скачать презентацию





































 Кукурузные хлопья. Здоровые завтраки
Кукурузные хлопья. Здоровые завтраки Городской гонкурс плакатов и листовок
Городской гонкурс плакатов и листовок ГОУ ЦЕНТР ДИАГНОСТИКИ И КОНСУЛЬТИРОВАНИЯ«УЧАСТИЕ»
ГОУ ЦЕНТР ДИАГНОСТИКИ И КОНСУЛЬТИРОВАНИЯ«УЧАСТИЕ» ПРЕЗЕНТАЦИЯ БИЗНЕС-ПЛАНА СОЗДАНИЯ АГРОПРОМЫШЛЕННОГО ХОЛДИНГАООО «ЛЮБИМСКАЯ БИОРАПСОВАЯ КОМПАНИЯ»
ПРЕЗЕНТАЦИЯ БИЗНЕС-ПЛАНА СОЗДАНИЯ АГРОПРОМЫШЛЕННОГО ХОЛДИНГАООО «ЛЮБИМСКАЯ БИОРАПСОВАЯ КОМПАНИЯ» Презентация на тему: Вставь пропущенную букву
Презентация на тему: Вставь пропущенную букву Исследовательская работа«Определение содержания нитратов в овощах, выращенных на дачном участке и китайского происхождения»
Исследовательская работа«Определение содержания нитратов в овощах, выращенных на дачном участке и китайского происхождения» Шедевры Мировой архитектуры
Шедевры Мировой архитектуры Классическое международное право
Классическое международное право Система среднего профессионального образования Сибирского федерального округа
Система среднего профессионального образования Сибирского федерального округа Методологічний апарат логістики
Методологічний апарат логістики Работа и мощность электрического тока.
Работа и мощность электрического тока. Новый препарат для лечения остеоартроза
Новый препарат для лечения остеоартроза История денег. От монет до биткоина
История денег. От монет до биткоина Презентация на тему Аборты. О вреде абортов
Презентация на тему Аборты. О вреде абортов Стратегии развития и современные инструменты управления
Стратегии развития и современные инструменты управления Научно-исследовательская работа «Своеобразие воплощения образа золотого цвета в произведениях русских писателей и поэтов x׀x и xx веков в аспекте реализаций народно-сказочных традиций.» Выполнила: ученица 8 класса Дронова Анастасия
Научно-исследовательская работа «Своеобразие воплощения образа золотого цвета в произведениях русских писателей и поэтов x׀x и xx веков в аспекте реализаций народно-сказочных традиций.» Выполнила: ученица 8 класса Дронова Анастасия Наши достижения
Наши достижения Собственность. Организационно-правовые формы предприятий России
Собственность. Организационно-правовые формы предприятий России Александр Круглов. Графика
Александр Круглов. Графика История талисманов Олимпийских Игр
История талисманов Олимпийских Игр Элективный курс «Практическое право»
Элективный курс «Практическое право» Шедевры архитектуры Индии
Шедевры архитектуры Индии Память в системе познавательной деятельности
Память в системе познавательной деятельности Что такое ИТ-бюджет, система инвестиционных проектов или затратная часть бюджета организации?
Что такое ИТ-бюджет, система инвестиционных проектов или затратная часть бюджета организации? Оформление сайта
Оформление сайта Презентация на тему логарифмы и их свойства
Презентация на тему логарифмы и их свойства  Glowing stones
Glowing stones Удмуртские перепечи
Удмуртские перепечи