Содержание
- 2. Вопрос Какие из химических реакций являются обратимыми? 1. NaOH + HCl ? NaCl + H2O 2.
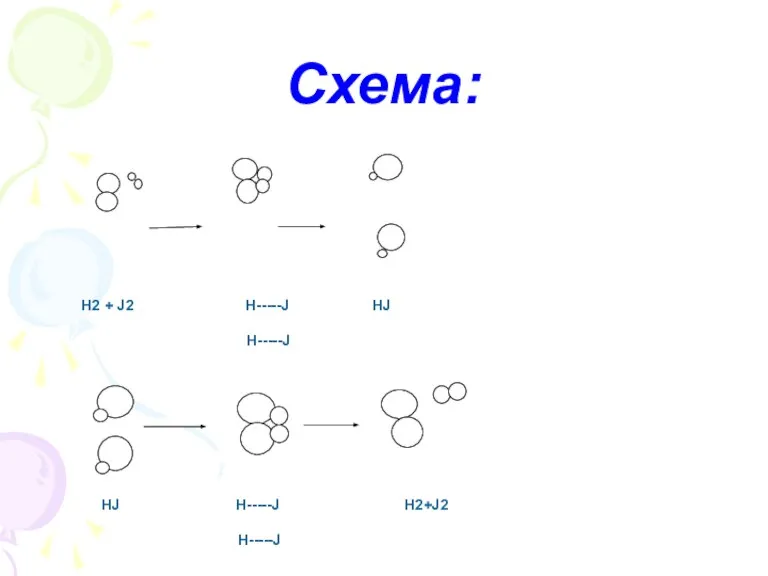
- 3. Н2 + J2 Н-----J HJ Н-----J HJ Н-----J H2+J2 Н-----J Схема:
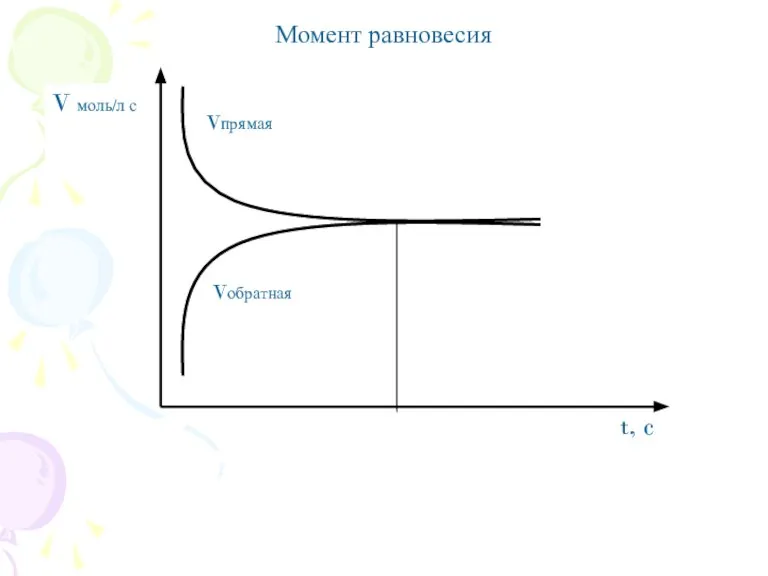
- 4. Момент равновесия
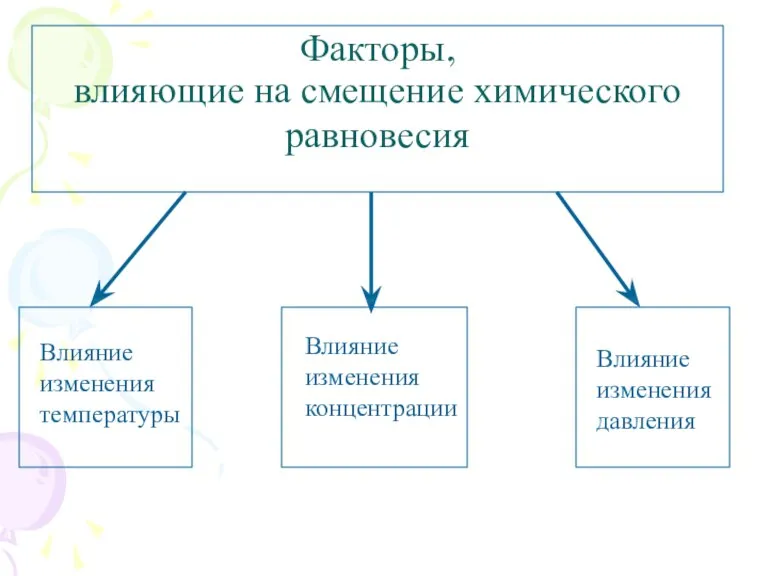
- 5. Факторы, влияющие на смещение химического равновесия
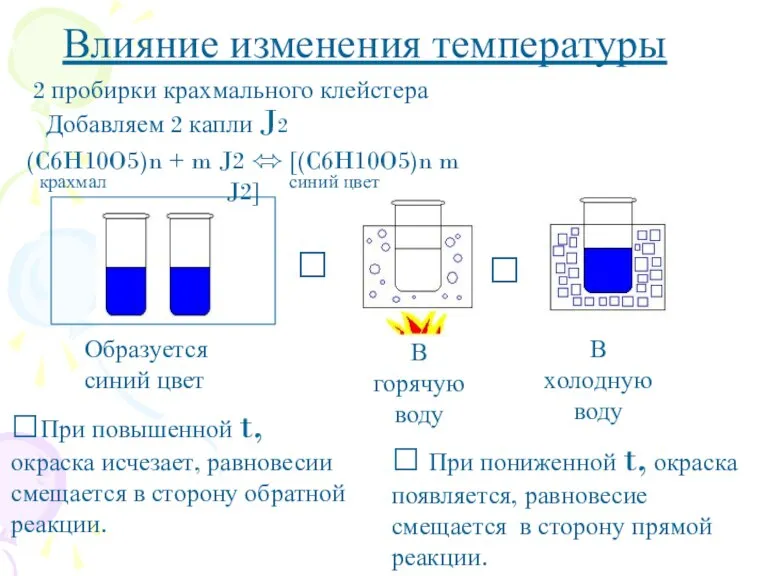
- 6. ? ? Влияние изменения температуры 2 пробирки крахмального клейстера Добавляем 2 капли J2 ?При повышенной t,
- 7. Влияние изменения концентрации + 2-3 капли FeCl3 + 1-2 капли KNCS + 1-2 капли KCl При
- 8. Влияние изменения давления 2NO2 ⬄ N2O4 + Q При расширении цвет газа стал темно-бурым, а равновесие
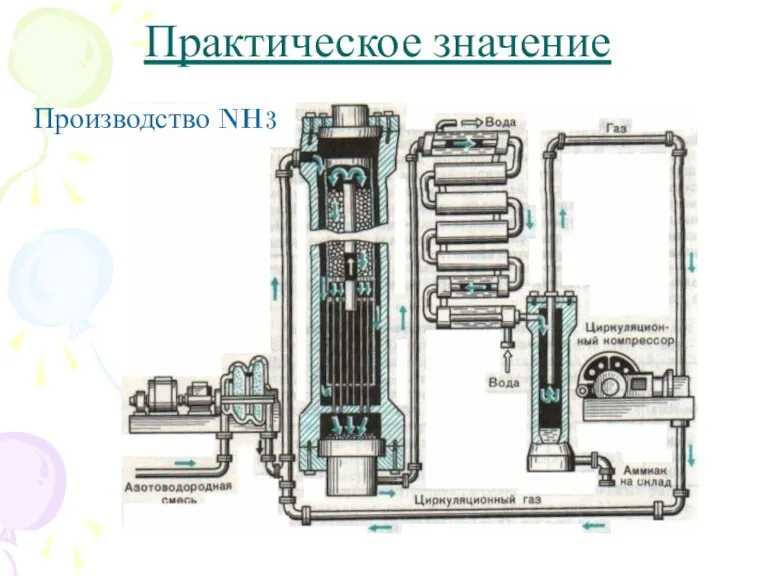
- 9. Практическое значение Производство NH3
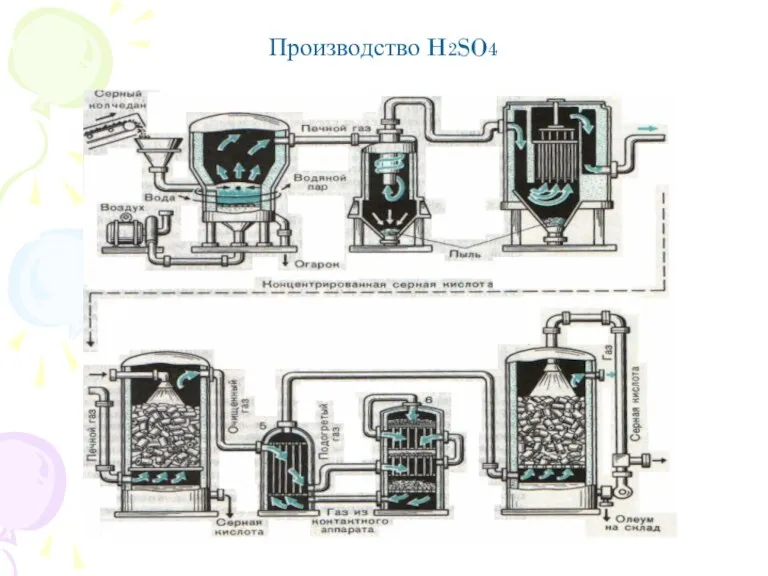
- 10. Производство H2SO4
- 11. Производство HNO3
- 12. Смещение химического равновесия 1. Смещение химического равновесия обеспечивает высокий выход желаемого продукта. 2. Открывает путь к
- 14. Скачать презентацию





 Vidy_soderzhanie_i_forma_konstruktorskih_dokumentov_7
Vidy_soderzhanie_i_forma_konstruktorskih_dokumentov_7 Склонение количественных числительных
Склонение количественных числительных 2006
2006 Как играть разминку. Занятие №24
Как играть разминку. Занятие №24 АНТРОПОЛОГИЯ
АНТРОПОЛОГИЯ РЕФОРМЫ ИЗБРАННОЙ РАДЫ
РЕФОРМЫ ИЗБРАННОЙ РАДЫ Культура Agile команд
Культура Agile команд Презентация на тему Химическое равновесие
Презентация на тему Химическое равновесие  Макеты динозавров
Макеты динозавров От внедрения WGS-84 к новым процедурам для аэронавигации
От внедрения WGS-84 к новым процедурам для аэронавигации Синтеллект Система учета товарно-материальных ценностей
Синтеллект Система учета товарно-материальных ценностей Изготовление лекал
Изготовление лекал Конституция. Конституционное право
Конституция. Конституционное право Что_будет_с_рынком_недвижимости_часть_3
Что_будет_с_рынком_недвижимости_часть_3 Файл. Файловая система
Файл. Файловая система Funktsii_i_grafiki_OGE_na_1_10_20
Funktsii_i_grafiki_OGE_na_1_10_20 Появление денег
Появление денег Выпиливание лобзиком. Первоначальные навыки
Выпиливание лобзиком. Первоначальные навыки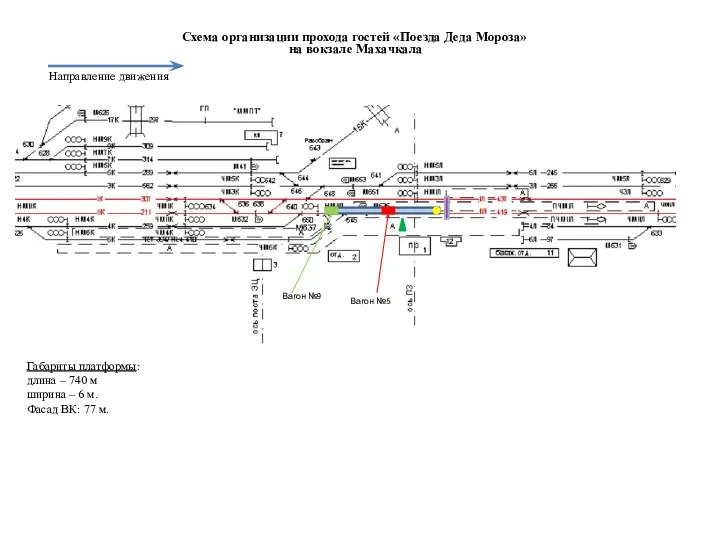 Схема организации прохода гостей Поезда Деда Мороза на вокзале Махачкала
Схема организации прохода гостей Поезда Деда Мороза на вокзале Махачкала Общая характеристика подцарства высшие растения
Общая характеристика подцарства высшие растения ПК «Мастер-Тур»
ПК «Мастер-Тур» Мастер - класс Особенности составления зимних букетов
Мастер - класс Особенности составления зимних букетов Какие виды гуслей были на Руси
Какие виды гуслей были на Руси Презентация на тему Русская и американская экранизация романа Анна Каренина
Презентация на тему Русская и американская экранизация романа Анна Каренина  Turbo Pascal
Turbo Pascal Презентация на тему Джаз – искусство 20 века
Презентация на тему Джаз – искусство 20 века Муниципальное общеобразовательное учреждение «Ломовская средняя общеобразовательная школа Корочанского района Белгородской об
Муниципальное общеобразовательное учреждение «Ломовская средняя общеобразовательная школа Корочанского района Белгородской об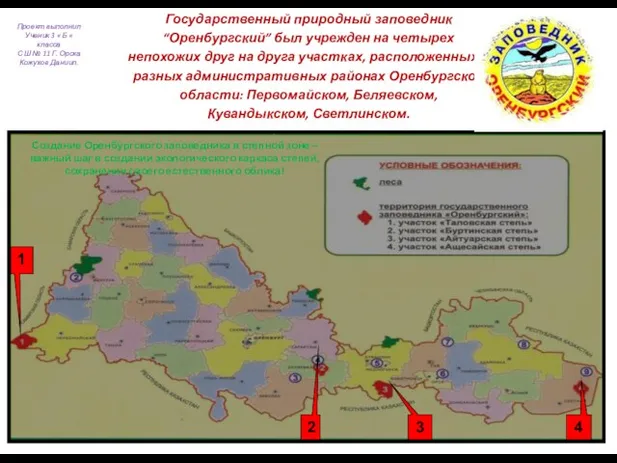 Оренбургский заповедник
Оренбургский заповедник