Содержание
- 2. Цели работы: Изучить процесс производства аммиака Изучить условия протекания реакции Изучить пользу и вред производства
- 3. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах
- 4. Промышленное получение аммиака Условия протекания реакции Современная установка синтеза аммиака Поиск катализатора Итог исследований Ф. Габер
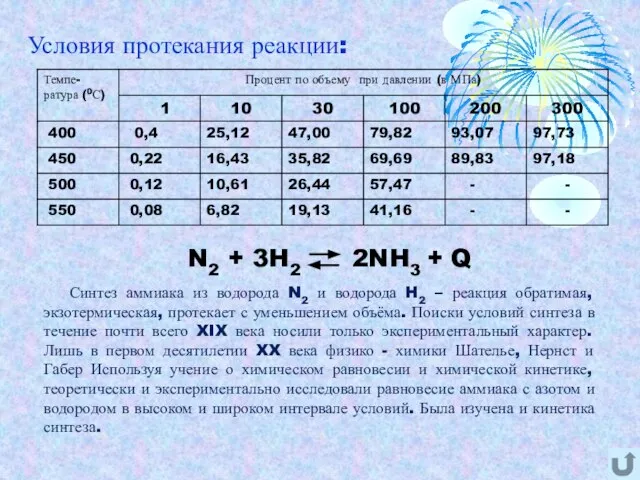
- 5. Условия протекания реакции: Синтез аммиака из водорода N2 и водорода H2 – реакция обратимая, экзотермическая, протекает
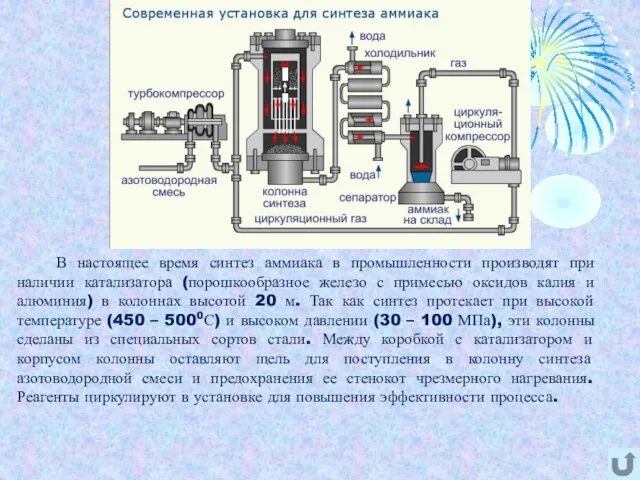
- 6. В настоящее время синтез аммиака в промышленности производят при наличии катализатора (порошкообразное железо с примесью оксидов
- 7. Разработав технологию получения аммиака прямым синтезом из азота и водорода, немецкие химики Фриц Габер и Карл
- 8. Установка для промышленного производства аммиака, разработанная Ф. Габером и К. Бошем. Массовое производство аммиака началось в
- 9. В период разработки промышленного способа синтеза аммиака проводились многочисленные исследования в поисках активных катализаторов. Были испытаны
- 10. Аммиак ядовит. ПДК = 20 мг/м3. Жидкий аммиак вызывает сильные ожоги. При содержании в воздухе 0,5%
- 11. Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков,
- 12. Отравление аммиаком вызывает также сильное возбуждение, вплоть до буйного бреда, а последствия могут быть весьма тяжелыми
- 13. Количество аварий, связанных с утечкой аммиака, по отношению к общему количеству систем, невелико. Все происшествия такого
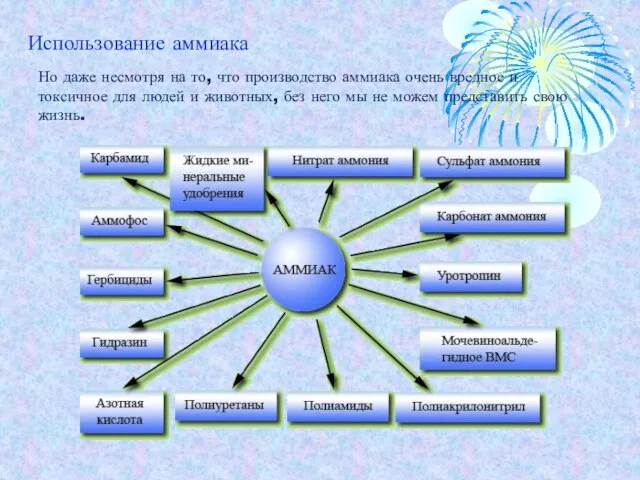
- 14. Но даже несмотря на то, что производство аммиака очень вредное и токсичное для людей и животных,
- 15. Использование аммиака
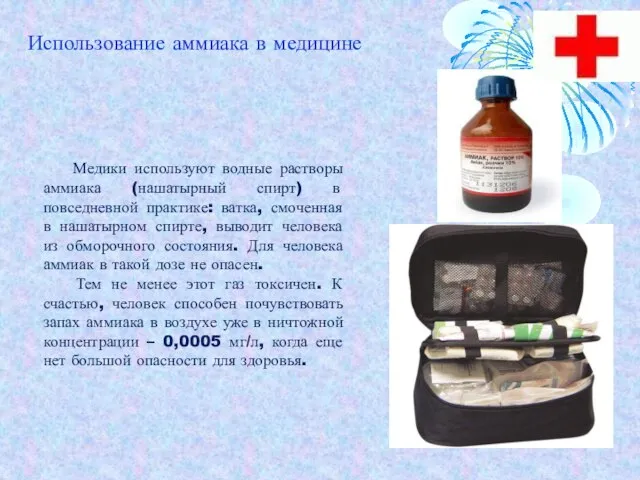
- 16. Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит
- 18. Скачать презентацию










 Buzefal Анализ рабочих режимов электроэнергетических систем Обзор программного обеспечения
Buzefal Анализ рабочих режимов электроэнергетических систем Обзор программного обеспечения Подготовка документации по контролируемым сделкам (трансфертное ценообразование)
Подготовка документации по контролируемым сделкам (трансфертное ценообразование) Уголовный процесс Чешской республики
Уголовный процесс Чешской республики Всемирный день правовой помощи детям
Всемирный день правовой помощи детям Учебник - твой друг, береги его
Учебник - твой друг, береги его СОФИЗМЫ
СОФИЗМЫ rvex5e0qf2kcfgmz01w1i7ity29jz3lp
rvex5e0qf2kcfgmz01w1i7ity29jz3lp In-Memory-Undo in Oracle 10g-11g
In-Memory-Undo in Oracle 10g-11g Урок-конференция-спектакль (в 7-ом классе) Тема: IDEOMTIC ENGLICH
Урок-конференция-спектакль (в 7-ом классе) Тема: IDEOMTIC ENGLICH Презентация на тему Мой родной город – Саратов
Презентация на тему Мой родной город – Саратов Триггеры. Регистры. Буферные элементы
Триггеры. Регистры. Буферные элементы Проблемы сбора и компиляции данных для интегрированной электронной медицинской карты
Проблемы сбора и компиляции данных для интегрированной электронной медицинской карты Проповедь Иоанна Крестителя
Проповедь Иоанна Крестителя Чтобы праздник был в радость
Чтобы праздник был в радость Красная линия – Екатеринбург
Красная линия – Екатеринбург Технологии организации самостоятельной работы
Технологии организации самостоятельной работы Поддержка социальной и творческой активностипедагогов средствами сетевых сервисов Web 2.0
Поддержка социальной и творческой активностипедагогов средствами сетевых сервисов Web 2.0 Предложение о партнерстве
Предложение о партнерстве Современные стратегии международного бизнеса в условиях глобализации
Современные стратегии международного бизнеса в условиях глобализации Англицизмы в речи русского делового человека
Англицизмы в речи русского делового человека Методы оказания психологической помощи людям в ситуациях тяжёлых переживаний
Методы оказания психологической помощи людям в ситуациях тяжёлых переживаний Теория перевода как научная и учебная дисциплина
Теория перевода как научная и учебная дисциплина Достопримечательности города Магнитогорск
Достопримечательности города Магнитогорск Правовые основы управления современной школой
Правовые основы управления современной школой Постройка и реальность. Подводный мир
Постройка и реальность. Подводный мир Литературная игра для 6-8 классов по прозе А.С.Пушкина «Умники и Умницы» («Повести Белкина», «Дубровский», «Капитанская дочка»)
Литературная игра для 6-8 классов по прозе А.С.Пушкина «Умники и Умницы» («Повести Белкина», «Дубровский», «Капитанская дочка») Путешествие по столице
Путешествие по столице Фирма в кейсах
Фирма в кейсах