Слайд 2Хлороводород HCl
HCl – это бесцветный газ с резким неприятным запахом, тяжелее воздуха.
Докажем

это:
М (HCl)= 1+35,5=36,5 г/моль
М (воздуха)= 29 г/моль
Слайд 3Получение HCl
В лаборатории:
t
NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl
В промышленности:
H2 +
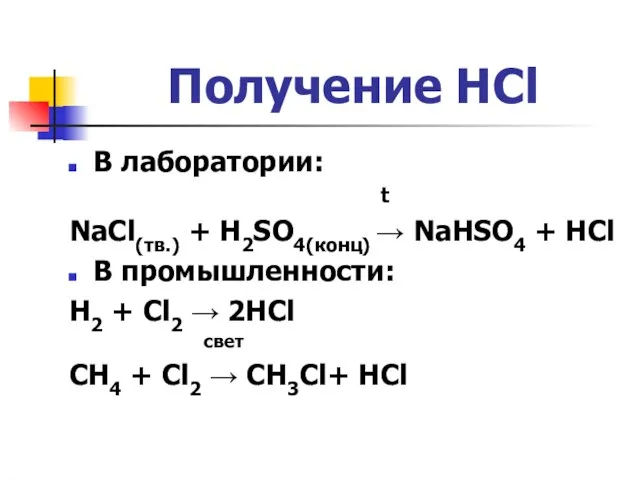
Cl2 → 2HCl
свет
CH4 + Cl2 → CH3Cl+ HCl
Слайд 4Соляная кислота HCl
Соляная кислота сильная, т.е. в водных растворах полностью распадается на

ионы:
HCl → H+ + Cl-
Растворы кислоты не имеют запаха.
Слайд 5Химические свойства
Кислотные свойства
А. Взаимодействие с металлами, стоящими в ряду активности до водорода:
HCl

+ Zn →
2HCl + Zn → ZnCl2 + H2
Допишите:
HCl + Al →
Слайд 6Б. С оксидами металлов:
HCl + CuO →
2HCl + CuO → CuCl2
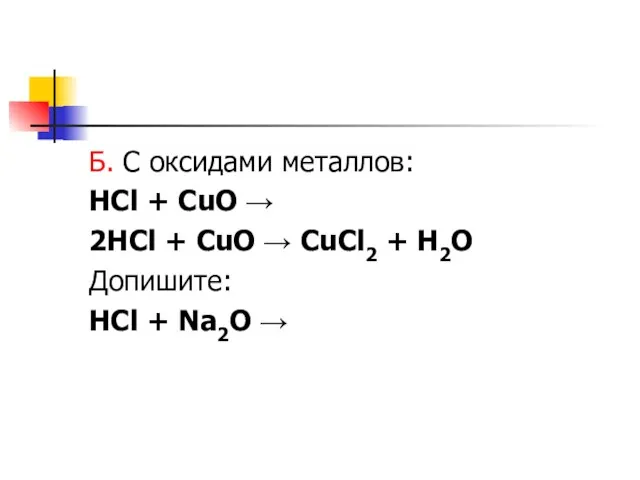
+ H2O
Допишите:
HCl + Na2O →
Слайд 7В. С гидроксидами металлов:
HCl + NaOH →
HCl + NaOH → NaCl
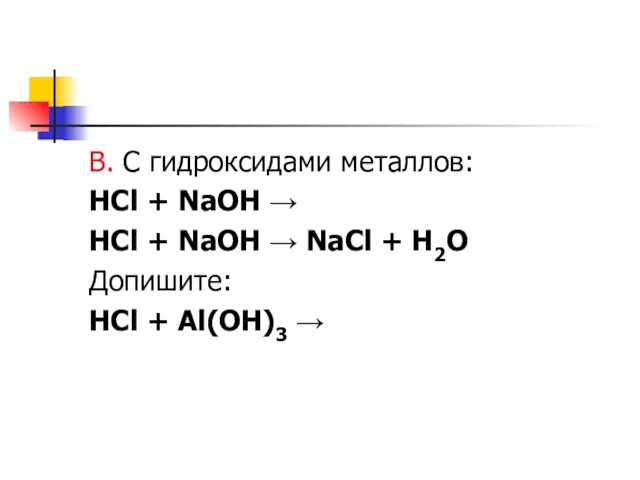
+ H2O
Допишите:
HCl + Al(OH)3 →
Слайд 8Г. С солями (при условии, если образуется осадок или газ).
HCl + AgNO3
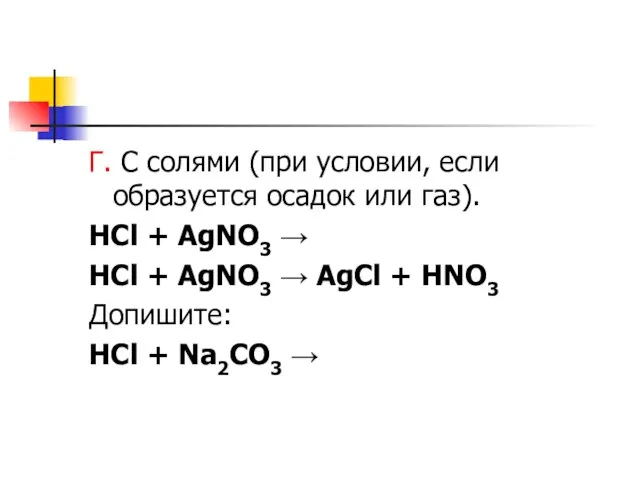
→
HCl + AgNO3 → AgCl + HNO3
Допишите:
HCl + Na2CO3 →







 Классная работа
Классная работа Налоги РФ
Налоги РФ Искусство ХХ века. Парижская школа (5 класс)
Искусство ХХ века. Парижская школа (5 класс) Установка на рефлексию сессии и сборку результатов
Установка на рефлексию сессии и сборку результатов ПЛАН РАБОТЫ КАК ВИД ТВОРЧЕСТВА
ПЛАН РАБОТЫ КАК ВИД ТВОРЧЕСТВА Презентация на тему СИЛЫ ВСЕМИРНОГО ТЯГОТЕНИЯ Силы в механике
Презентация на тему СИЛЫ ВСЕМИРНОГО ТЯГОТЕНИЯ Силы в механике  Духовная культура
Духовная культура Новый продукт VISION 2009 г. Зрение – бесценный уникальный дар природы Более 80% информации мы воспринимаем через органы зрения - глаза.
Новый продукт VISION 2009 г. Зрение – бесценный уникальный дар природы Более 80% информации мы воспринимаем через органы зрения - глаза. Презентация на тему строение клетки
Презентация на тему строение клетки Своя игра 9 класс
Своя игра 9 класс Развитие отечественной патопсихологии
Развитие отечественной патопсихологии Ванны
Ванны Зеленый рай своими руками!
Зеленый рай своими руками! Родной обычай старины «Зеленые Святки»
Родной обычай старины «Зеленые Святки» Цветок — Нарцисс
Цветок — Нарцисс Предпринимательство – это значит работать на себя Предпринимательство – это значит работать на себя
Предпринимательство – это значит работать на себя Предпринимательство – это значит работать на себя Виды компьютерных сетей.Телекоммуникации
Виды компьютерных сетей.Телекоммуникации Что же делать ?
Что же делать ? Детерминанты подготовки кадров инновационной экономики в современной России
Детерминанты подготовки кадров инновационной экономики в современной России Основы эпидемиологии
Основы эпидемиологии Презентация на тему Ахматова Реквием
Презентация на тему Ахматова Реквием База - WPS Office
База - WPS Office Presentation Title
Presentation Title  Қабылдаудың онтогенез барысындағы дамуы
Қабылдаудың онтогенез барысындағы дамуы Павел Луспекаев. Киноискусство
Павел Луспекаев. Киноискусство Повседневная жизнь земледельцев и горожан
Повседневная жизнь земледельцев и горожан Доменные имена и их защита
Доменные имена и их защита Фирма в кейсах
Фирма в кейсах