Содержание
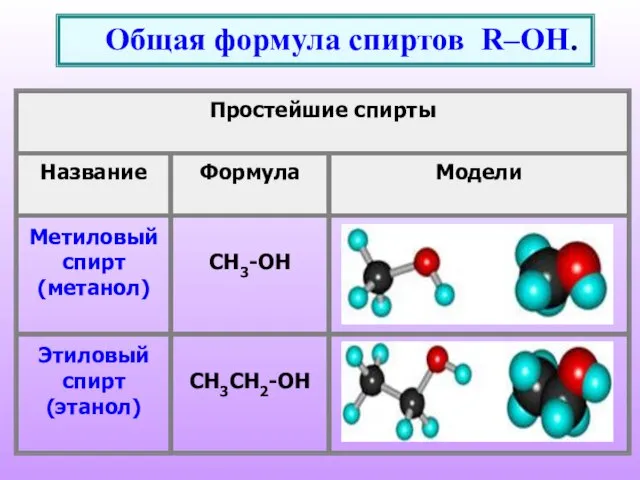
- 2. Общая формула спиртов R–OH.
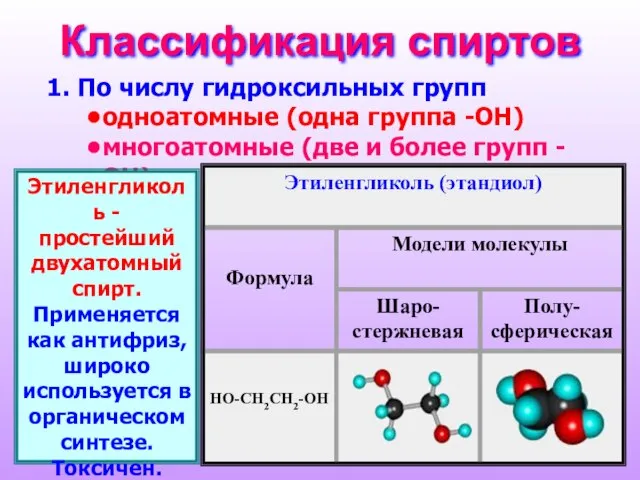
- 3. Классификация спиртов По числу гидроксильных групп одноатомные (одна группа -ОН) многоатомные (две и более групп -ОН)
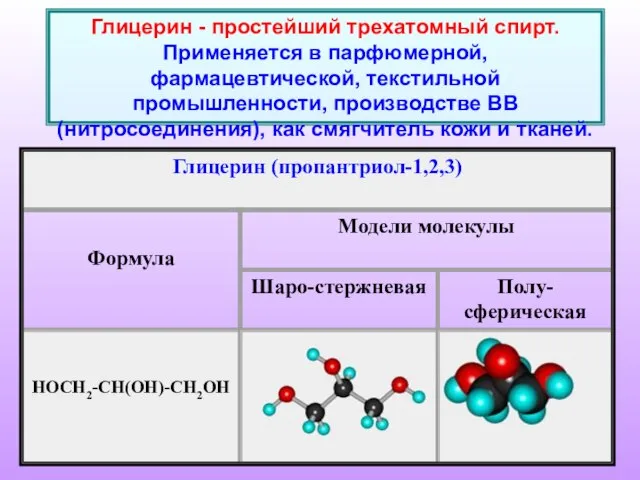
- 4. Глицерин - простейший трехатомный спирт. Применяется в парфюмерной, фармацевтической, текстильной промышленности, производстве ВВ (нитросоединения), как смягчитель
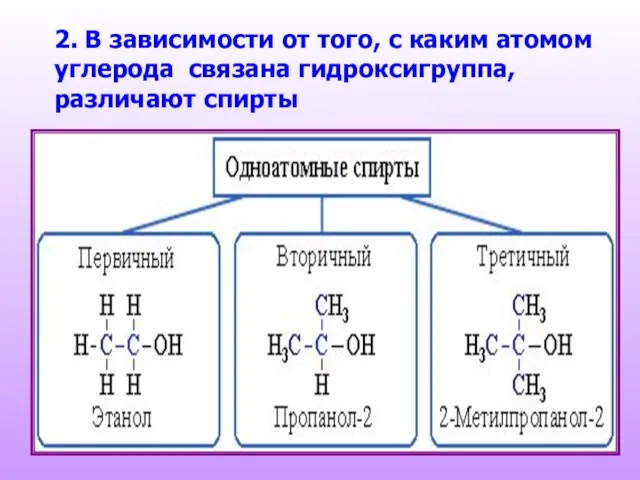
- 5. 2. В зависимости от того, с каким атомом углерода связана гидроксигруппа, различают спирты
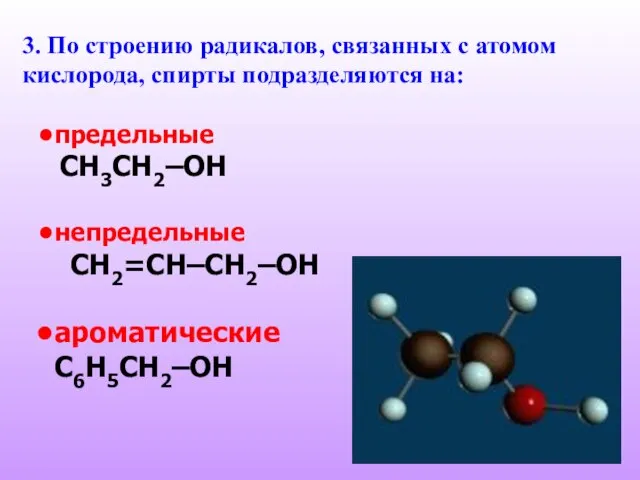
- 6. 3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на: предельные СH3CH2–OH непредельные CH2=CH–CH2–OH ароматические
- 7. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение
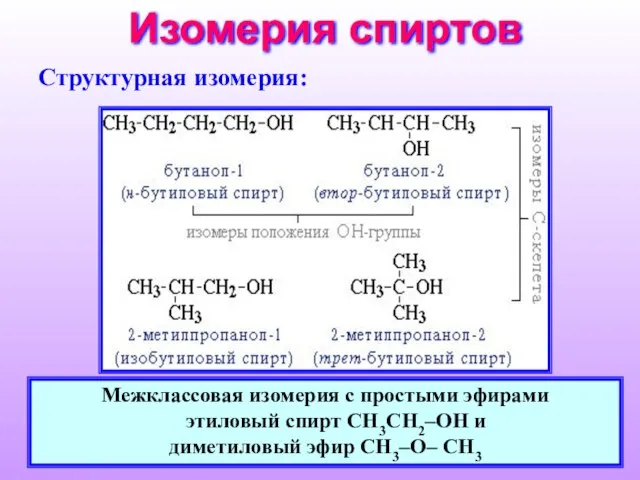
- 8. Изомерия спиртов Cтруктурная изомерия: Межклассовая изомерия с простыми эфирами этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–
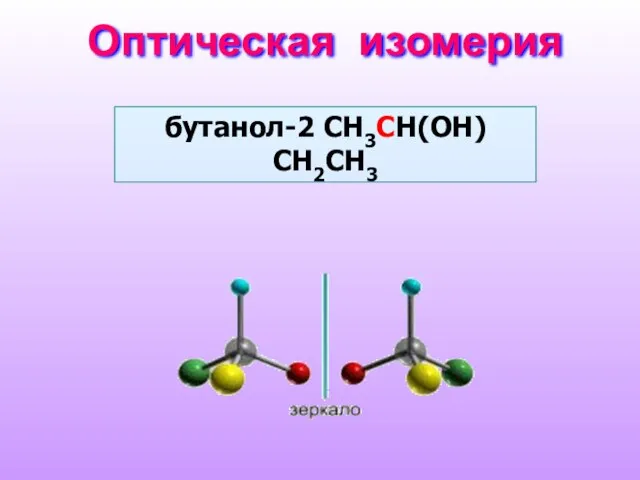
- 9. Оптическая изомерия бутанол-2 СH3CH(OH)СH2CH3
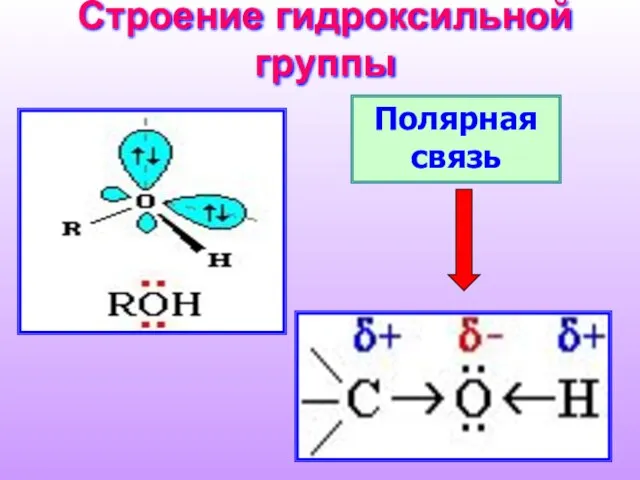
- 10. Строение гидроксильной группы Полярная связь
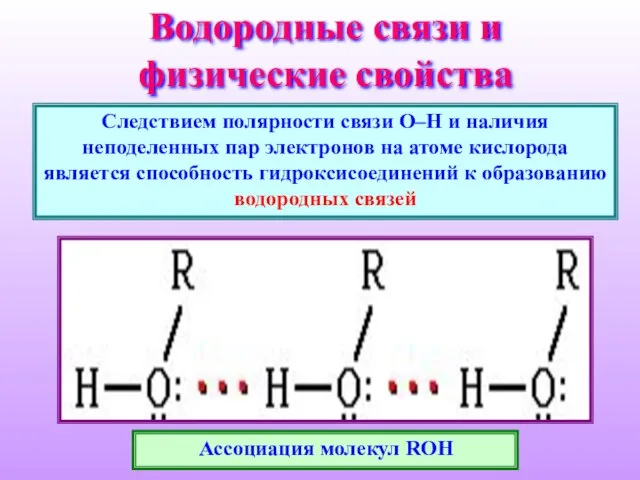
- 11. Водородные связи и физические свойства Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме
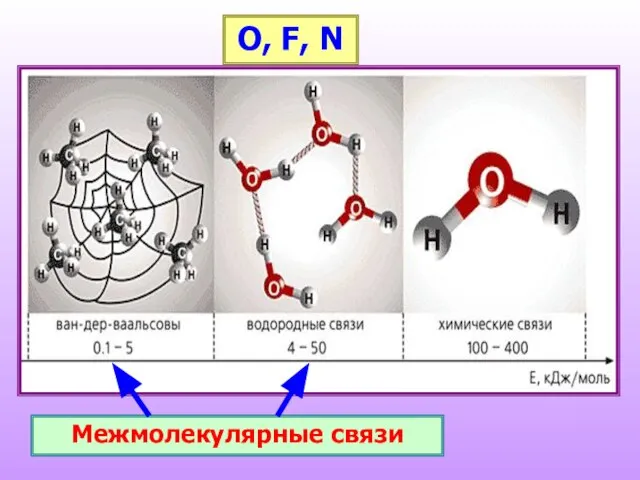
- 12. Межмолекулярные связи O, F, N
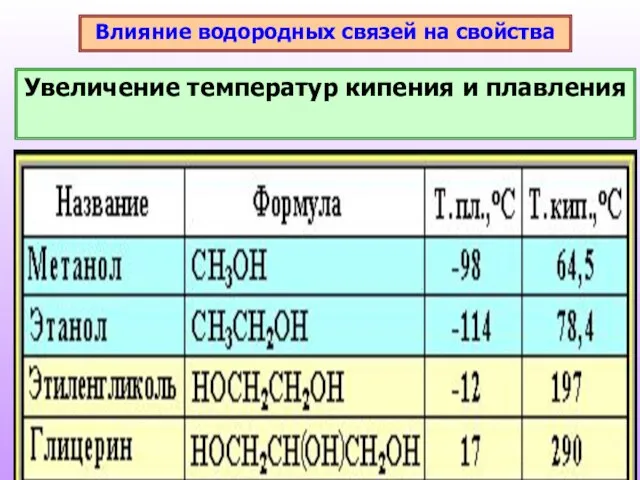
- 13. Влияние водородных связей на свойства Увеличение температур кипения и плавления
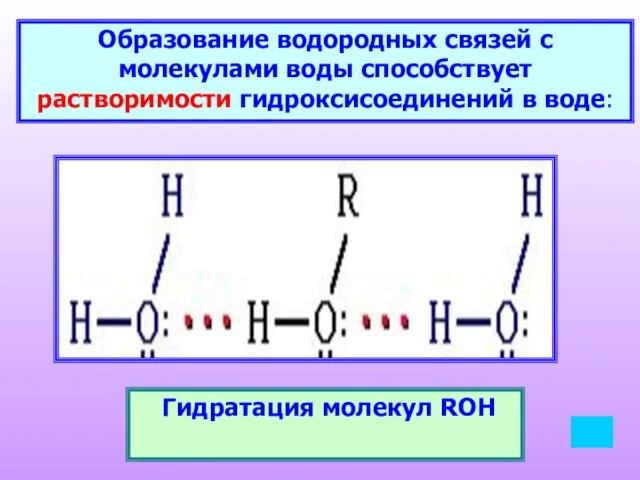
- 14. Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде: Гидратация молекул ROH
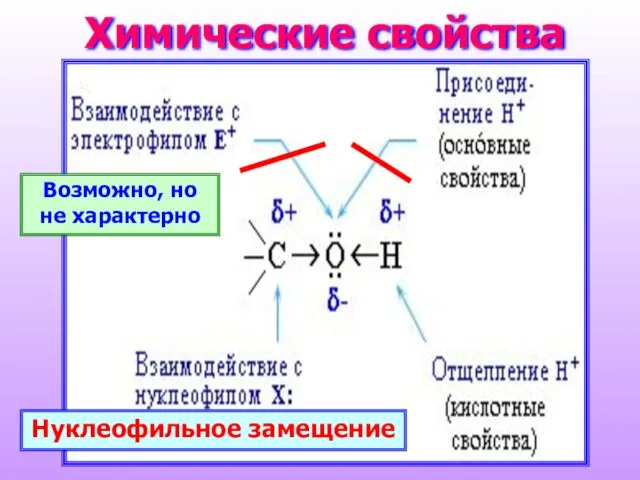
- 15. Химические свойства Нуклеофильное замещение Возможно, но не характерно
- 16. Реакции по связи О–Н CH3OH > первичные > вторичные > третичные реакции замещения атома водорода на
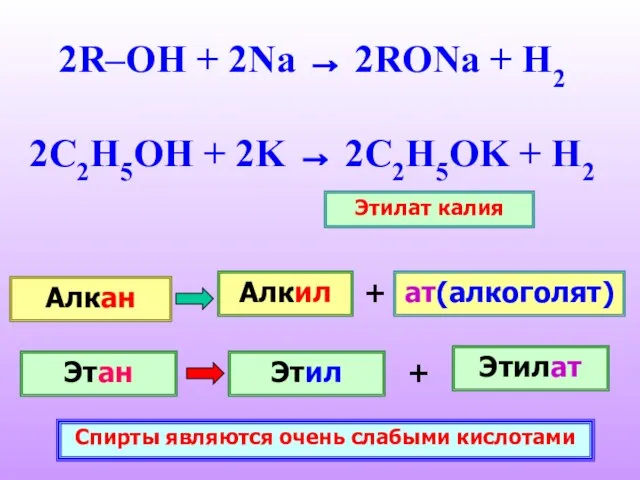
- 17. 2R–OH + 2Na → 2RONa + H2 2C2H5OH + 2K → 2C2H5OK + H2 Этилат калия
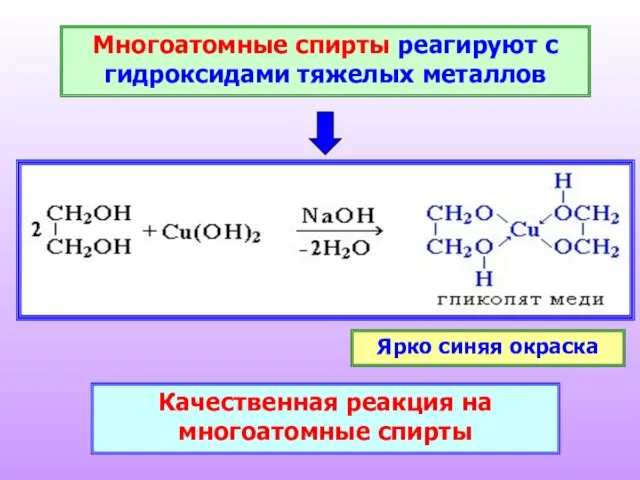
- 18. Многоатомные спирты реагируют с гидроксидами тяжелых металлов Качественная реакция на многоатомные спирты Ярко синяя окраска
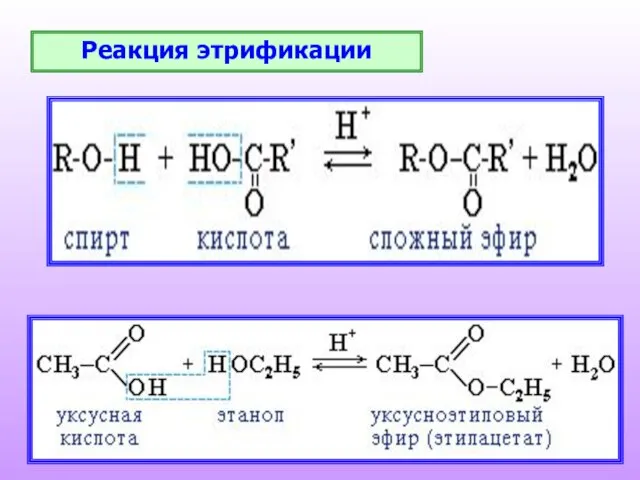
- 19. Реакция этрификации
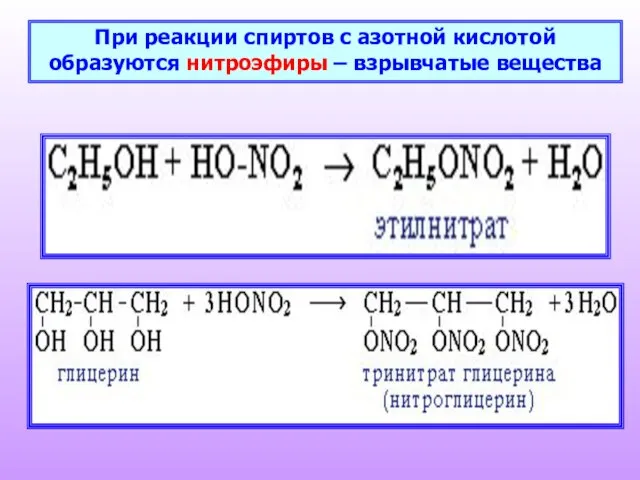
- 20. При реакции спиртов с азотной кислотой образуются нитроэфиры – взрывчатые вещества
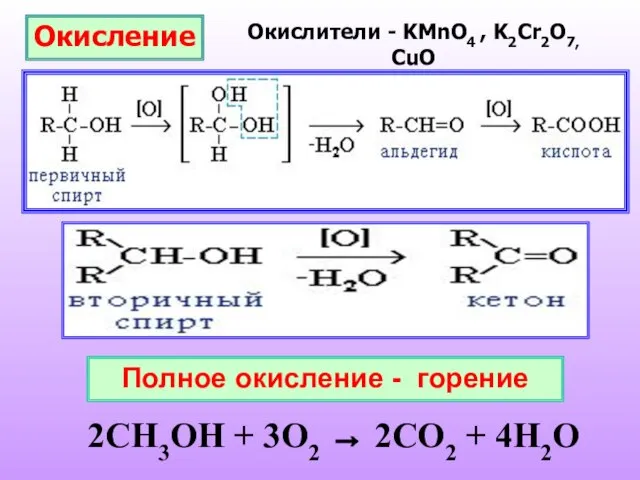
- 21. Окисление Окислители - KMnO4 , K2Cr2O7, CuO Полное окисление - горение 2CH3OH + 3O2 → 2CO2
- 22. Реакции по связи С–О нуклеофильное замещение - SN : внутримолекулярная дегидратация спиртов – образование алкенов межмолекулярная
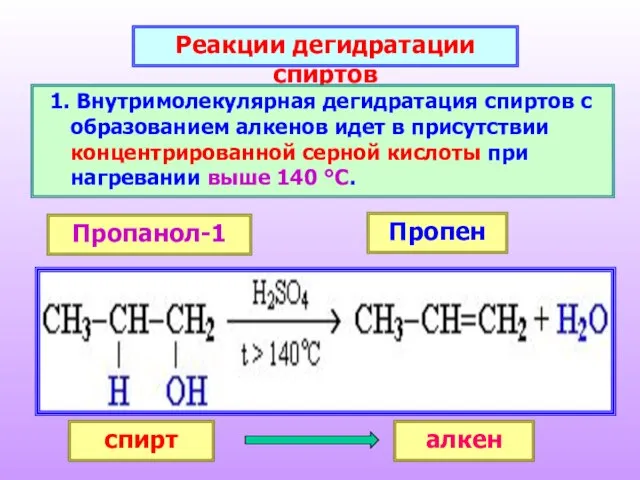
- 23. Реакции дегидратации спиртов Внутримолекулярная дегидратация спиртов с образованием алкенов идет в присутствии концентрированной серной кислоты при
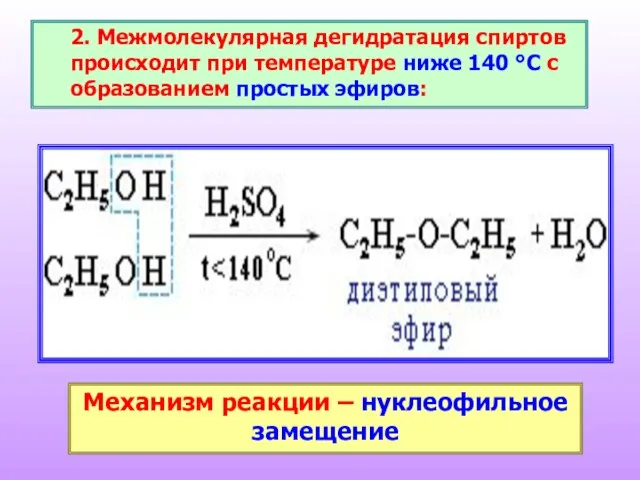
- 24. 2. Межмолекулярная дегидратация спиртов происходит при температуре ниже 140 °С с образованием простых эфиров: Механизм реакции
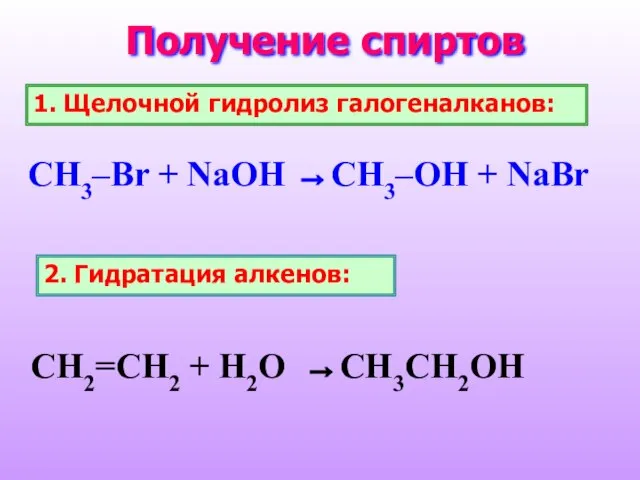
- 25. Получение спиртов 1. Щелочной гидролиз галогеналканов: CH3–Br + NaOH →CH3–OH + NaBr 2. Гидратация алкенов: CH2=CH2
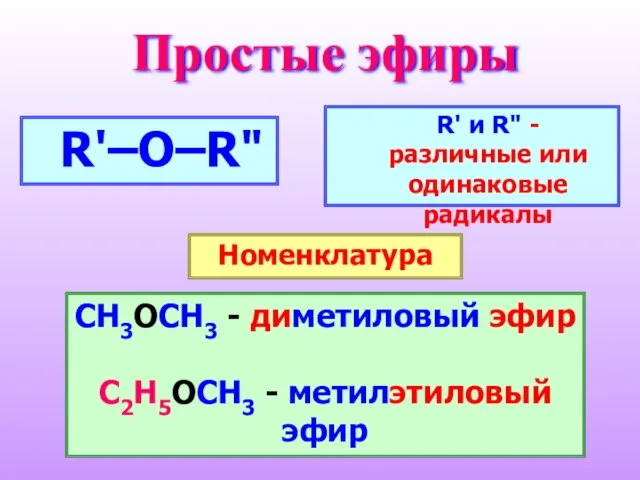
- 26. Простые эфиры R'–O–R" CH3OCH3 - диметиловый эфир C2H5OCH3 - метилэтиловый эфир R' и R" - различные
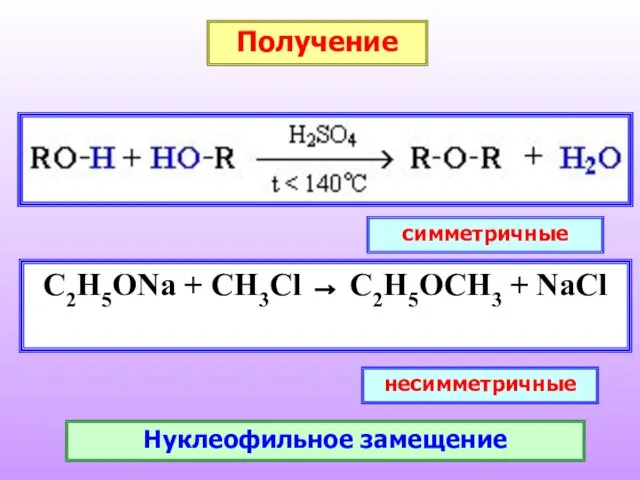
- 27. Получение C2H5ONa + CH3Cl → C2H5OCH3 + NaCl симметричные несимметричные Нуклеофильное замещение
- 29. Скачать презентацию



 Виды Австралии
Виды Австралии Презентация на тему Наука и образование 7 класс
Презентация на тему Наука и образование 7 класс Орхидеи из бумаги в технике квиллинга
Орхидеи из бумаги в технике квиллинга Способы обозначения [Й‘] на письме
Способы обозначения [Й‘] на письме Программы утилиты
Программы утилиты Портрет
Портрет Симметрия вокруг нас
Симметрия вокруг нас Гимнастика спортивная и атлетическая
Гимнастика спортивная и атлетическая Школа
Школа 222 группа. Лукояновский педагогический колледж им. А.М. Горького
222 группа. Лукояновский педагогический колледж им. А.М. Горького ГЕНЕОЛОГИЯ UNIX
ГЕНЕОЛОГИЯ UNIX МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов
МОУ сош№2 МО город Горячий Ключ7 апреля 2011 годаСобрание родителей учащихся 9-х, 10-х классов Международные договоры как источник МЧП
Международные договоры как источник МЧП example
example Новая начальная школа
Новая начальная школа Родом из бетонной коробки, или новейшая архитектура Петербурга
Родом из бетонной коробки, или новейшая архитектура Петербурга ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА.
ИСПОЛЬЗОВАНИЕ ВОЗМОЖНОСТЕЙ ИНТЕРНЕТ В РАБОТЕ УЧИТЕЛЕЙ АНГЛИЙСКОГО ЯЗЫКА. Трудности адаптации первоклассников к школе
Трудности адаптации первоклассников к школе Презентация на тему Классификация детских игр
Презентация на тему Классификация детских игр Тематическая деловая игра Государственная Дума РФ
Тематическая деловая игра Государственная Дума РФ Проектный метод в образовании
Проектный метод в образовании  Презентация на тему Возрастные особенности детей 5-6 лет
Презентация на тему Возрастные особенности детей 5-6 лет  Бизнес-марафон Взлетная полоса. Команда Fairy tale
Бизнес-марафон Взлетная полоса. Команда Fairy tale Природные памятники литосферы
Природные памятники литосферы Роль книги в интеллектуальном развитии ребенка
Роль книги в интеллектуальном развитии ребенка SHOES
SHOES Изображение фигуры человека и образ человека
Изображение фигуры человека и образ человека ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ
ПРАВОПРЕЕМСТВО ГОСУДАРСТВ В ОТНОШЕНИИ ГОСУДАРТСВЕННОЙ СОБСТВЕННОСТИ, ГОСУДАРСТВЕННЫХ ДОЛГОВ И ГОСУДАРСТВЕННЫХ АРХИВОВ