Слайд 2Цель урока:
Установить взаимосвязь между макроскопическими и микроскопическими параметрами
Научиться решать вычислительные задачи с

использованием основного уравнения МКТ
Слайд 3Макроскопические – параметры, которые можно измерить с помощью приборов.
Микроскопические – параметры, которые

измеряются косвенным путем.
Слайд 4m – масса газа
V – объем газа
t – температура газа
p –
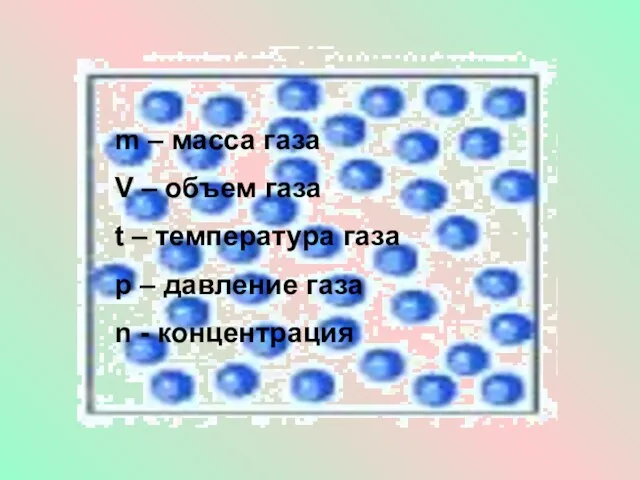
давление газа
n - концентрация
Слайд 6Модель идеального газа
1. Межмолекулярные силы притяжения отсутствуют (можно пренебречь потенциальной энергией)
2. Взаимодействия

молекул газа происходят только при их соударениях и являются упругими
3. Молекулы газа не имеют объема - рассматриваются как материальные точки
Слайд 8Это уравнение, выведенное впервые немецким физиком Р. Клаузиусом, называется основным уравнением молекулярно-кинетической

теории идеального газа. Оно устанавливает связь между микроскопическими параметрами и макроскопическими (измеряемыми) величинами.
Слайд 9Учитывая, что - средняя кинетическая энергия молекулы газа,
получим:

Слайд 10Давление идеального газа прямо пропорционально средней кинетической энергии поступательного движения молекул, содержащихся

в единице объема газа.
Слайд 12Задача №1.
Каково давление азота, если средняя
квадратичная скорость его молекул
500 м/с, а

его плотность 1,36 кг/м3 ?
Слайд 14Задача №2.
Имеются два одинаковых сосуда. В одном из них находится кислород,

а в другом азот. Число молекул каждого газа и средние квадраты их скоростей одинаковы. Давление кислорода равно 32 кПа. Чему равно давление азота?








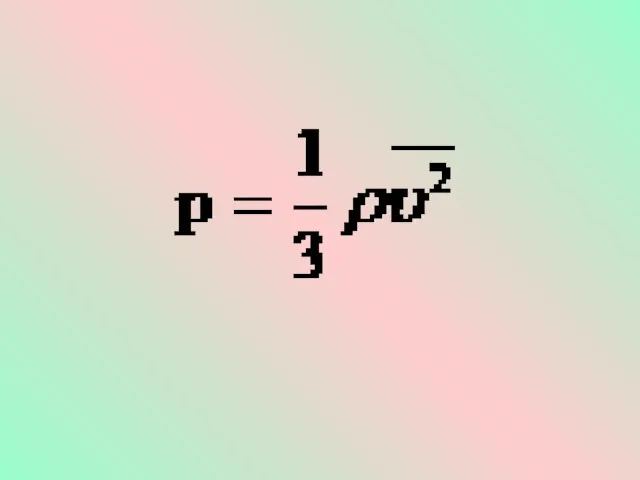



 Активизация деятельности учащихся с помощью интерактивных технологий
Активизация деятельности учащихся с помощью интерактивных технологий ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ
ЭЛЕКТРОННАЯ ВЕРСИЯ ПРОТОКОЛОВ ВЕДЕНИЯ БОЛЬНЫХ Грибы. Общая характеристика грибов. Шляпочные грибы
Грибы. Общая характеристика грибов. Шляпочные грибы Правила устройства и безопасной эксплуатации сосудов, работающих под давлением
Правила устройства и безопасной эксплуатации сосудов, работающих под давлением Санкт-Петербургский государственный университетинформационных технологий, механики и оптики
Санкт-Петербургский государственный университетинформационных технологий, механики и оптики Геометрия корпуса судна
Геометрия корпуса судна Ознакомление с технологией изготовления витража
Ознакомление с технологией изготовления витража Достопримечательности Зарубежной Азии - Япония
Достопримечательности Зарубежной Азии - Япония Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека
Представления о функциональном состоянии эффективностной стороны деятельности или поведения человека УСТРОЙСТВА ПЛАВНОГО ПУСКА
УСТРОЙСТВА ПЛАВНОГО ПУСКА Презентация на тему Теллур
Презентация на тему Теллур  Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны
Форма правления – республика. Глава государства – королева Великобритании, представленная генерал-губернатором. Законодательны Художник в театре
Художник в театре VoevodinskaiaIndustrijaMesa
VoevodinskaiaIndustrijaMesa Творческое объединение лего-мастерская Шелезяка. Робототехника
Творческое объединение лего-мастерская Шелезяка. Робототехника Александр Иванович Куприн
Александр Иванович Куприн Рассказ на свободную тему
Рассказ на свободную тему Prezentatsia_Microsoft_PowerPoint
Prezentatsia_Microsoft_PowerPoint Дворцово-парковые ансамбли
Дворцово-парковые ансамбли Статистические методы в параметрическом анализе
Статистические методы в параметрическом анализе Параллельное и последовательное соединения проводников
Параллельное и последовательное соединения проводников Зерновые культуры (7 класс)
Зерновые культуры (7 класс) Ой, да Краснодарский край!
Ой, да Краснодарский край! Россия в условиях Первой мировой войны и общенационального кризиса
Россия в условиях Первой мировой войны и общенационального кризиса Кроссворд по сказкамГанса Христиана Андерсена
Кроссворд по сказкамГанса Христиана Андерсена Проект Free Way Кучер Максим Краснодар
Проект Free Way Кучер Максим Краснодар Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот
Цели урока Цель: познакомить с понятием «причастный оборот» и с его синтаксическим синонимом – предложением с союзным словом «кот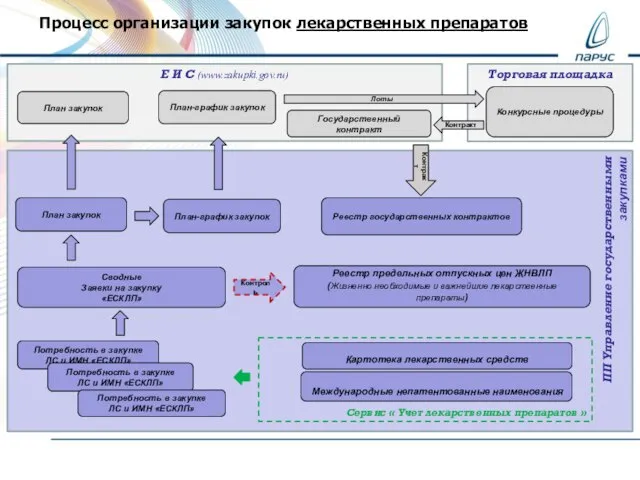 ПФХД_Закуупки_Бухгалтерия
ПФХД_Закуупки_Бухгалтерия