Содержание
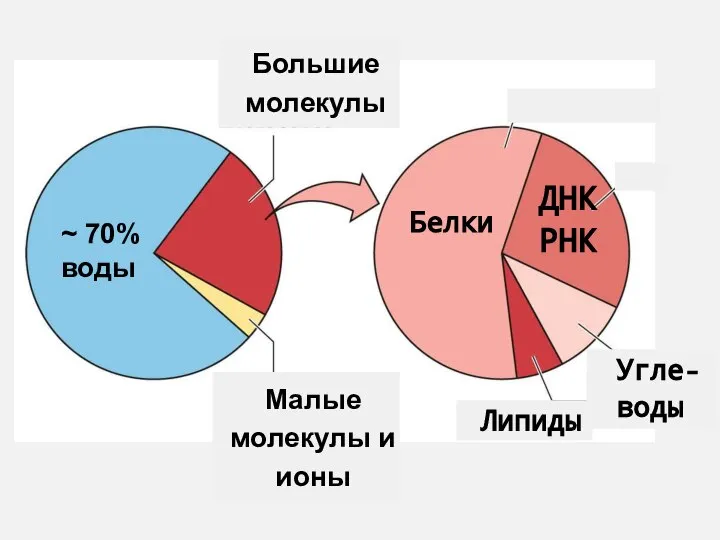
- 2. Из чего состоят клетки? 70-80 % – вода Цитоплазма клетки – водный раствор различных веществ, большую
- 3. Вещества клетки Органические Неорганические Белки Нуклеиновые кислоты (ДНК и РНК) Углеводы Липиды Витамины, АТФ Вода, ионы,
- 5. Вещества клетки Макромолекулы (полимеры) Простые молекулы Белки Нуклеиновые кислоты Вся неорганика «Кирпичики» макромолекул Витамины, АТФ Липиды
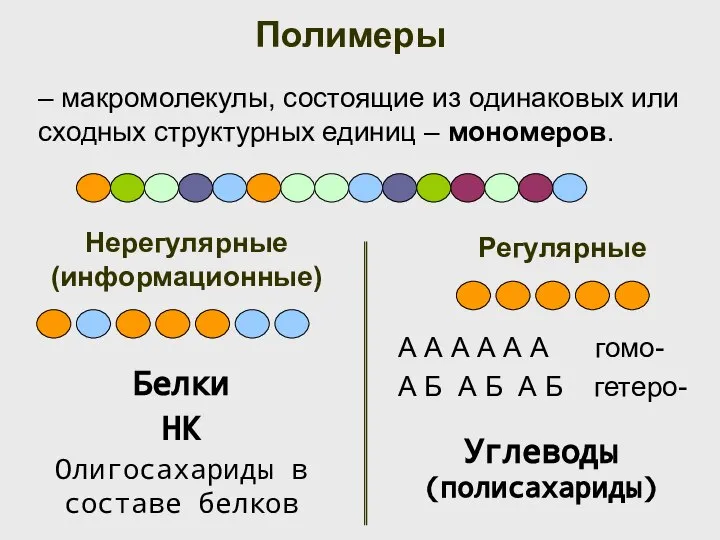
- 6. Полимеры – макромолекулы, состоящие из одинаковых или сходных структурных единиц – мономеров. Регулярные Нерегулярные (информационные) А
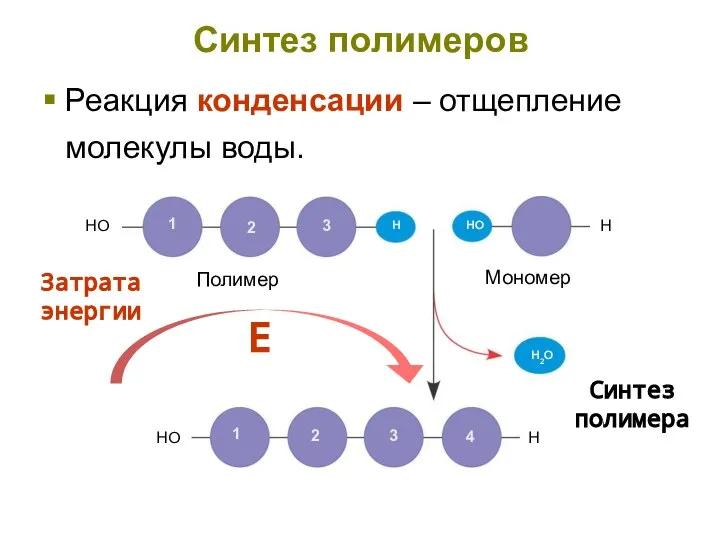
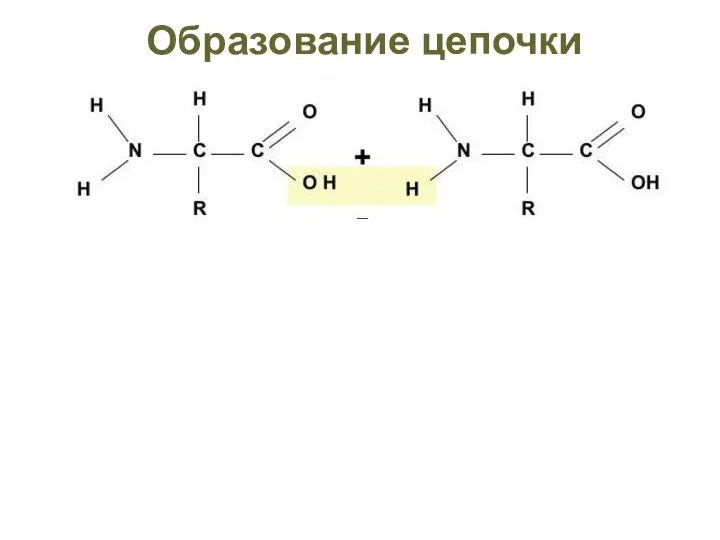
- 7. Синтез полимеров Реакция конденсации – отщепление молекулы воды. Затрата энергии Е Синтез полимера
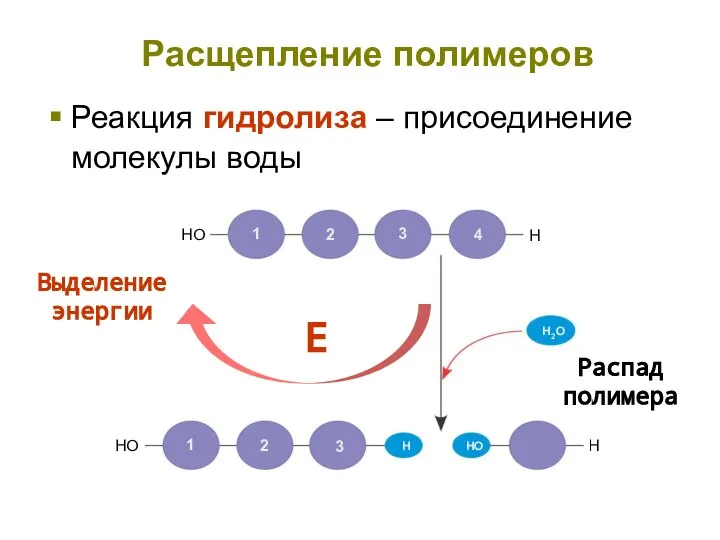
- 8. Реакция гидролиза – присоединение молекулы воды HO H Расщепление полимеров Распад полимера Выделение энергии Е
- 9. Свойства воды
- 10. Процент воды в тканях Мозг……………….... 70- 85 Мышцы…………….. 75 Кожа……………….... 70 Соединительная…. 60 Кости………………... 25 Жировая…………….
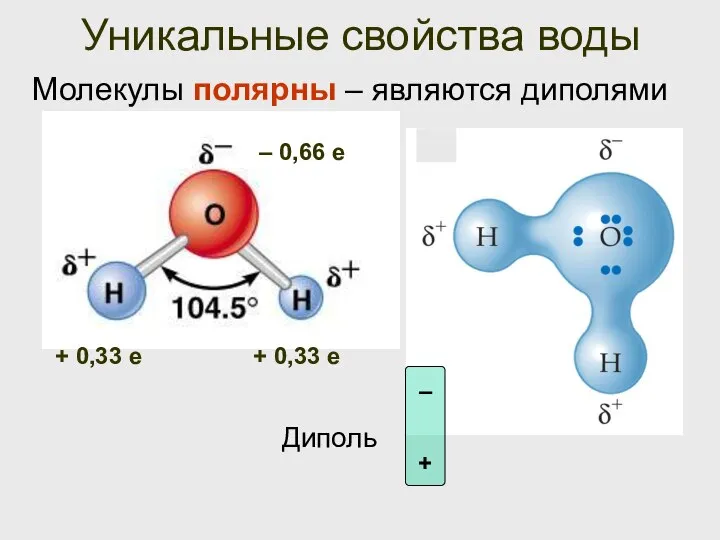
- 11. Уникальные свойства воды Молекулы полярны – являются диполями
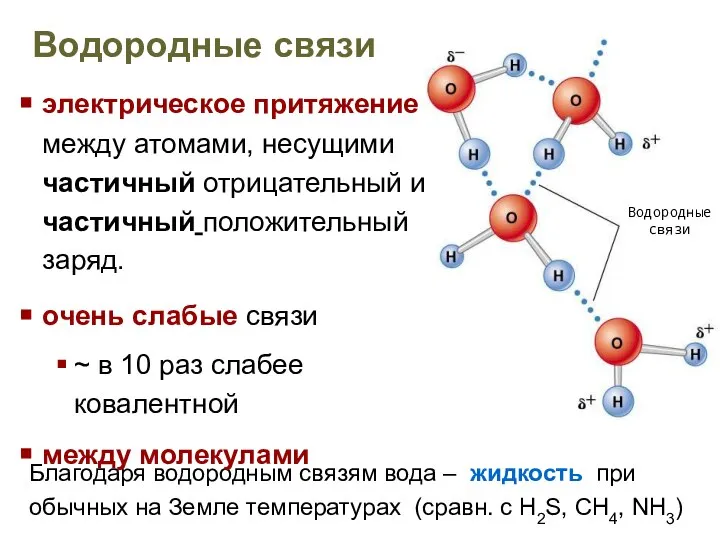
- 12. Водородные связи Благодаря водородным связям вода – жидкость при обычных на Земле температурах (сравн. с H2S,
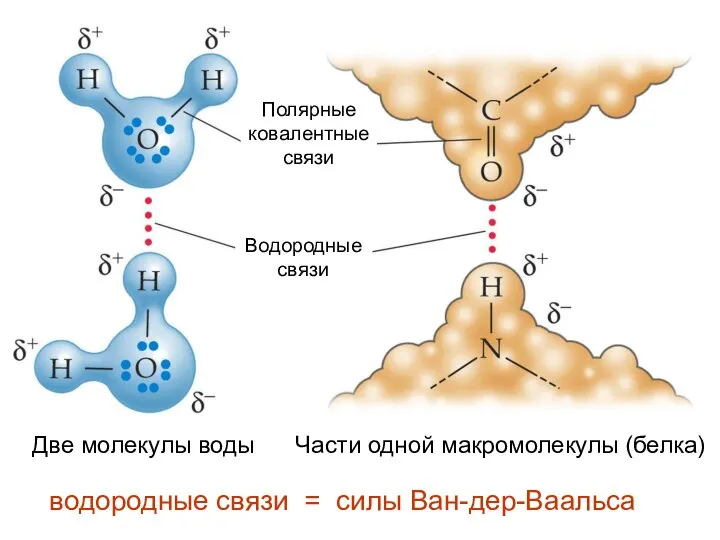
- 13. водородные связи = силы Ван-дер-Ваальса
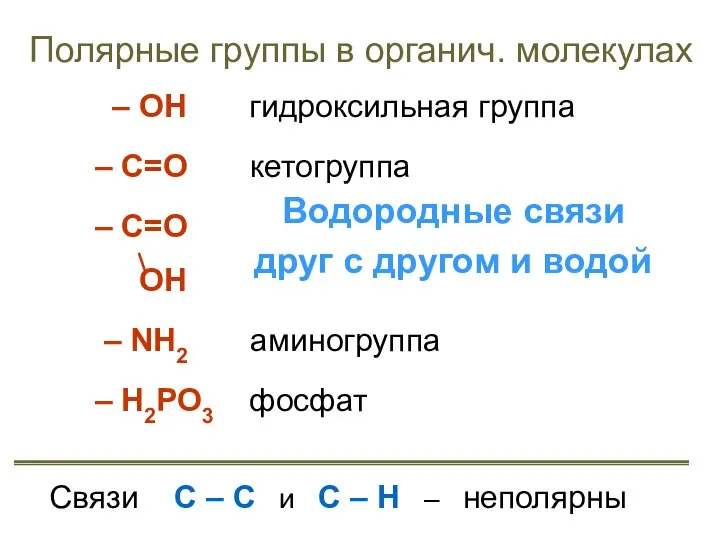
- 14. Полярные группы в органич. молекулах – ОН гидроксильная группа – С=О кетогруппа – С=О карбоксильная группа
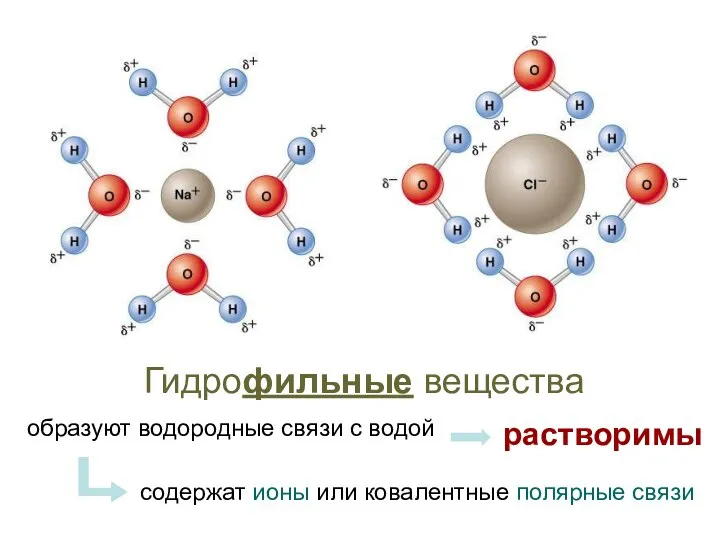
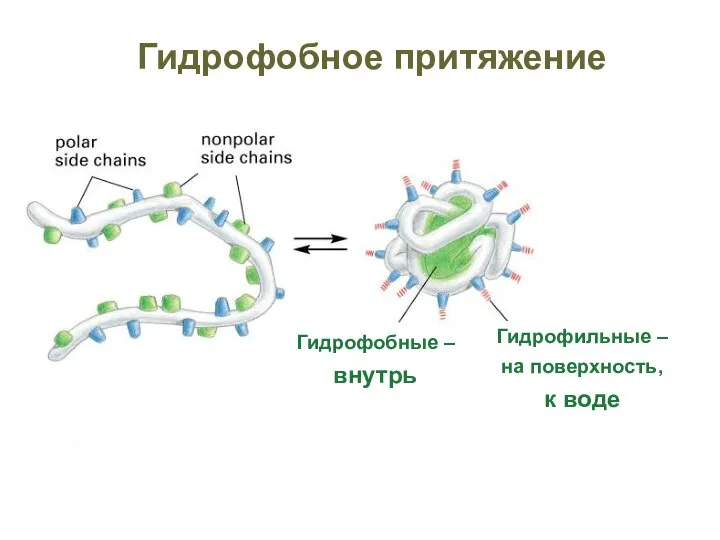
- 15. Гидрофильные вещества образуют водородные связи с водой содержат ионы или ковалентные полярные связи растворимы
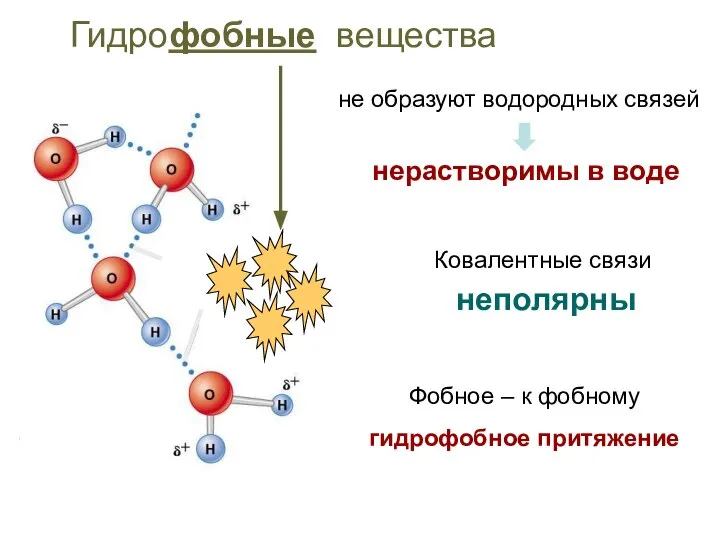
- 16. Ковалентные связи неполярны Гидрофобные вещества не образуют водородных связей нерастворимы в воде Фобное – к фобному
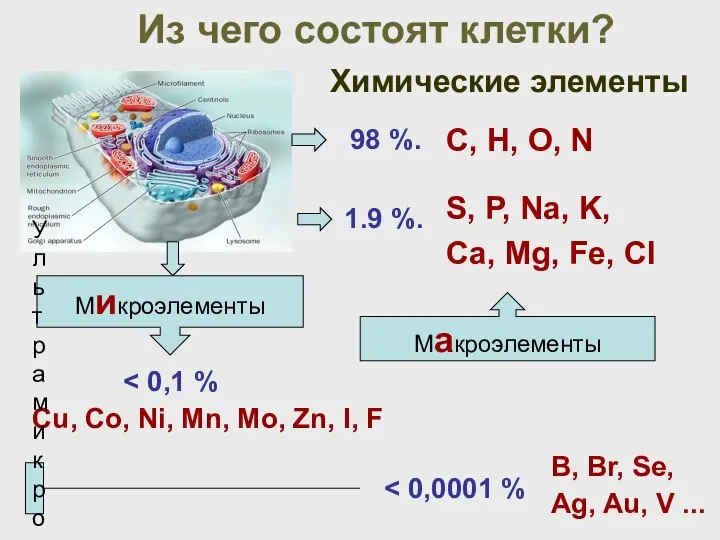
- 17. Из чего состоят клетки? Химические элементы Макроэлементы
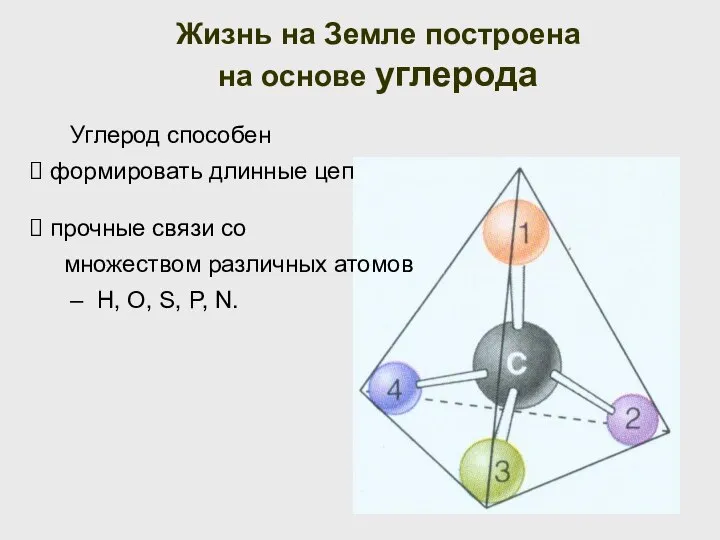
- 18. Углерод способен формировать длинные цепочки; Жизнь на Земле построена на основе углерода прочные связи со множеством
- 19. Б Е Л К И Тема 1. Биологические молекулы Часть 1. Строение.
- 20. БЕЛКИ = ПРОТЕИНЫ (от греч. protos – первый, главный)
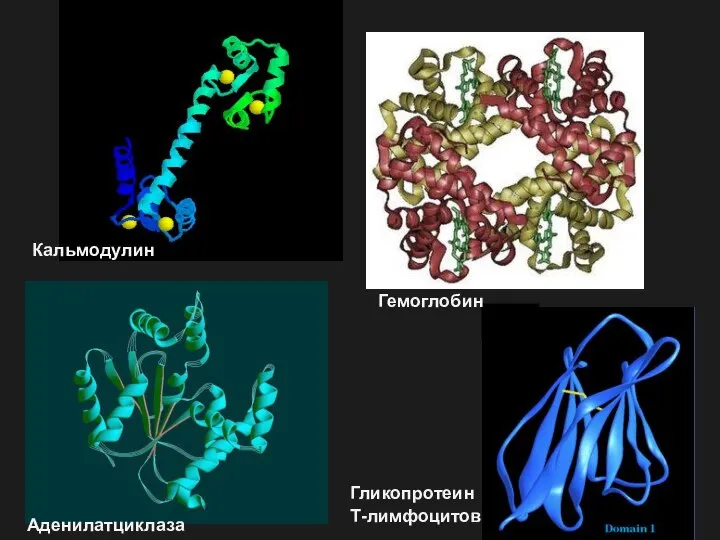
- 21. Кальмодулин Гемоглобин Гликопротеин Т-лимфоцитов Аденилатциклаза
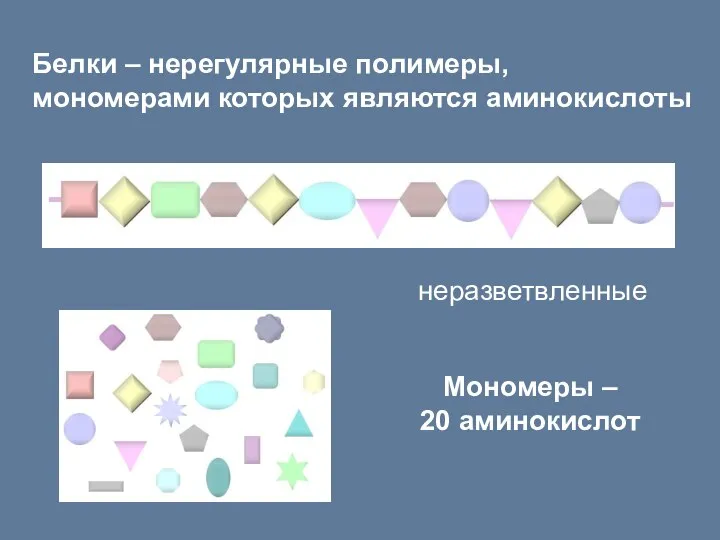
- 22. Белки – нерегулярные полимеры, мономерами которых являются аминокислоты Мономеры – 20 аминокислот неразветвленные
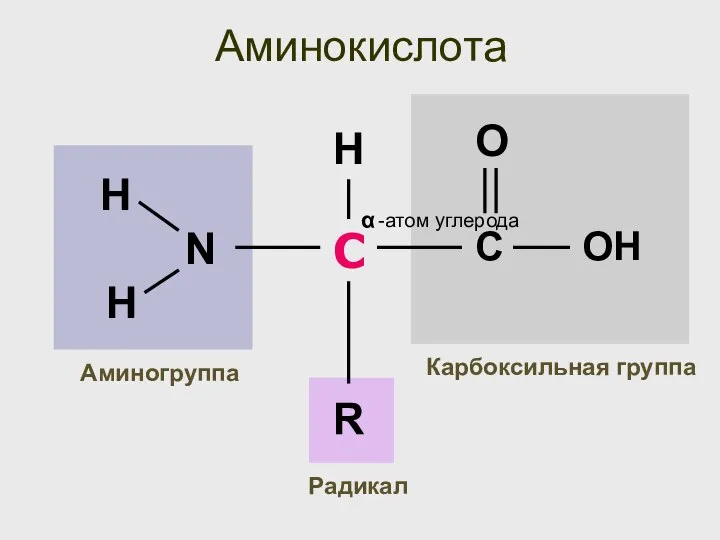
- 23. Аминокислота С -атом углерода α Карбоксильная группа Аминогруппа R H Радикал
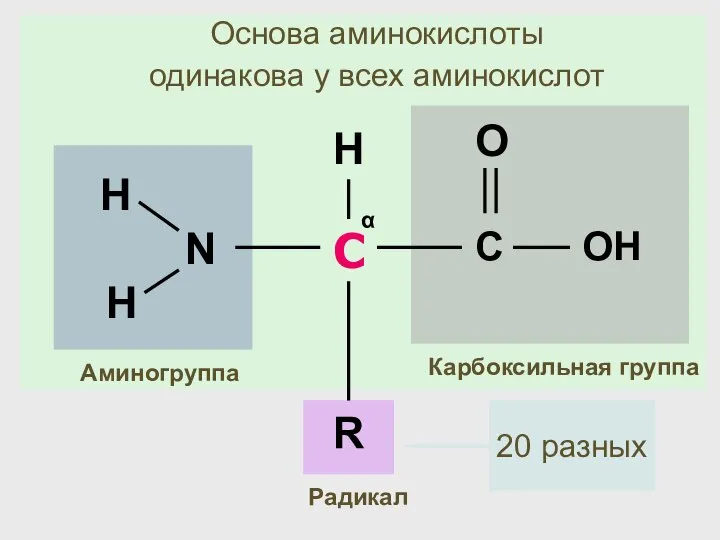
- 24. С α Карбоксильная группа Аминогруппа R H Радикал Основа аминокислоты одинакова у всех аминокислот 20 разных
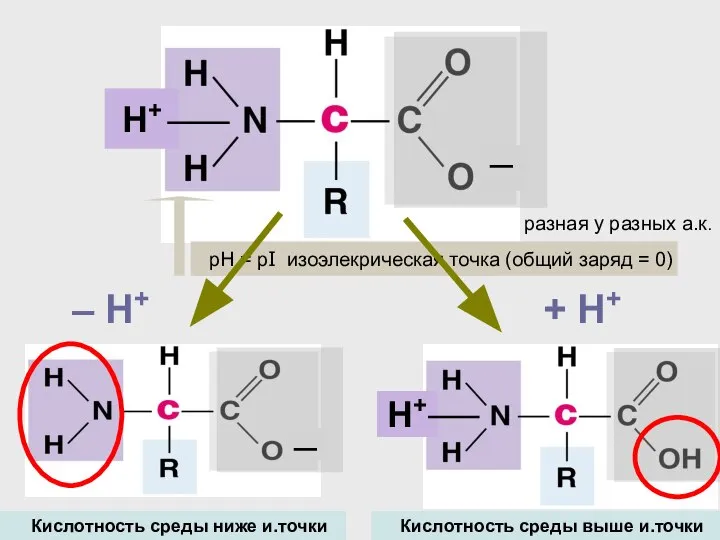
- 25. ─ Н+ разная у разных а.к. + H+ – H+ Кислотность среды выше и.точки Кислотность среды
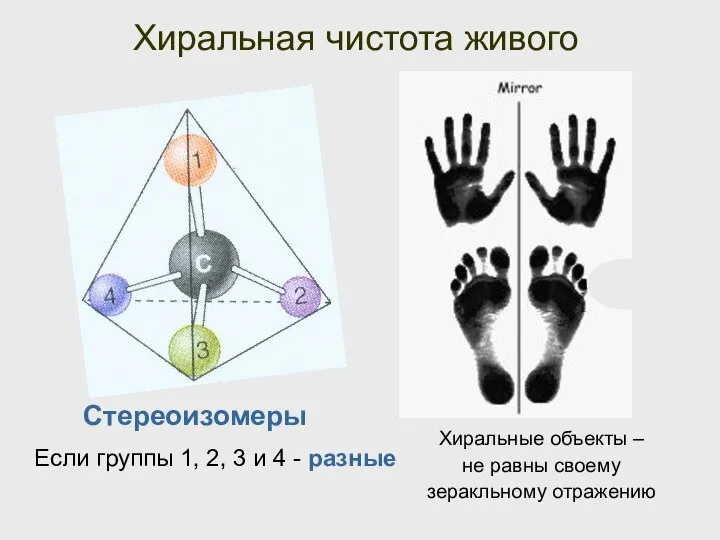
- 26. Хиральная чистота живого Если группы 1, 2, 3 и 4 - разные Хиральные объекты – не
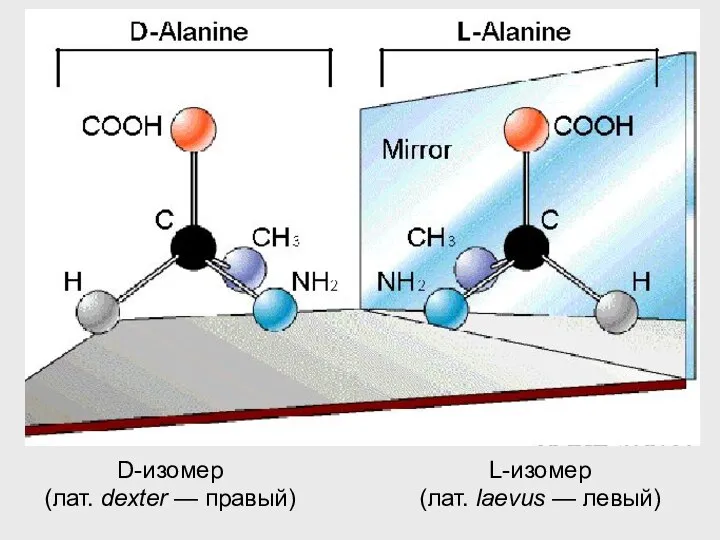
- 27. D-изомер (лат. dexter — правый) L-изомер (лат. laevus — левый)
- 28. Незаменимые аминокислоты Организм не может синтезировать сам → должны поступать с пищей. Для человека это: валин,
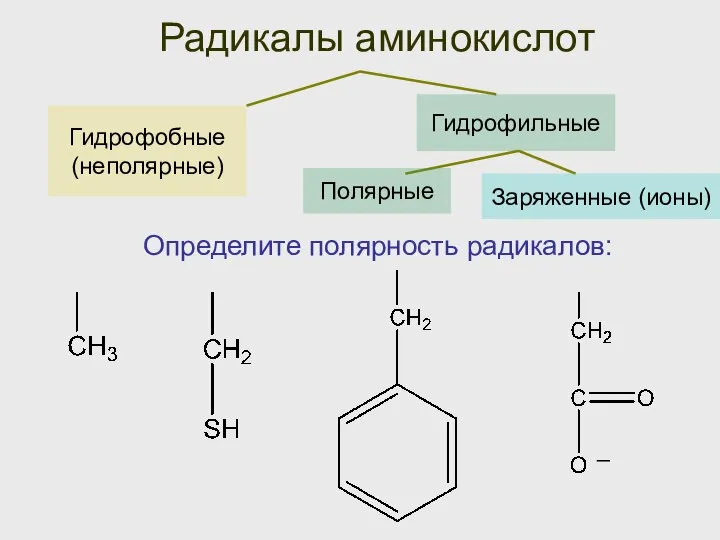
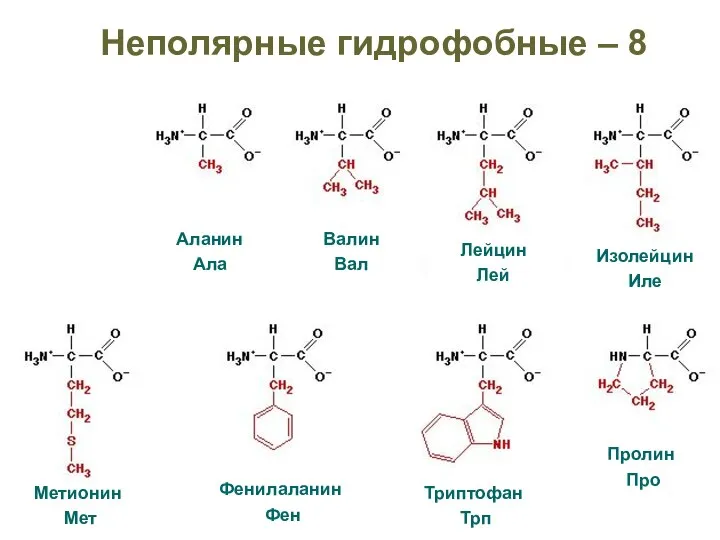
- 29. Гидрофобные (неполярные) Радикалы аминокислот Гидрофильные Определите полярность радикалов:
- 30. Неполярные гидрофобные – 8
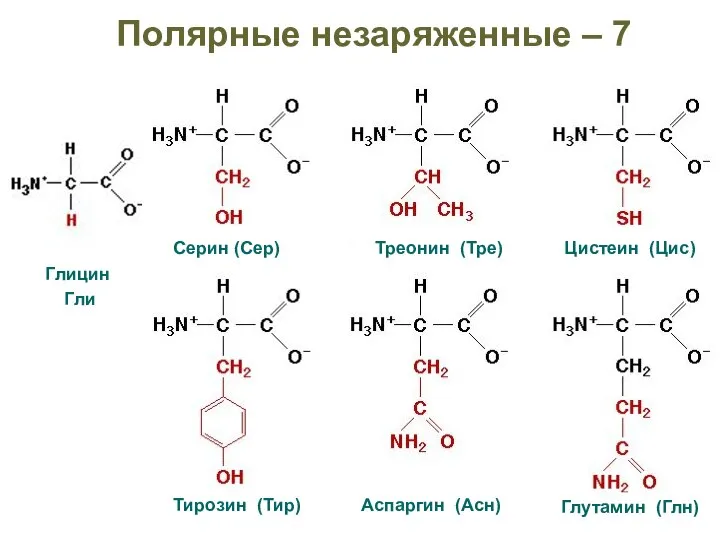
- 31. Полярные незаряженные – 7 Глицин Гли
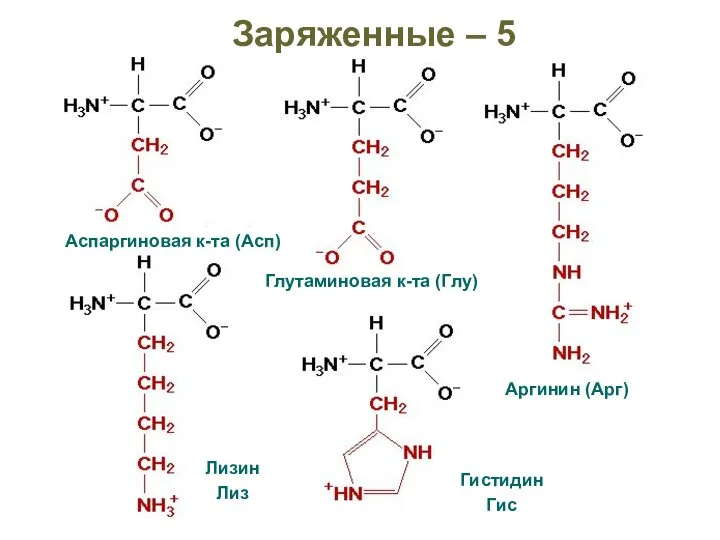
- 32. Заряженные – 5
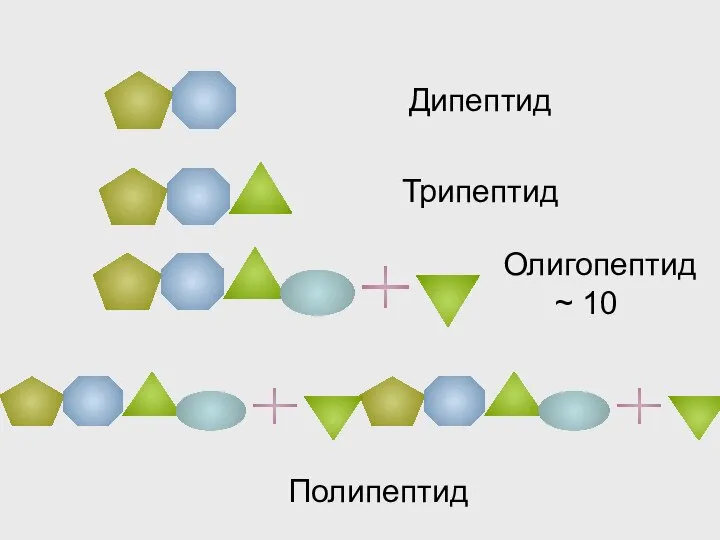
- 34. Дипептид Трипептид Олигопептид ~ 10 Полипептид
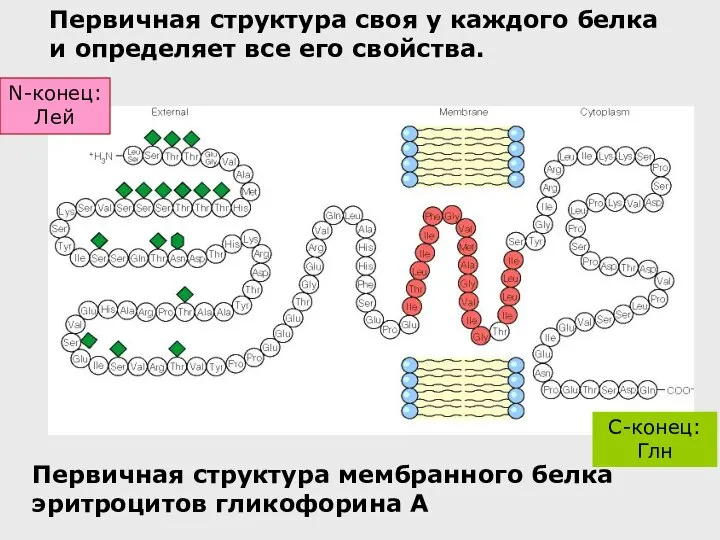
- 35. Первичная структура белка – это последовательность аминокислот в полипептидной цепочке, записанная в порядке N……..C. (соответствует направлению
- 36. Первичная структура мембранного белка эритроцитов гликофорина А C-конец: Глн Первичная структура своя у каждого белка и
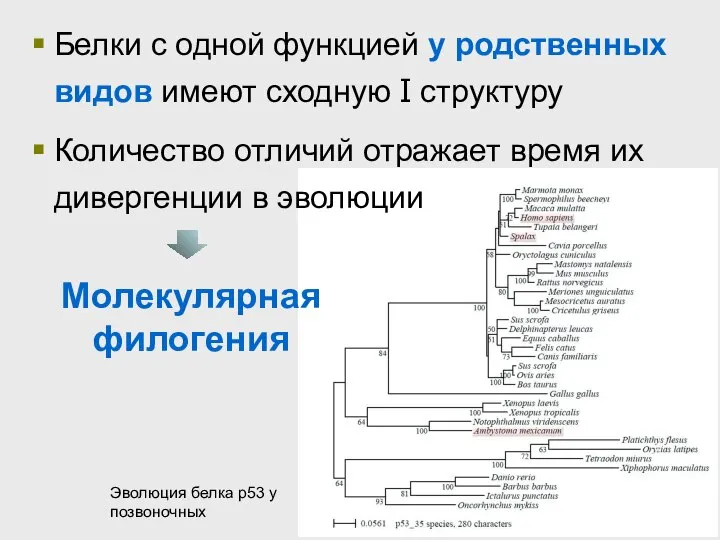
- 37. Белки с одной функцией у родственных видов имеют сходную I структуру Количество отличий отражает время их
- 38. Эволюция шаперонина-60 за ~1.5 млрд.лет Растения и грибы Животные Простейшие Бактерии Найдите участки белка, эволюционирующие быстро
- 39. Сколько разных белков длиной в n мономеров можно построить из 20 а.к.? 20n Средний белок: 300
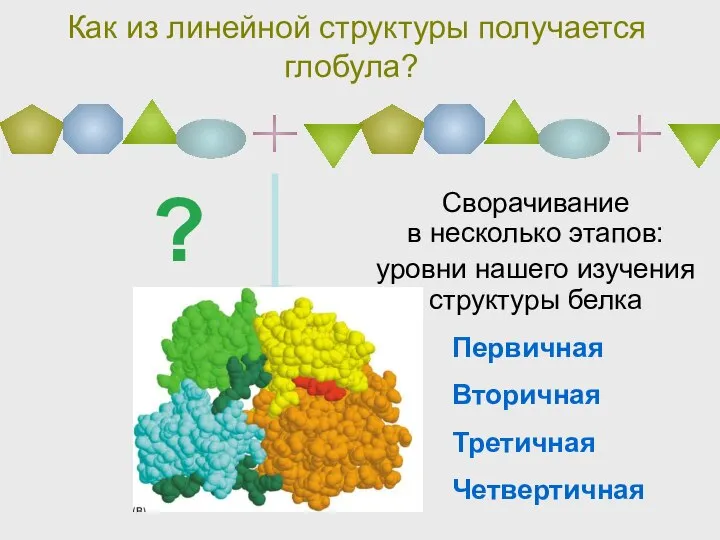
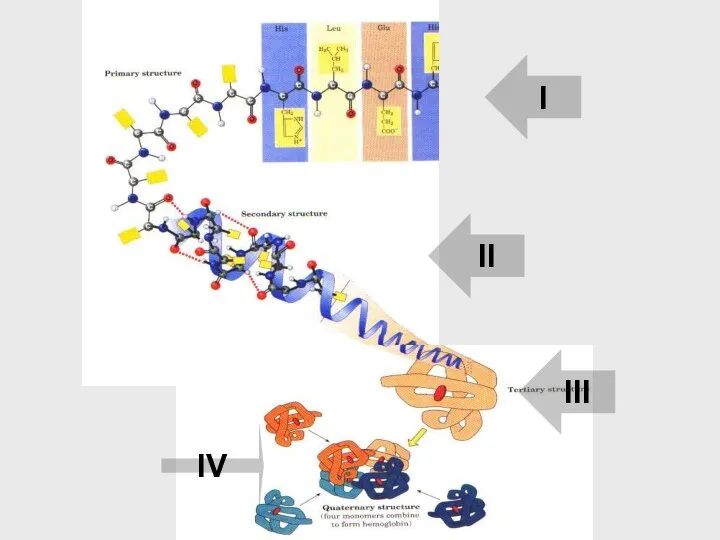
- 40. Как из линейной структуры получается глобула? Сворачивание в несколько этапов: уровни нашего изучения структуры белка ?
- 41. I II III IV
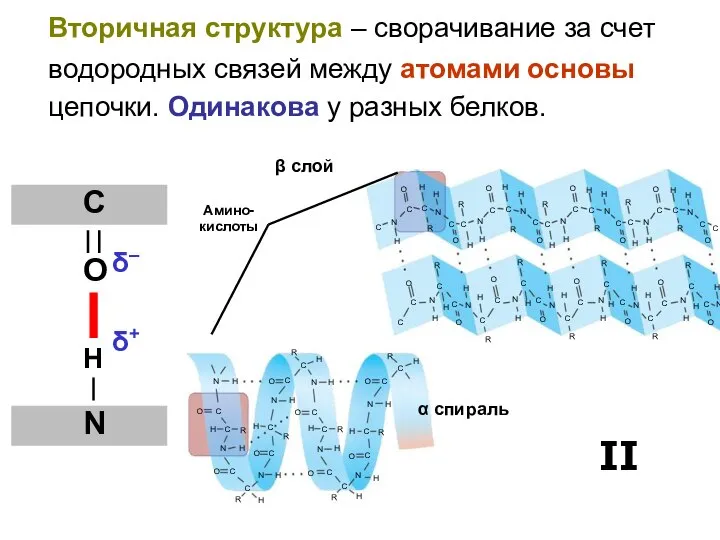
- 42. Вторичная структура – сворачивание за счет водородных связей между атомами основы цепочки. Одинакова у разных белков.
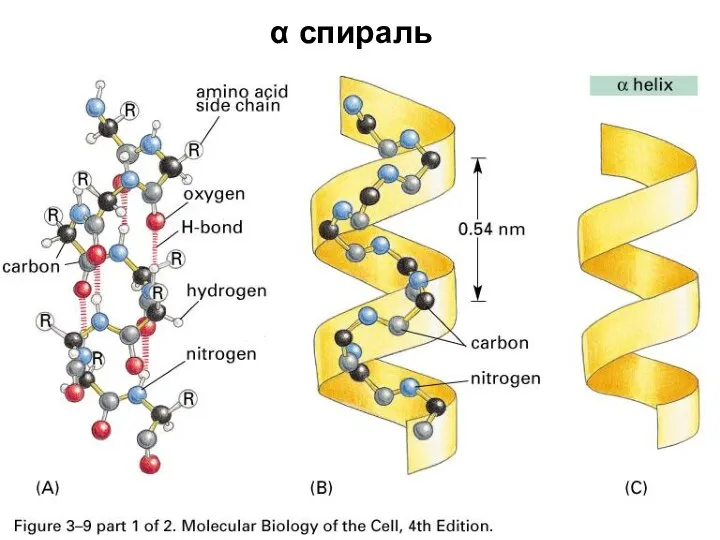
- 43. α спираль
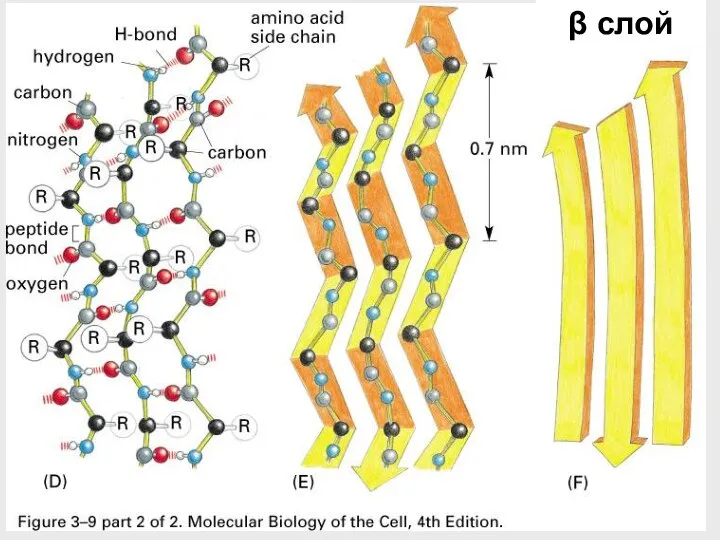
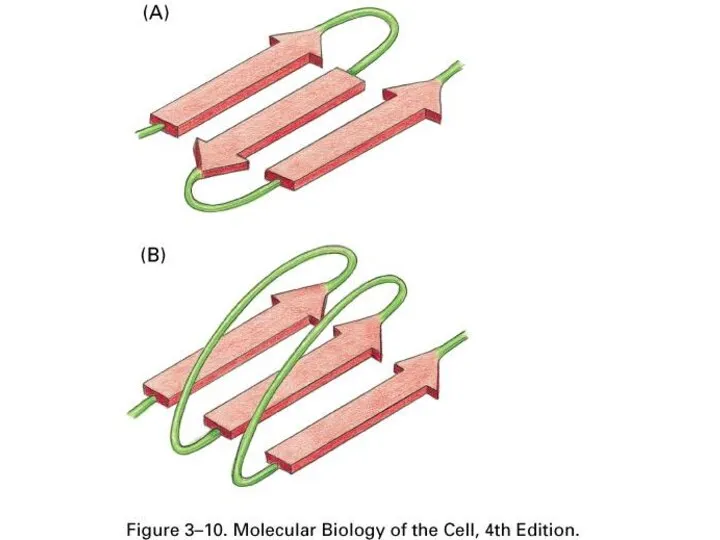
- 44. β слой
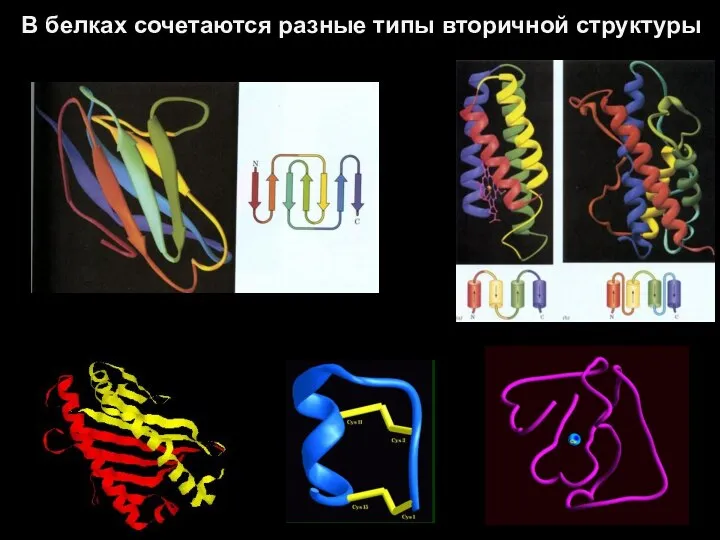
- 46. В белках сочетаются разные типы вторичной структуры
- 47. Встречаемость в белках разных вторичных структур 28% – 35% 18% – 26% 40% – 50% Нет
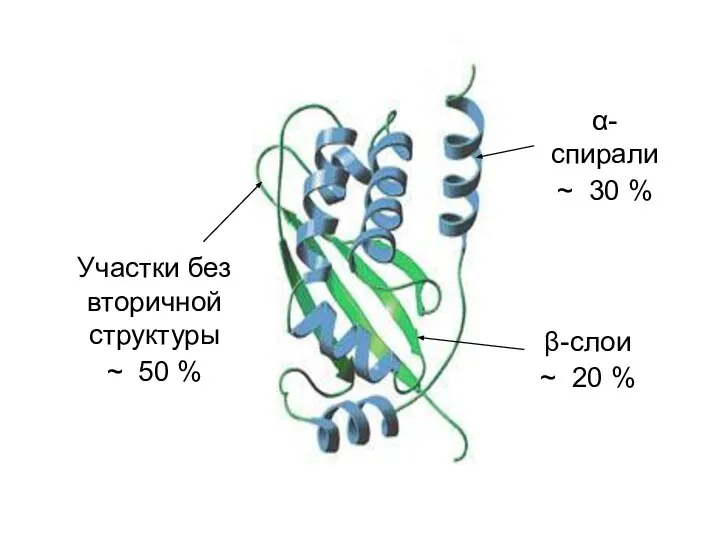
- 48. α-спирали ~ 30 % β-слои ~ 20 % Участки без вторичной структуры ~ 50 %
- 49. Лайнус Полинг Открыл α-спираль в 1951
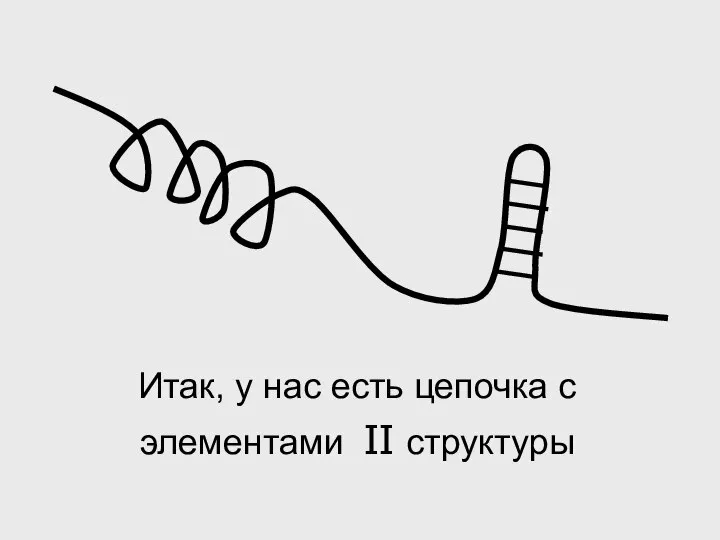
- 50. Итак, у нас есть цепочка с элементами II структуры
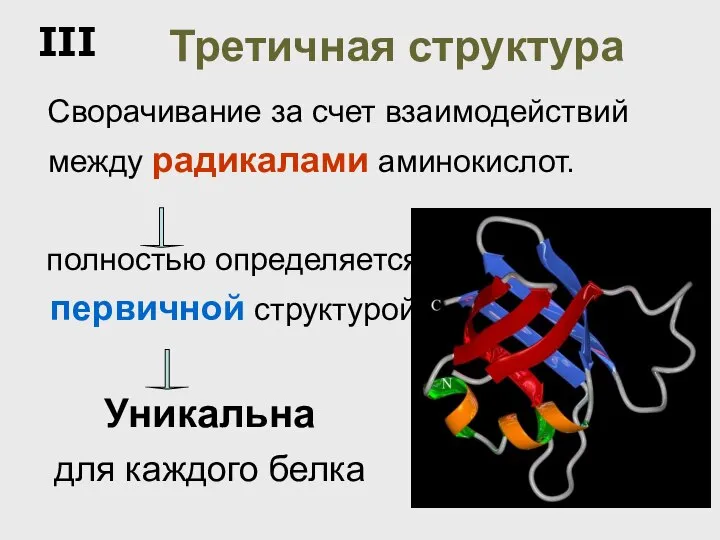
- 51. Третичная структура Сворачивание за счет взаимодействий между радикалами аминокислот. Уникальна для каждого белка полностью определяется первичной
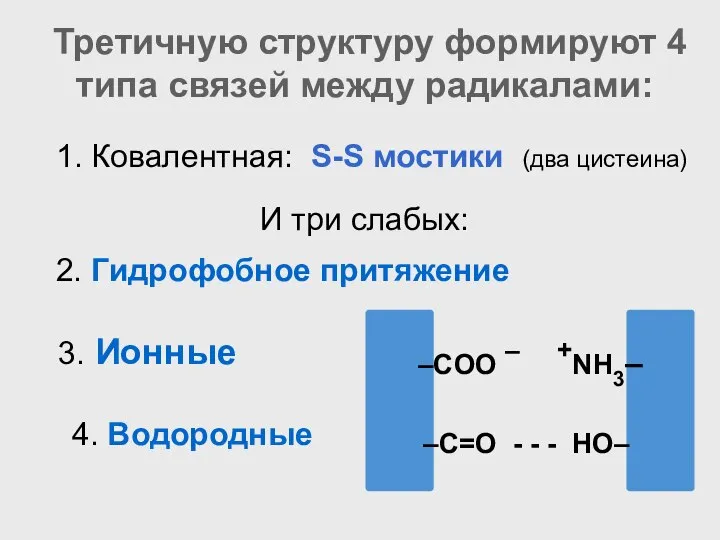
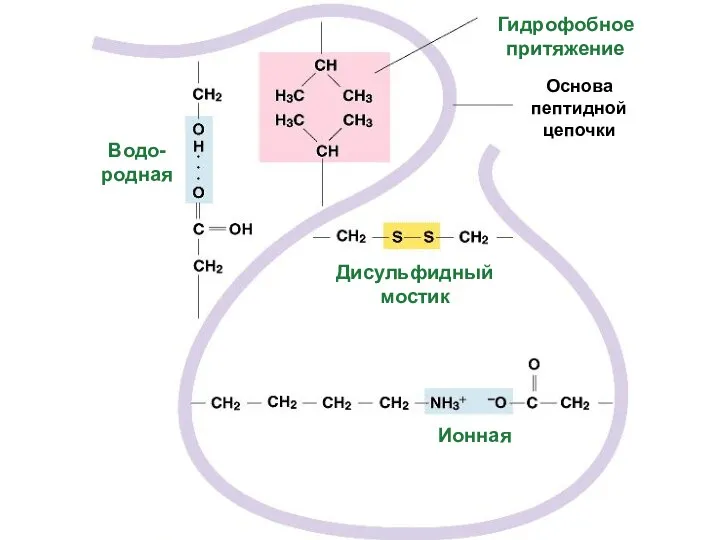
- 52. Третичную структуру формируют 4 типа связей между радикалами: 3. Ионные –COO – +NH3– –C=O - -
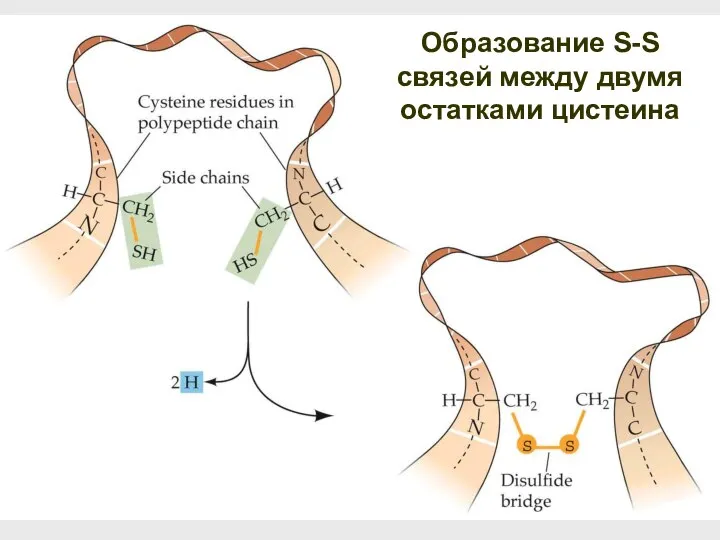
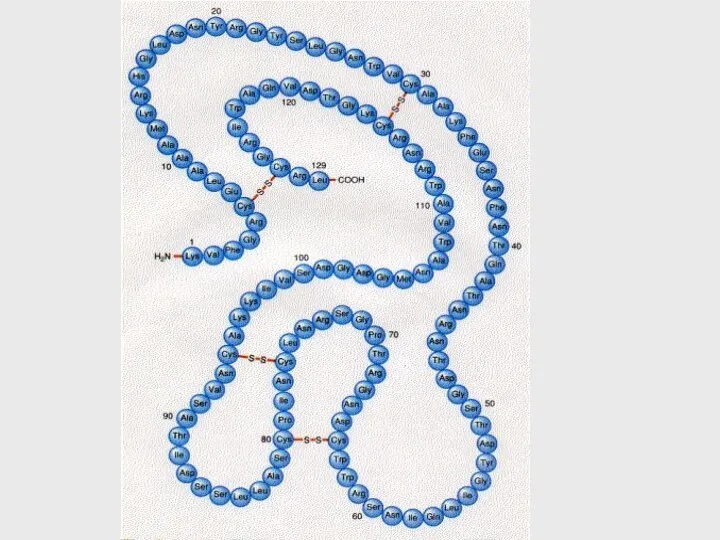
- 53. Образование S-S связей между двумя остатками цистеина
- 55. Гидрофобное притяжение
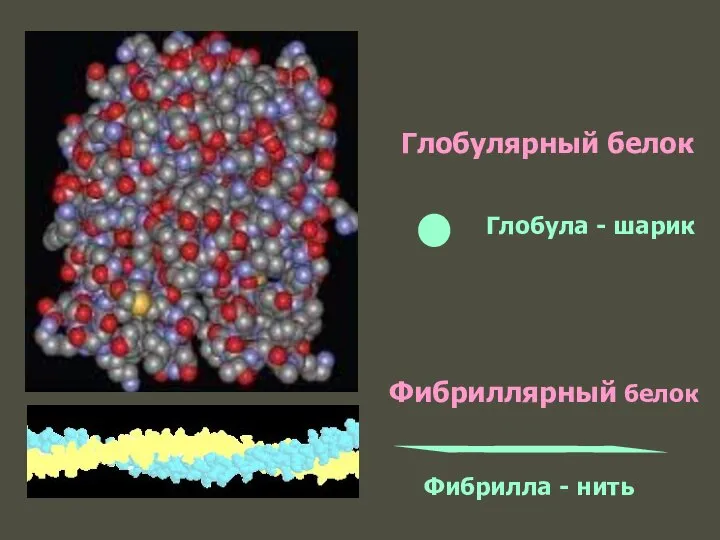
- 57. Глобулярный белок Фибриллярный белок Глобула - шарик Фибрилла - нить
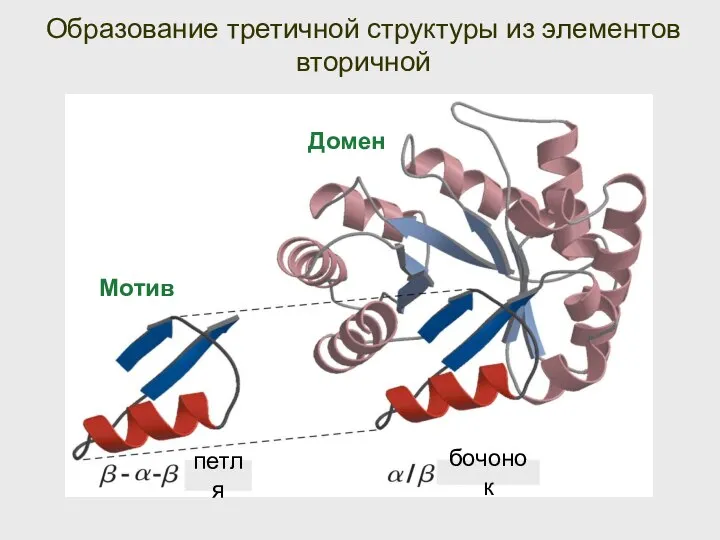
- 58. Образование третичной структуры из элементов вторичной Мотив Домен
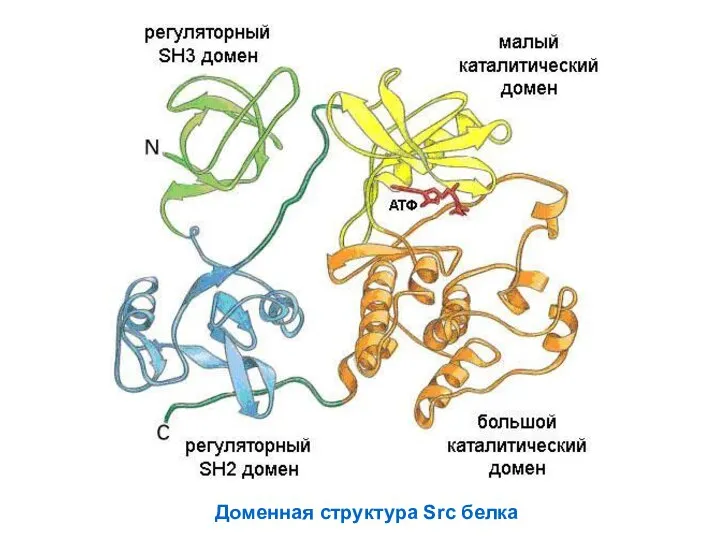
- 59. Доменная структура Src белка
- 60. Домен – часть белка пространственно обособленная сворачивается независимо выполняет одну функцию В эволюции домены – функциональные
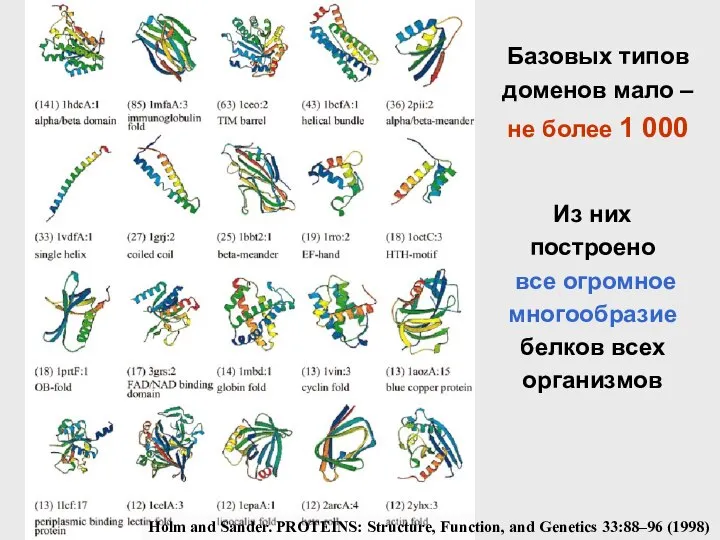
- 61. Базовых типов доменов мало – не более 1 000 Holm and Sander. PROTEINS: Structure, Function, and
- 62. Белки разных биологических видов с одной функцией – похожи по пространственной форме Хотя первичная последователь-ность может
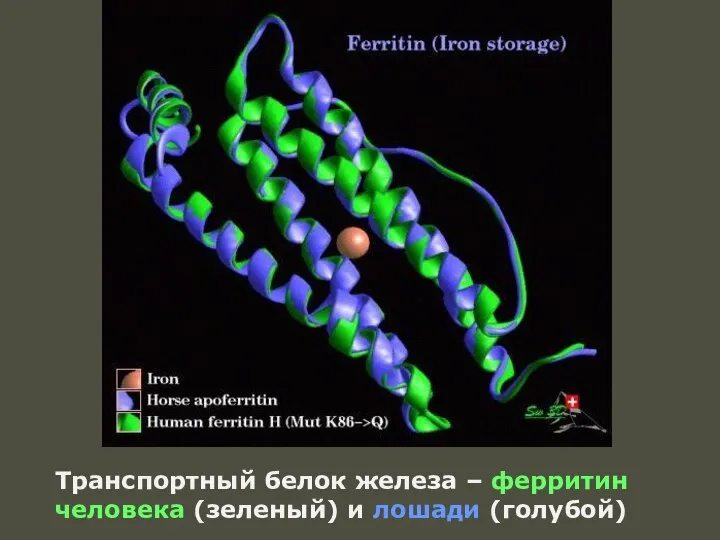
- 63. Транспортный белок железа – ферритин человека (зеленый) и лошади (голубой)
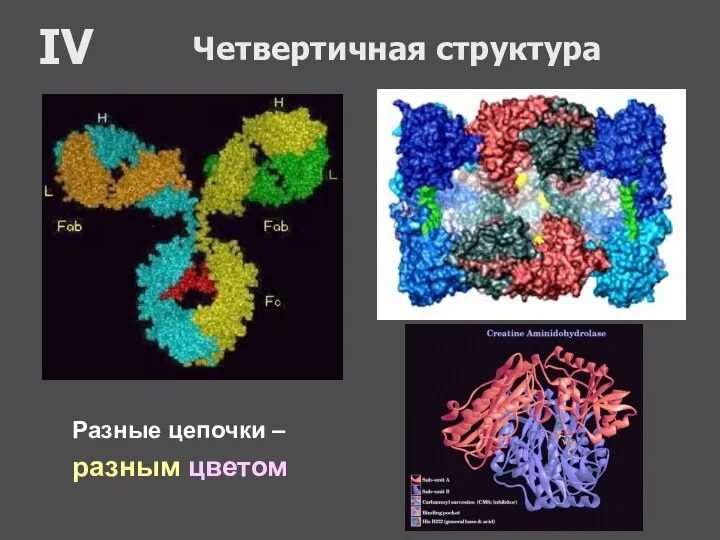
- 64. Четвертичная структура Объединение двух и более (до 20) полипептидных цепочек в один белок. Одна цепочка =
- 65. Четвертичная структура IV Разные цепочки – разным цветом
- 66. Домашнее задание Уметь нарисовать аминокислоту и пептидную связь. Знать, что такое I, II, III и IV
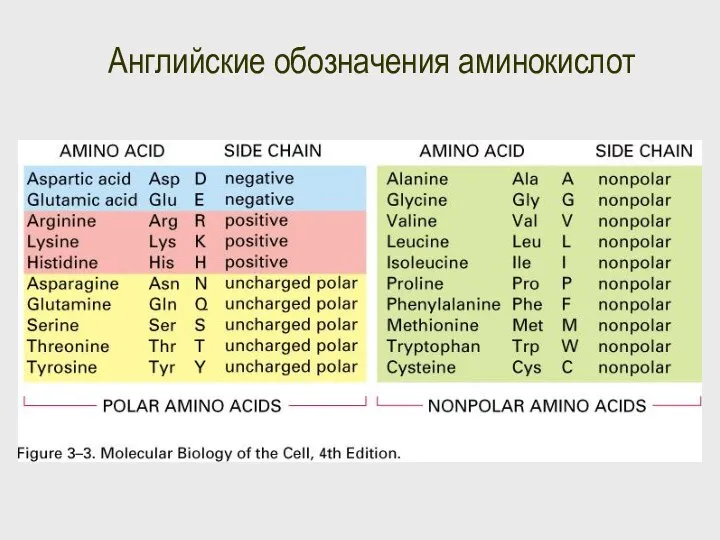
- 67. Английские обозначения аминокислот
- 69. Скачать презентацию

















 Жизненные формы растений
Жизненные формы растений Ткани
Ткани Лесная аптека
Лесная аптека Биомеханическая характеристика ходьбы и бега
Биомеханическая характеристика ходьбы и бега Презентация на тему Летучая мышь
Презентация на тему Летучая мышь  Презентация на тему Животные и растения в мировом океане
Презентация на тему Животные и растения в мировом океане  Cats by Mark Stafford
Cats by Mark Stafford Геохронологическая история Земли. Часть 1
Геохронологическая история Земли. Часть 1 Птицы
Птицы Внешнее строение моллюсков
Внешнее строение моллюсков Презентация на тему Опора и движение
Презентация на тему Опора и движение  Презентация на тему ВКЛАД ОТЕЧЕСТВЕННЫХ УЧЕНЫХ В РАЗРАБОТКУ УЧЕНИЯ О ВЫСШЕЙ НЕРВНОЙ ДЕЯТЕЛЬНОСТИ
Презентация на тему ВКЛАД ОТЕЧЕСТВЕННЫХ УЧЕНЫХ В РАЗРАБОТКУ УЧЕНИЯ О ВЫСШЕЙ НЕРВНОЙ ДЕЯТЕЛЬНОСТИ  Динамика численности рыжего соснового пилильщика
Динамика численности рыжего соснового пилильщика Оптические приборы, устройства и правила работы с ними
Оптические приборы, устройства и правила работы с ними Митоз
Митоз Олени Эвенки
Олени Эвенки Моллюски (мягкотелые)
Моллюски (мягкотелые) Биологически активные вещества витамины
Биологически активные вещества витамины Распознавание наиболее распространённых растений
Распознавание наиболее распространённых растений Презентация на тему ИНТЕРАКТИВНОЕ ПОСОБИЕ ПО АНАТОМИИ ЧЕЛОВЕКА
Презентация на тему ИНТЕРАКТИВНОЕ ПОСОБИЕ ПО АНАТОМИИ ЧЕЛОВЕКА  Растения у моего дома
Растения у моего дома Рост и развитие растений
Рост и развитие растений Происхождение жизни на Земле
Происхождение жизни на Земле Презентация на тему ВВЕДЕНИЕ. ЧТО ИЗУЧАЕТ НАУКА БИОЛОГИЯ
Презентация на тему ВВЕДЕНИЕ. ЧТО ИЗУЧАЕТ НАУКА БИОЛОГИЯ  вегетативная н.с
вегетативная н.с Фолдинг (складывание) образование третичной структуры белка
Фолдинг (складывание) образование третичной структуры белка Органические вещества
Органические вещества Як виростити квітку
Як виростити квітку