Содержание
- 2. "Жизнь — это открытые саморегулирующиеся и самовоспроизводящиеся системы совокупностей живых организмов, построенные из сложных биологических полимеров
- 3. Белки— высокомолекулярные органические соединения – (ВМС), нерегулярные биополимеры, состоящие из мономеров- аминокислот, соединенных пептидной связью.
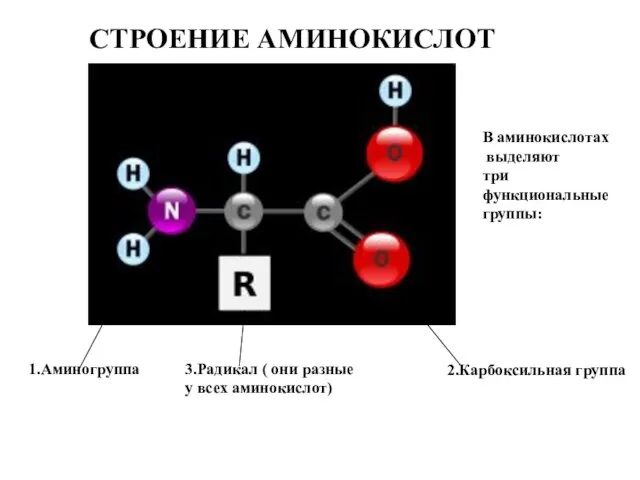
- 4. СТРОЕНИЕ АМИНОКИСЛОТ В аминокислотах выделяют три функциональные группы: 1.Аминогруппа 2.Карбоксильная группа 3.Радикал ( они разные у
- 5. Не могут быть синтезированы в организме. Поэтому их поступление в организм с пищей необходимо. Незаменимыми для
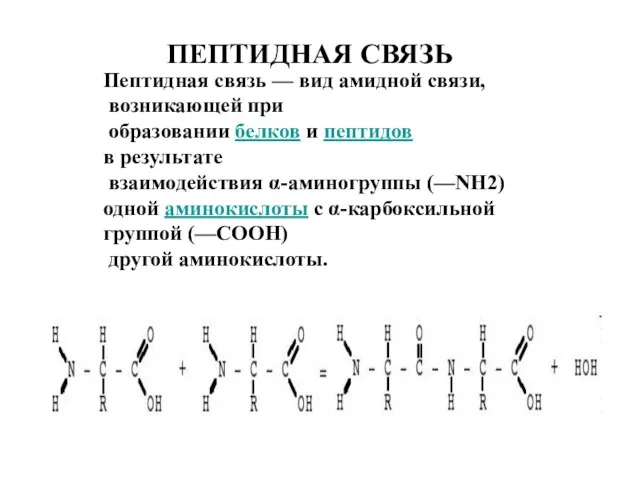
- 6. ПЕПТИДНАЯ СВЯЗЬ Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате
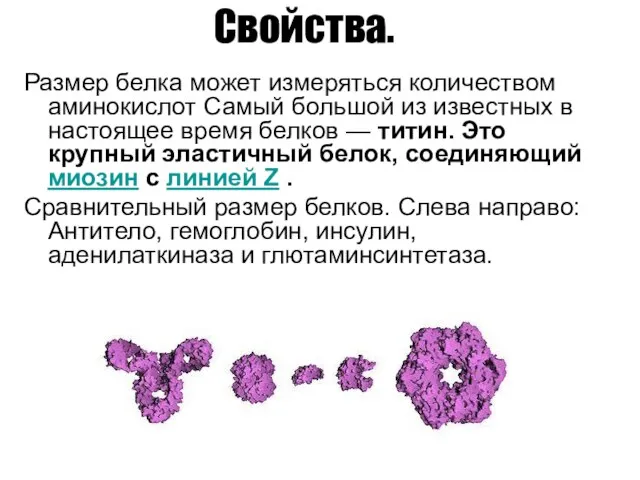
- 7. Свойства. Размер белка может измеряться количеством аминокислот Самый большой из известных в настоящее время белков —
- 8. Денатурация. Резкое изменение условий, например, нагревание или обработка белка кислотой или щёлочью приводит к потере четвертичной,
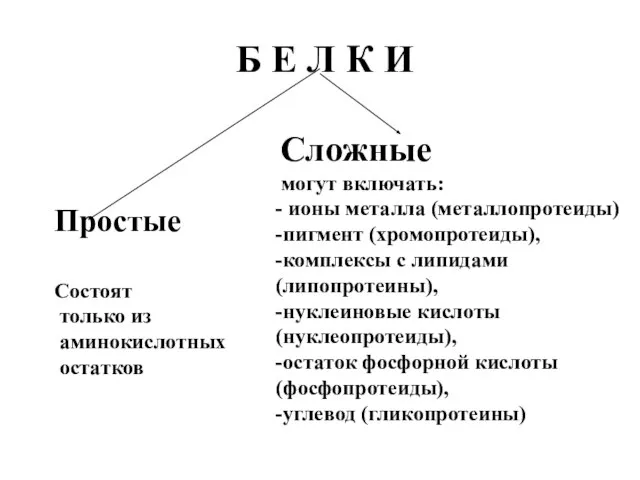
- 9. Б Е Л К И Простые Состоят только из аминокислотных остатков Сложные могут включать: - ионы
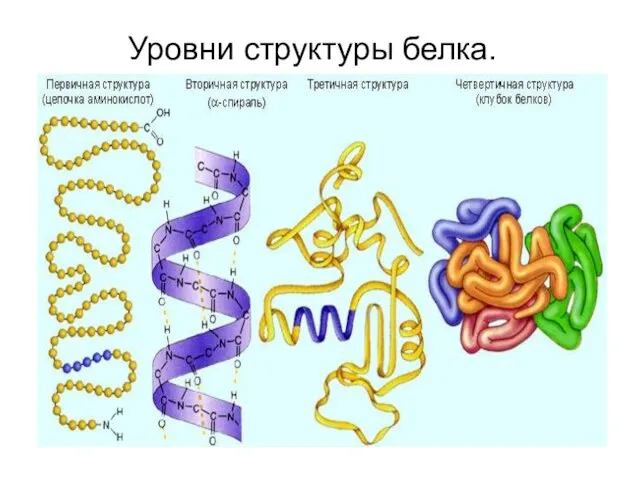
- 10. Уровни структуры белка.
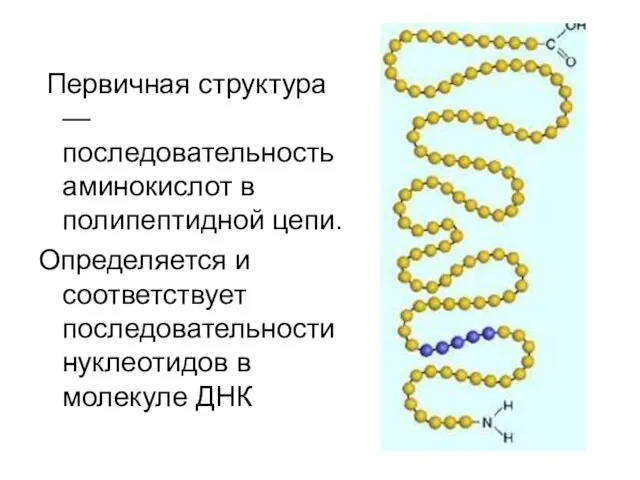
- 11. Первичная структура — последовательность аминокислот в полипептидной цепи. Определяется и соответствует последовательности нуклеотидов в молекуле ДНК
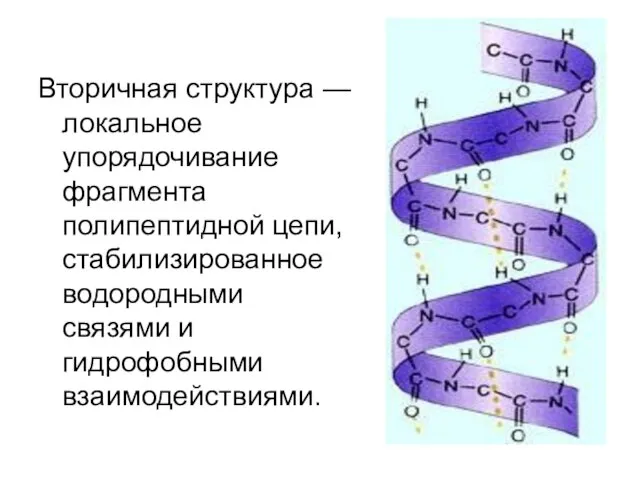
- 12. Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями.
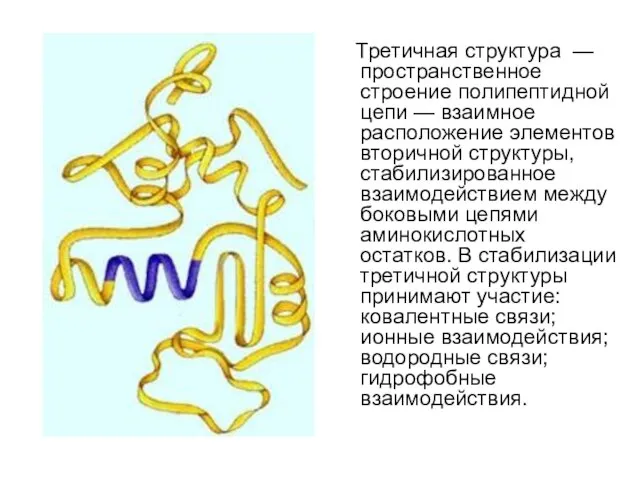
- 13. Третичная структура — пространственное строение полипептидной цепи — взаимное расположение элементов вторичной структуры, стабилизированное взаимодействием между
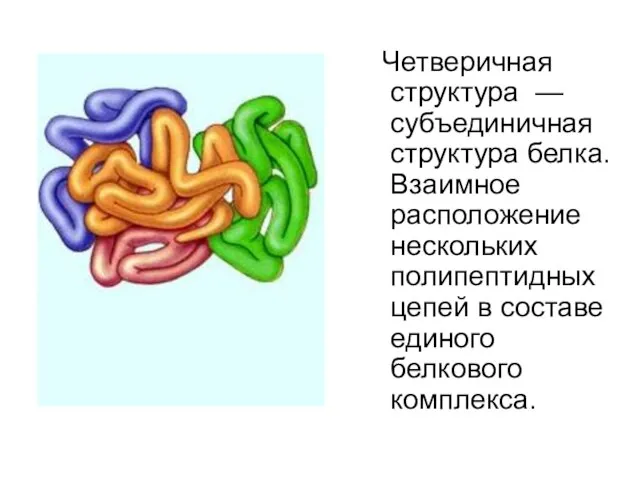
- 14. Четверичная структура — субъединичная структура белка. Взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса.
- 16. Скачать презентацию




 Презентация Растения
Презентация Растения Тип Кольчатые черви. Класс Малощетинковые
Тип Кольчатые черви. Класс Малощетинковые Питание человека
Питание человека Презентация на тему Отдел Голосеменные. Общая характеристика
Презентация на тему Отдел Голосеменные. Общая характеристика  Этилен. Действие этилена на рост проростков гороха
Этилен. Действие этилена на рост проростков гороха Стационарное состояние в биологических системах. Устойчивое и неустойчивое состояния
Стационарное состояние в биологических системах. Устойчивое и неустойчивое состояния Круги кровообращения
Круги кровообращения Презентация на тему Планета Зоологическая
Презентация на тему Планета Зоологическая  Компьютерная диагностика. Острый стеноз гортани
Компьютерная диагностика. Острый стеноз гортани Растение - живой организм
Растение - живой организм The kiwi is not only a fruit
The kiwi is not only a fruit ДНҚ РНҚ және хромосомадар. Олардың ағза үшін маңызы
ДНҚ РНҚ және хромосомадар. Олардың ағза үшін маңызы Хлорофилл. Синтез, химическая структура
Хлорофилл. Синтез, химическая структура Строение цветка. 7 класс
Строение цветка. 7 класс Гуморальная регуляция
Гуморальная регуляция Вестибулярный анализатор. Мышечное чувство. Осязание
Вестибулярный анализатор. Мышечное чувство. Осязание Тип членистоногие
Тип членистоногие Садовые цветы
Садовые цветы Microbial-host metabolism and the effect on behavioral function of brain
Microbial-host metabolism and the effect on behavioral function of brain Эффективность применения препарата Клиодезив для санации объектов ветеринарного надзора
Эффективность применения препарата Клиодезив для санации объектов ветеринарного надзора Кошачья двуустка
Кошачья двуустка Rosengarten der Grauen
Rosengarten der Grauen Комплексный биопрепарат для рекультивации почв от токсикантов техногенного и природного происхождения
Комплексный биопрепарат для рекультивации почв от токсикантов техногенного и природного происхождения Геннің құрлымы
Геннің құрлымы Анатомия и физиология человека. (Лекция 3)
Анатомия и физиология человека. (Лекция 3) Презентация 2.2. Ранние этапы антропогенеза
Презентация 2.2. Ранние этапы антропогенеза Критерии вида
Критерии вида Биоинженерия. Дезоксирибонуклеиновая кислота
Биоинженерия. Дезоксирибонуклеиновая кислота