Содержание
- 2. Лекция 13 Обмен холестерина Нарушения обмена холестерина (биохимические основы атеросклероза, желчнокаменной болезни, нарушения обмена липидов при
- 3. Актуальность темы Холестерин – основной стероид организма человека, выполняющий ряд важных функций Нарушения обмена холестерина играют
- 4. План лекции Холестерин: структура, биологическая роль (повторение курса химии) Ассимиляция пищевого холестерина Синтез эндогенного холестерина Регуляция
- 5. Цель лекции Знать: химико-биологическую сущность процессов обмена холестерина в организме человека Использовать полученные знания для понимания
- 6. ОБМЕН ХОЛЕСТЕРИНА Структура, роль холестерина Ассимиляция пищевого холестерина Синтез эндогенного холестерина Транспорт холестерина в ткани Образование
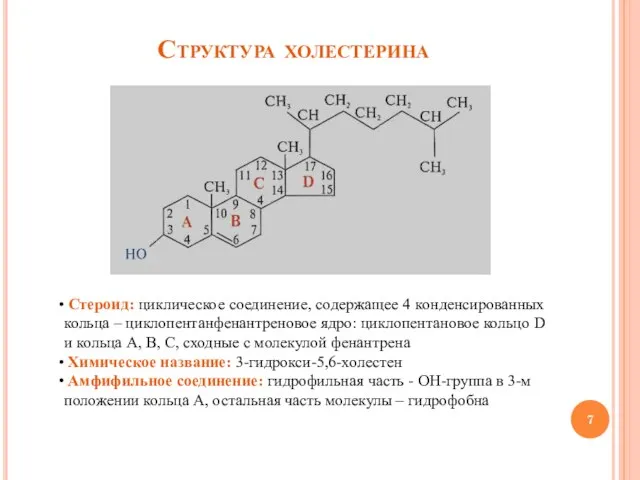
- 7. Структура холестерина Стероид: циклическое соединение, содержащее 4 конденсированных кольца – циклопентанфенантреновое ядро: циклопентановое кольцо D и
- 8. Фонд холестерина в организме человека В мембранах клеток – свободный холестерол В липидных каплях цитоплазмы –
- 9. Биологическая роль холестерина Холестерин – компонент мембран клеток способствует упорядоченности, устойчивости, компактности липидного бислоя за счет
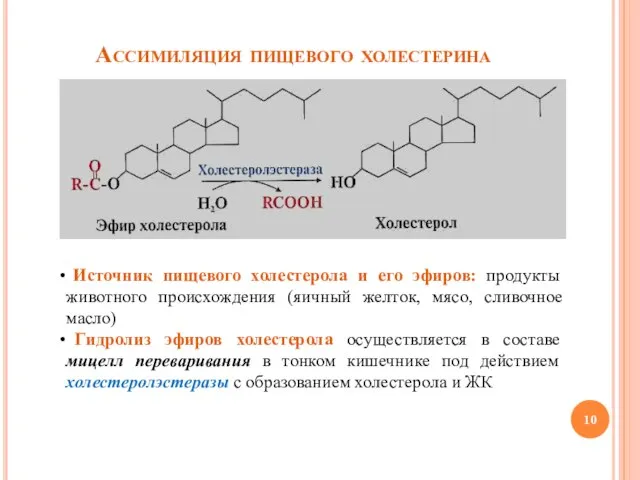
- 10. Ассимиляция пищевого холестерина Источник пищевого холестерола и его эфиров: продукты животного происхождения (яичный желток, мясо, сливочное
- 11. Ассимиляция пищевого холестерина (продолжение) Всасывание холестерола в энтероциты происходит в составе смешанных мицелл Ресинтез эфиров холестерола
- 12. Синтез холестерина Основное место синтеза: печень (~50%), кишечник (~15%), кожа, кора надпочечников, репродуктивные органы. Все клетки,
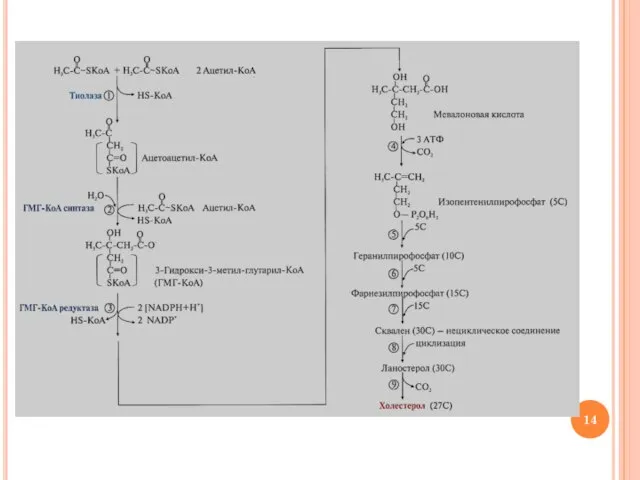
- 13. Этапы синтеза холестерина Образование мевалоновой кислоты (6С) Фосфорилирование и декарбоксилирование мевалоната с образованием изопентенилпирофосфата – активированной
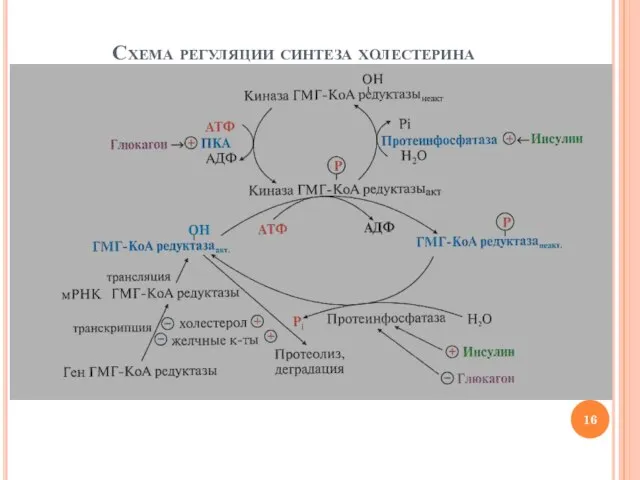
- 15. Регуляция синтеза холестерина Механизмы регуляция активности ГМГ-КоА-редуктазы Регуляция на уровне транскрипции: холестерол и желчные кислоты подавляют
- 16. Схема регуляции синтеза холестерина
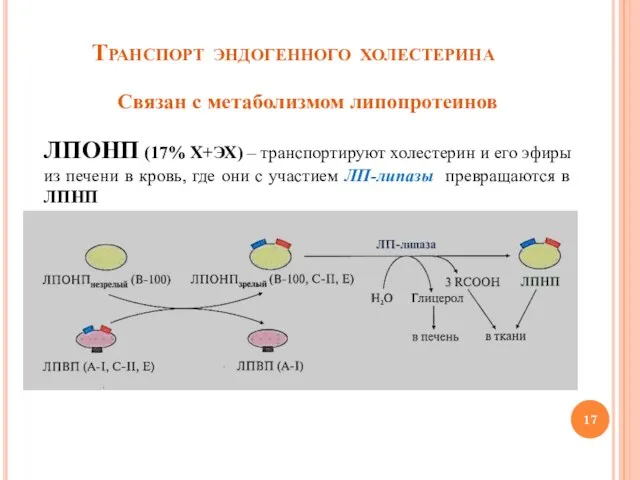
- 17. Транспорт эндогенного холестерина Связан с метаболизмом липопротеинов ЛПОНП (17% Х+ЭХ) – транспортируют холестерин и его эфиры
- 18. Метаболизм ЛПНП ЛПНП (50% Х+ЭХ) образуются главным образом в кровотоке из ЛПОНП и переносят холестерин из
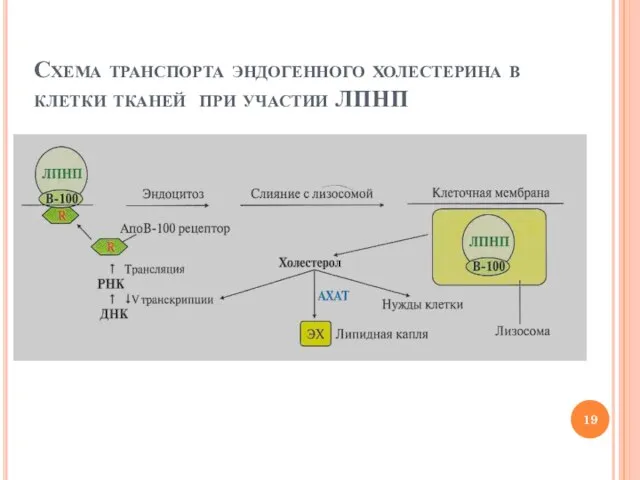
- 19. Схема транспорта эндогенного холестерина в клетки тканей при участии ЛПНП
- 20. ЛПНП – АТЕРОГЕННЫЙ ФАКТОР Концентрация ЛПНП в крови прямо пропорциональна вероятности возникновения атеросклероза Ограниченный захват ЛПНП
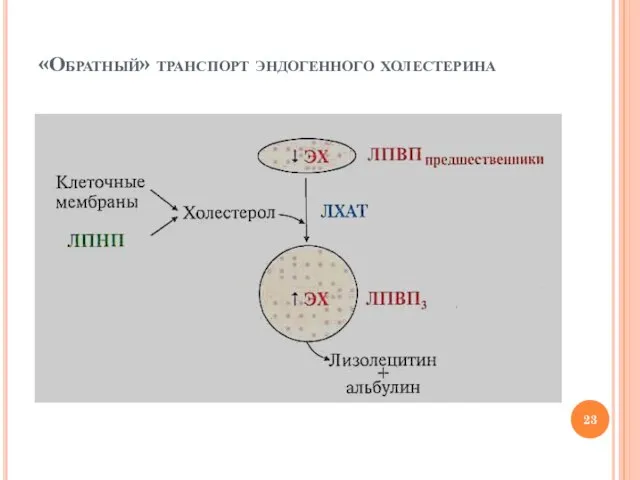
- 21. «Обратный» транспорт эндогенного холестерина в печень ЛПВП (20% Х+ЭХ) принимают холестерин с поверхности ЛПНП и мембран
- 22. Роль фермента ЛХАТ в транспорте холестерина ЛХАТ – лецитин: холестрол ацилтрансфераза Лецитин + холестерол → ЭХ
- 23. «Обратный» транспорт эндогенного холестерина
- 24. «Обратный» транспорт эндогенного холестерина В процессе «передачи» холестерина из ЛПВП в печень участвуют: специфические рецепторы ЛПВП
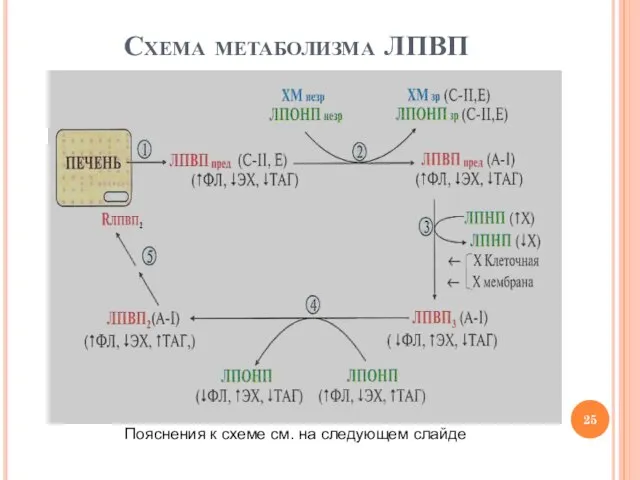
- 25. Схема метаболизма ЛПВП Пояснения к схеме см. на следующем слайде
- 26. Метаболизм ЛПВП 1. Образование предшественников ЛПВП (насцентных частиц в форме «шайбы») в печени 2. Обмен белками
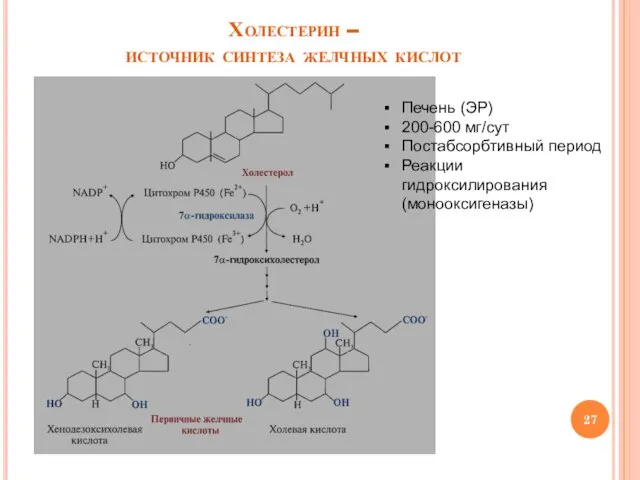
- 27. Холестерин – источник синтеза желчных кислот Печень (ЭР) 200-600 мг/сут Постабсорбтивный период Реакции гидроксилирования (монооксигеназы)
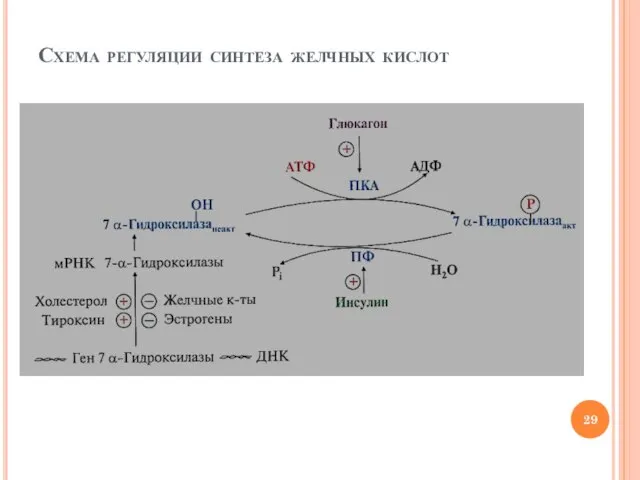
- 28. Регуляция синтеза желчных кислот Механизмы регуляция активности 7α-гидроксилазы Регуляция на уровне транскрипции гена Активаторы: холестерол, тироксин
- 29. Схема регуляции синтеза желчных кислот
- 30. НАРУШЕНИЯ ОБМЕНА ХОЛЕСТЕРИНА Желчнокаменная болезнь Атеросклероз Нарушения обмена липидов при сахарном диабете
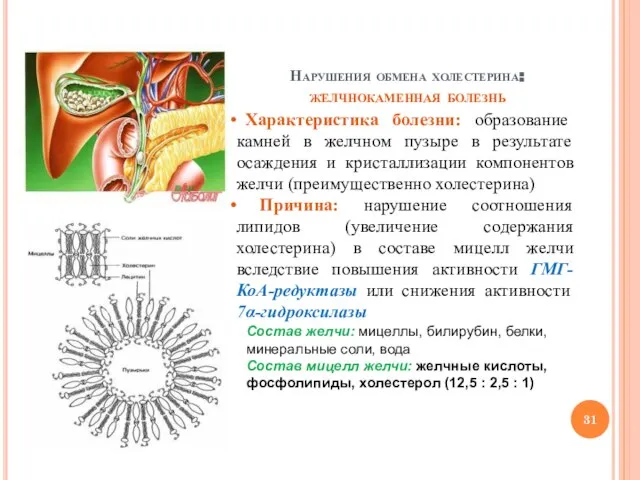
- 31. Нарушения обмена холестерина: желчнокаменная болезнь Характеристика болезни: образование камней в желчном пузыре в результате осаждения и
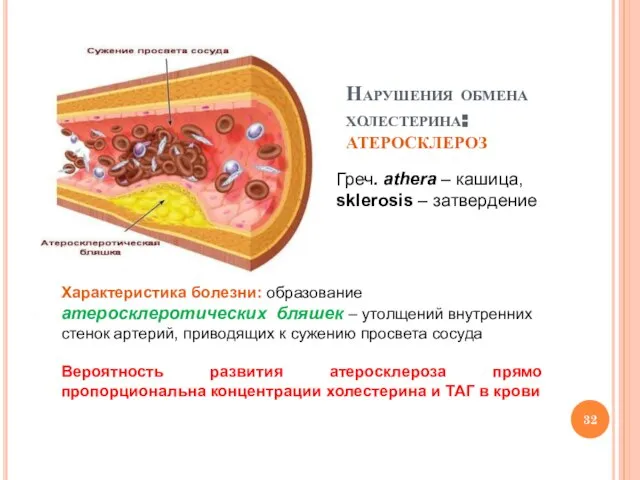
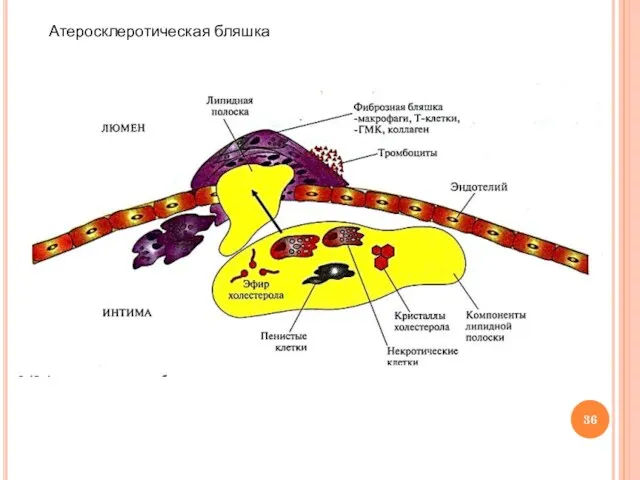
- 32. Нарушения обмена холестерина: атеросклероз Греч. аthera – кашица, sklerosis – затвердение Характеристика болезни: образование атеросклеротических бляшек
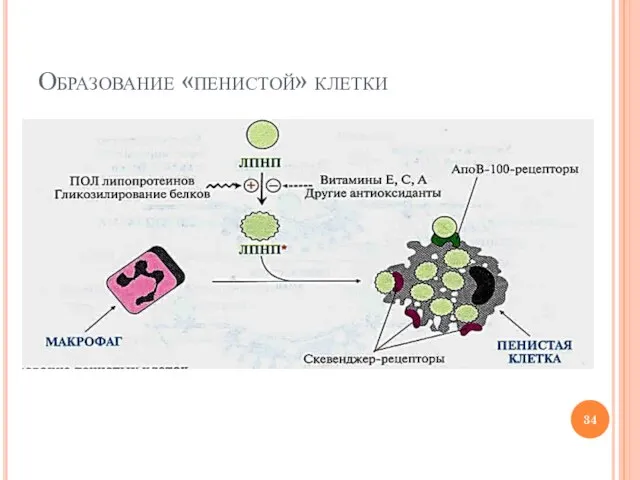
- 33. Механизм развития атеросклеротической бляшки Гиперхолестеролемия (↑ЛПНП) Повышение времени жизни ЛПНП (до 4-6 сут) Химическая модификация ЛПНП
- 34. Образование «пенистой» клетки
- 35. Механизм развития атеросклеротической бляшки (продолжение) Повреждение эндотелия, развитие воспалительной реакции Тромбообразование: секреция тромбоксанов → ↑агрегации тромбоцитов,
- 36. Атеросклеротическая бляшка
- 37. Для оценки риска развития у пациента атеросклероза и выбора лечения врачу необходимо знать не только концентрацию
- 38. Биохимические подходы в профилактике и лечении атеросклероза Снижение уровня холестерина в крови: Снижение калорийности питания: низкое
- 39. Механизм антиатерогенного действия ЛПВП ЛПВП осуществляют «обратный» транспорт холестерина в печень ЛПВП ингибируют экспрессию факторов адгезии
- 40. Изменения обмена липидов при сахарном диабете (СД) При СД возникает кетонемия вторичная гиперлипопротеинемия (повышается уровень ЛПОНП
- 41. Изменения обмена липидов при сахарном диабете (продолжение) Причины повышения уровня ЛПОНП: Активация липолиза глюкагоном, поступление в
- 42. Изменения обмена липидов при сахарном диабете (продолжение) Причины повышения уровня ЛПНП: Повышение уровня ЛПОНП Неферментативное гликозилирование
- 43. Атерогенные сдвиги в обмене ЛП при сахарном диабете Атерогенные сдвиги в обмене ЛП как правило более
- 44. Особенности обмена холестерина и фосфолипидов в детском возрасте До 10 лет содержание холестерина (ХС) у детей
- 45. Задание для самостоятельной работы (начало) Эффективным средством профилактики атеросклероза являются омега-3 жирные кислоты: α-линоленовая С18:3, тимнодоновая
- 46. Задание для самостоятельной работы (продолжение) Используя учебник, составьте конспект и изучите информацию по следующим вопросам: Механизм
- 47. Заключение Холестерин играет важную роль в организме человека, являясь структурным компонентом клеточных мембран и источником синтеза
- 49. Скачать презентацию
































 Плесневые грибы
Плесневые грибы Дыхательная система
Дыхательная система Муравьи. Виды муравьёв
Муравьи. Виды муравьёв Типы биохимических процессов, протекающих в экосистемах с участием микроорганизмов
Типы биохимических процессов, протекающих в экосистемах с участием микроорганизмов Птица стриж
Птица стриж Мейоз. Интерфазы
Мейоз. Интерфазы Osennii_774_e_776_zhik
Osennii_774_e_776_zhik Воздействие внешних факторов на рост микроорганизмов, физиологическая активность и экономический коэффициент
Воздействие внешних факторов на рост микроорганизмов, физиологическая активность и экономический коэффициент Царство грибы
Царство грибы Непрямой остеогенез
Непрямой остеогенез Зелёная морская черепах
Зелёная морская черепах Физические основы гемодинамики
Физические основы гемодинамики Вирусы
Вирусы Презентация на тему Общая характеристика опорно - двигательной системы
Презентация на тему Общая характеристика опорно - двигательной системы  Сравнение клеток разных систематических групп
Сравнение клеток разных систематических групп Почему люди любят динозавров
Почему люди любят динозавров Введение в нервную систему
Введение в нервную систему Бактерии
Бактерии Питание растений
Питание растений Биология, как наука
Биология, как наука Радула молюсків та її будова
Радула молюсків та її будова Особенности формирования растений огурца, томата, перца в теплицах. Агрофирма Поиск
Особенности формирования растений огурца, томата, перца в теплицах. Агрофирма Поиск Детёныши животных
Детёныши животных Земля и её обитатели
Земля и её обитатели Кормление аквариумных рыбок
Кормление аквариумных рыбок Генетические болезни и здоровье человека
Генетические болезни и здоровье человека Повторение
Повторение Строение и значение кожи. Терморегуляция. Кожные заболевания. Травмы кожи. Первая помощь при ожогах и обморожениях. Гигиена
Строение и значение кожи. Терморегуляция. Кожные заболевания. Травмы кожи. Первая помощь при ожогах и обморожениях. Гигиена