Поли- и гетерофункциональность, как причина появления специфических свойств у гидрокси-амино и кетокислот. (Лекция 11)
Содержание
- 2. ПЛАН 11.1.Стереоизомерия соединений с одним центром хиральности 11.2.Стереоизомерия соединений с двумя центрами хиральности 11.3.Стереоизомерия соединений с
- 3. 11.1. Стереоизомерия соединений с одним центром хиральности Атом углерода в sp3-гибридизации имеет тетраэдрическую конфигурацию. Если из
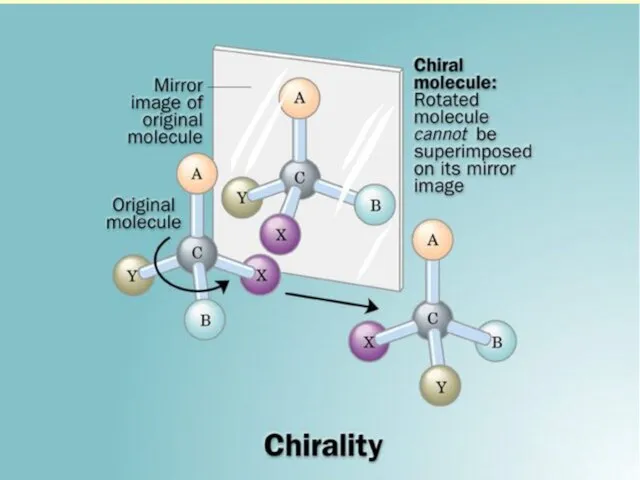
- 4. Это обстоятельство рождает новое явление хиральность - свойство молекулы соединения не совмещаться со своим зеркальным отображением
- 5. Хиральность присуща миру материальных объектов - руки, левые и правые спирали Существует 2 типа соединений –
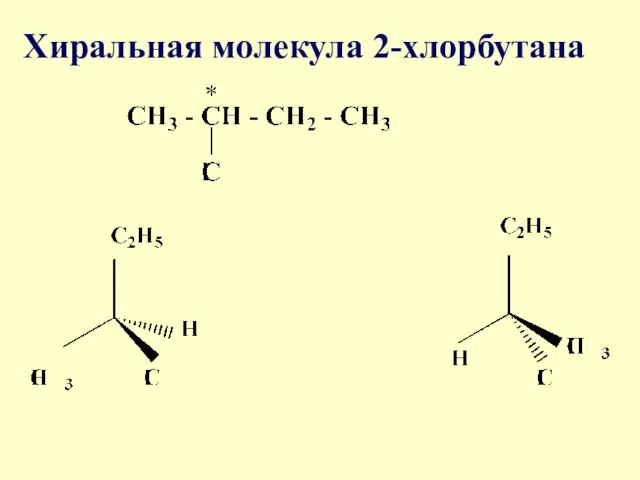
- 6. Хиральная молекула 2-хлорбутана
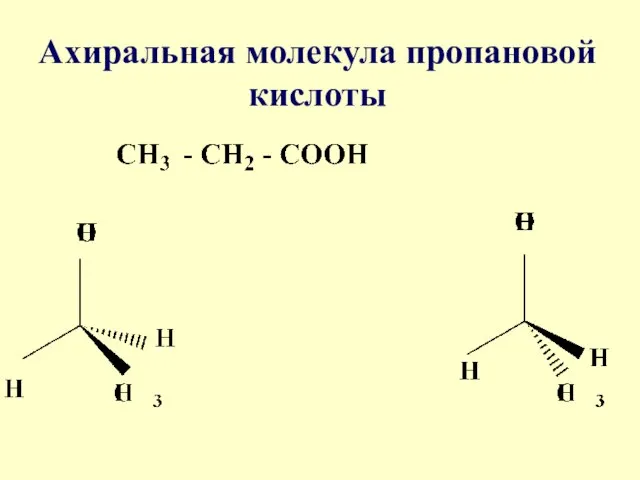
- 7. Ахиральная молекула пропановой кислоты
- 8. Термин хиральность (от древнегреческого «хир» - рука) ввел английский физик Кельвин в 1884 году для обозначения
- 11. Простейший случай возникновения хиральности - наличие асимметрического атома углерода - т.е. такого атома, который связан с
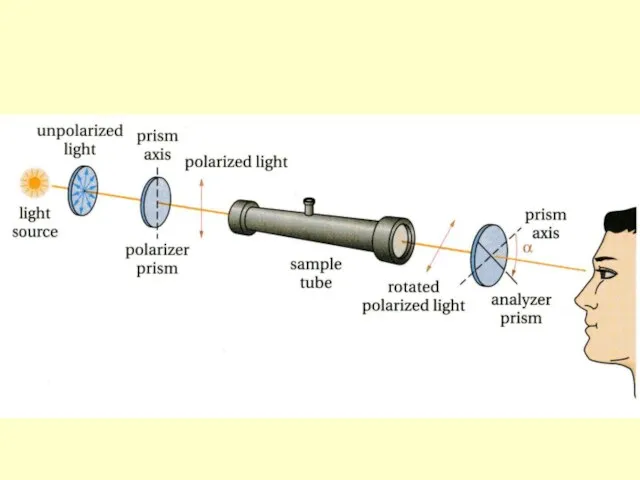
- 12. Характерное свойство хиральных соединений - способность вращать плоскость поляризации поляризованного света. Хиральные молекулы всегда оптически активны
- 14. Геометрическое свойство молекул - хиральность лежит в основе деления конфи-гурационных и конфор-мационных стереоизомеров на энантиомеры и
- 15. Энантиомеры или оптические антиподы - это два хиральных стереоизомера, которые являются зеркальным изображением друг друга Энантиомеры
- 16. Энантиомеры - оптические изомеры, оптические антиподы, имеют одинаковые физические и химические свойства: температуры кипения, плавления, растворимость,
- 17. Энантиомеры-различные соединения с характерными отличающимися свойствами
- 18. 1. Энантиомеры вращают плоскость поляризации поляризованного света на один и тот же угол вращения (α), но
- 19. Энантиомер, отклоняющий плоскость поляризации поляризованного света влево (против часовой стрелки) называют левовращающим, ему приписывают знак (-),
- 20. 2. Энантиомеры реагируют с другими хиральными соеди-нениями с различной скоростью, что имеет большое значение для биохимических
- 21. 3. При смешении равных количеств двух энантиомеров образуется оптически неактивная смесь (рацемат). Процесс превращения одного из
- 22. Стереоизомеры, не являющиеся зеркальным изображением один другого и имеющие различные физические и химические свойства называются диастереомеры
- 23. Диастереомеры делятся на две группы - σ- и π-диастереоизомеры. Стереоизомеры, у которых хиральный центр связан с
- 24. Стереоизомеры с одним центром хиральности Молекулы, имеющие центры хиральности на плоскости принято изображать в виде проекционных
- 25. Вверху располагают старшую характеристическую,наиболее окисленную группу, чаще всего карбоксильную или альдегидную. По горизонтали располагают неуглеродные заместители:
- 26. Абсолютную конфигурацию, отражающую истинное расположение заместителей в пространстве впервые определили в 1951 году с помощью рентгеноструктурного
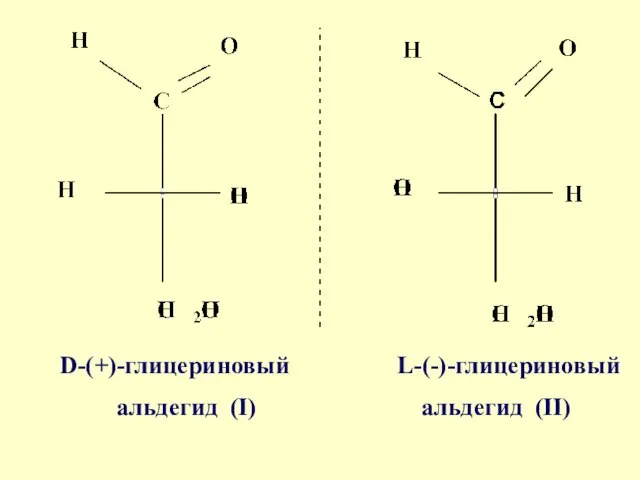
- 27. Относительную конфигурацию определяют путем сравнения с известным стандартом Конфигурационный стандарт - глицериновый альдегид
- 28. Условно, правовращающему глицериновому альдегиду была приписана конфигурация (I) и обозначена "D", а левовращающему энантиомеру - конфигурация
- 29. D-(+)-глицериновый L-(-)-глицериновый альдегид (I) альдегид (II)
- 30. В настоящее время действует R,S-номенклатура (R- ректус, правый; S-синистер, левый)
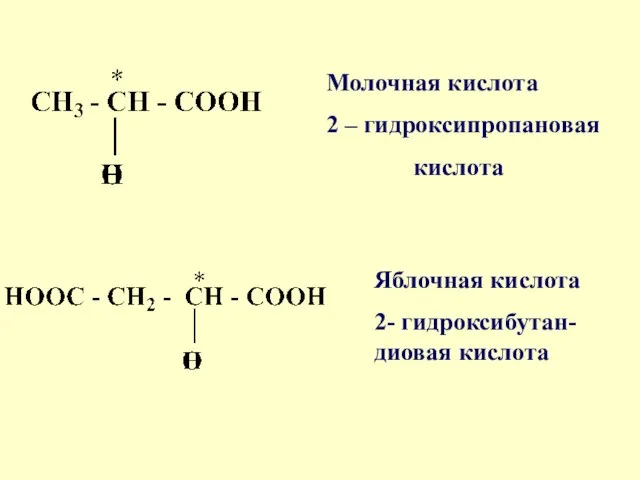
- 31. Соединениями с одним цент-ром хиральности являются некоторые гидроксикислоты, участвующие в биохимических процессах: молочная кислота (продукт метаболизма
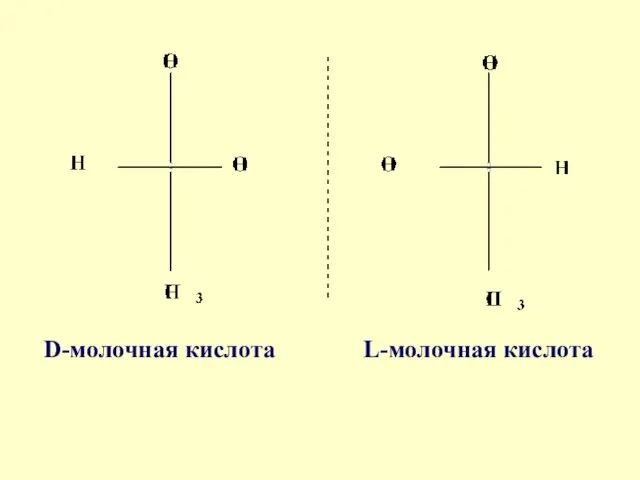
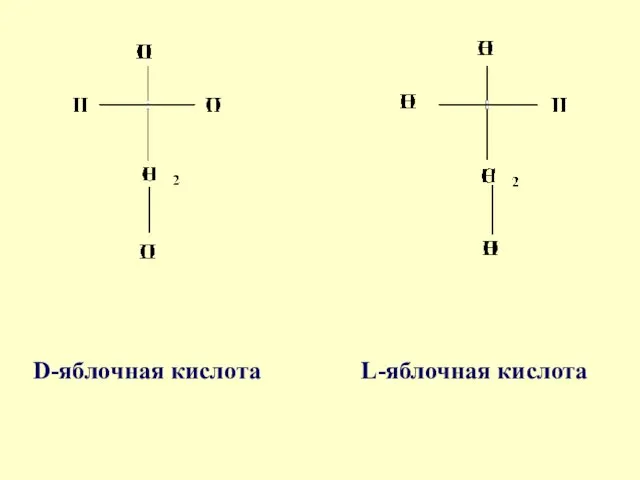
- 32. Молочная кислота 2 – гидроксипропановая кислота Яблочная кислота 2- гидроксибутан-диовая кислота
- 33. D-молочная кислота L-молочная кислота
- 34. D-яблочная кислота L-яблочная кислота
- 35. 11.2. Стереоизомерия соединений с двумя центрами хиральности Возрастание числа центров хиральности и приводит к появлению нового
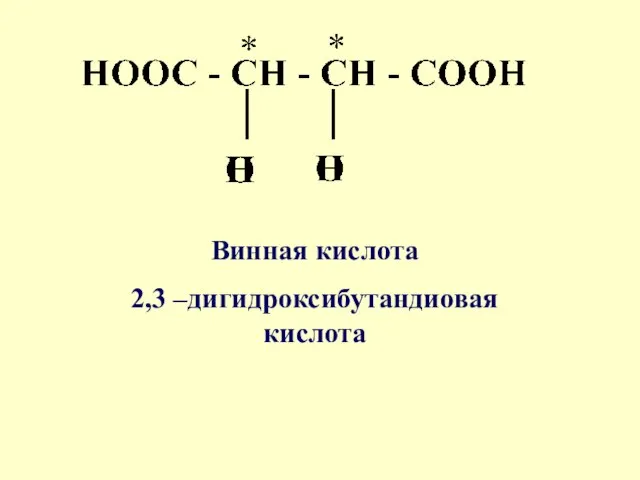
- 36. Винная кислота 2,3 –дигидроксибутандиовая кислота
- 37. Особый случай диастереомерии встречается в соединениях, у кото-рых центры хиральности содержат одинаковые заместители. Это при-водит к
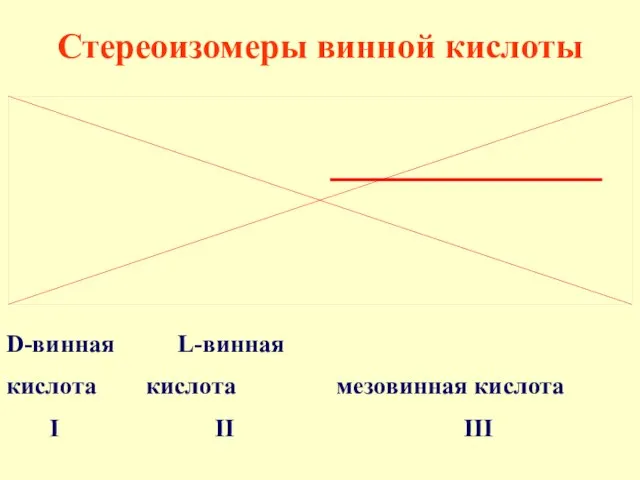
- 38. Стереоизомеры винной кислоты D-винная L-винная кислота кислота мезовинная кислота I II III
- 39. I и II - энантиомеры, I и III, II и III - диастереомеры. В молекуле мезовинной
- 40. К соединениям с двумя центрами хиральности относят также и некоторые аминокислоты, участвующие в биосинтезе белков. Примером
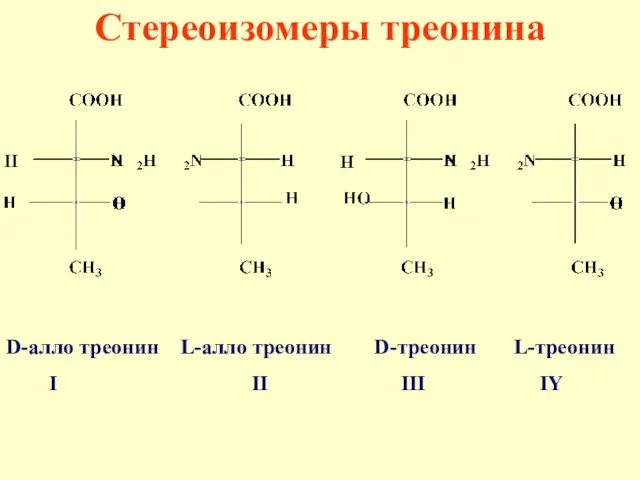
- 41. Стереоизомеры треонина D-алло треонин L-алло треонин D-треонин L-треонин I II III IY
- 42. Энантиомеры - I и II; III и IY Диастереомеры - I и III; I и IY;
- 43. 11.3. Стереоизомерия соединений с двойной связью (π-диастереоизомерия) π-Диастереомеры относятся к конфигурационным стереоизомерам. Этот вид изомерии наблюдается
- 44. Молекулы π-диастереомеров - ахиральны, поэтому для них не может быть энантиомеров. π-диастереомеры также обозначают как цис-
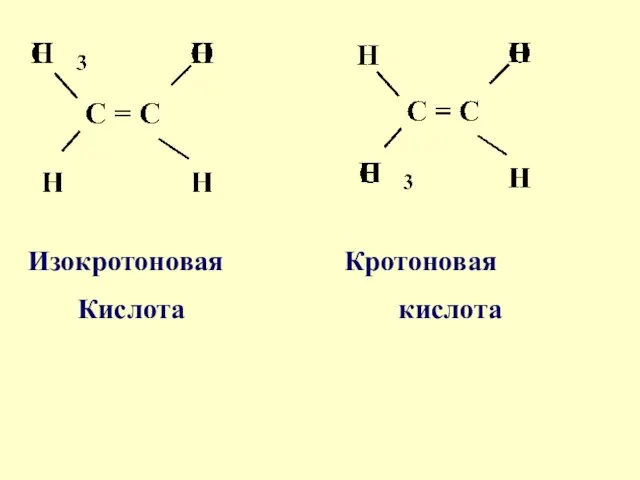
- 45. Изокротоновая Кротоновая Кислота кислота
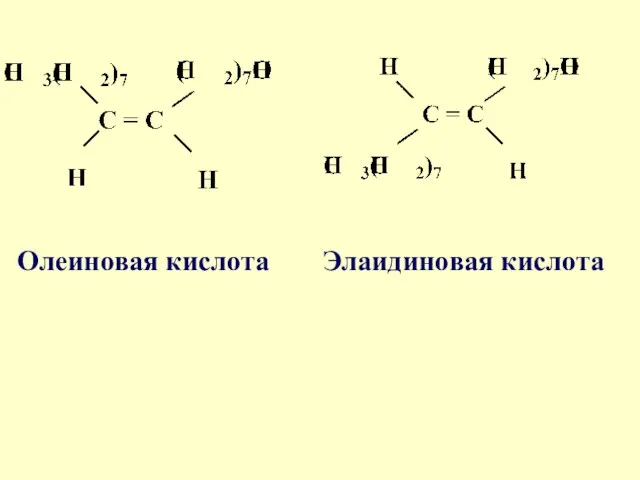
- 46. Олеиновая кислота Элаидиновая кислота
- 47. Пространственное строение органических молекул тесно связано с проявлением ими биологической активности или возможностью участия в биологических
- 48. Следствием стереоселективности взаимодействия живого с оптическими изомерами является, в частности, различие в терапевтической активности энантиомеров оптически
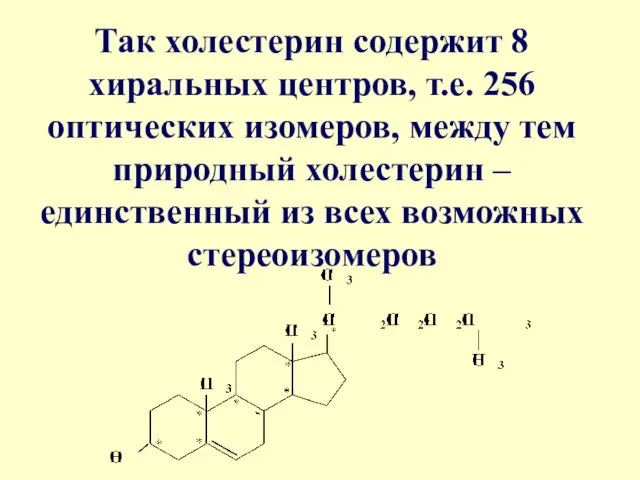
- 49. Так холестерин содержит 8 хиральных центров, т.е. 256 оптических изомеров, между тем природный холестерин – единственный
- 50. Из двух энантиомеров более физиологически активный - называют эвтомер, второй (менее или физиологически неактивный) - дистомер
- 51. В настоящее время приблизительно 40 процентов лекарственных веществ являются хиральными и только ничтожная часть этих соединений
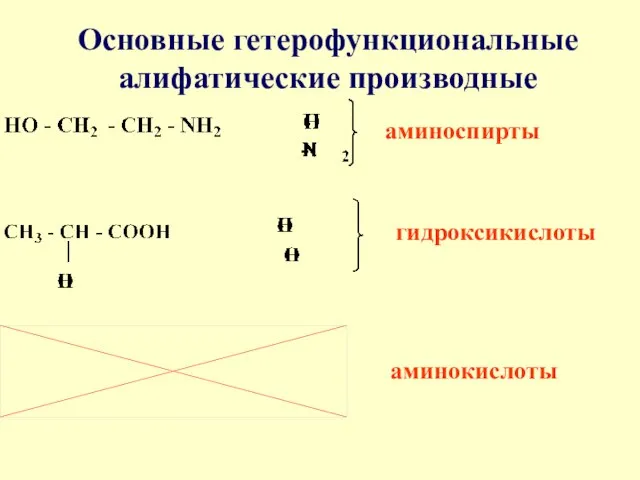
- 52. 11.4. Реакционная способность гетерофункциональных соединений К гетерофункциональным произ-водным, участвующим в процессах жизнедеятельности относят - аминоспирты, гидрокси-
- 53. Основные гетерофункциональные алифатические производные аминоспирты гидроксикислоты аминокислоты
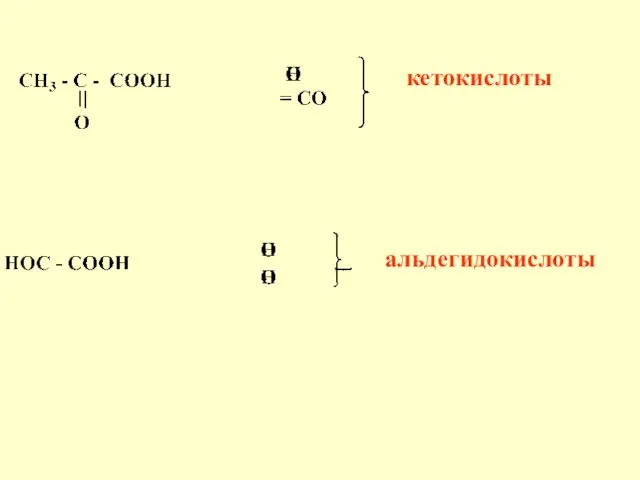
- 54. кетокислоты альдегидокислоты
- 55. Химические свойства этих соеди-нений определяются свойствами соответствующих монофункцио-нальных производных, однако наличие нескольких функцио-нальных групп ведет к
- 56. Каждая гетерофункциональная группа сохраняет свойственную ей реакционоспособность, но происходит и взаимное усиление реакционной способности. В зависимости
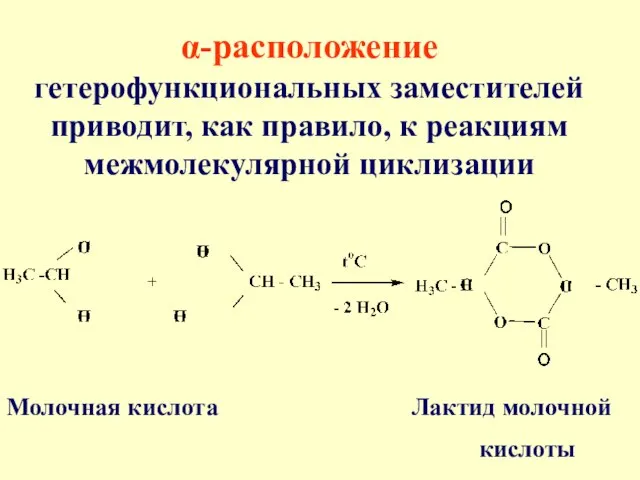
- 57. α-расположение гетерофункциональных заместителей приводит, как правило, к реакциям межмолекулярной циклизации Молочная кислота Лактид молочной кислоты
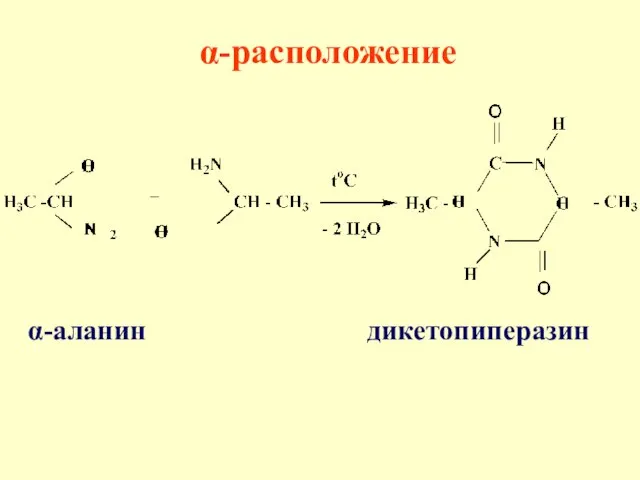
- 58. α-аланин дикетопиперазин α-расположение
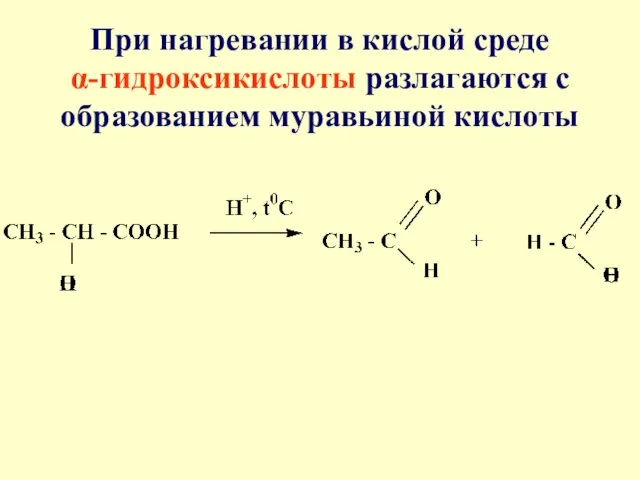
- 59. При нагревании в кислой среде α-гидроксикислоты разлагаются с образованием муравьиной кислоты
- 60. β-расположение предопределяет между гетерофункциональными группами достаточно сильный СН- кислотный центр благодаря влиянию ЭА групп с двух
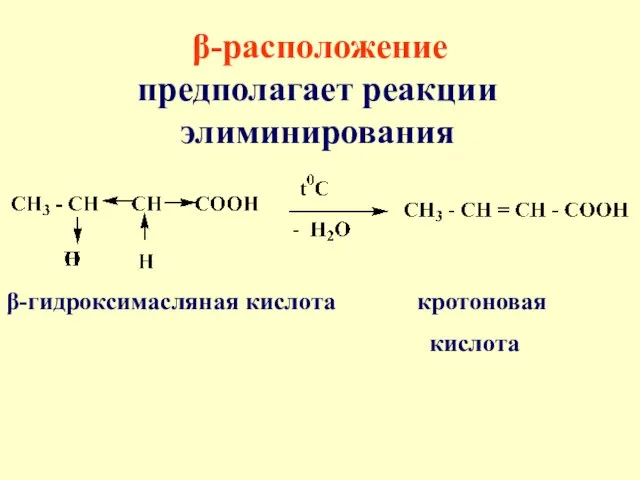
- 61. β-расположение предполагает реакции элиминирования β-гидроксимасляная кислота кротоновая кислота
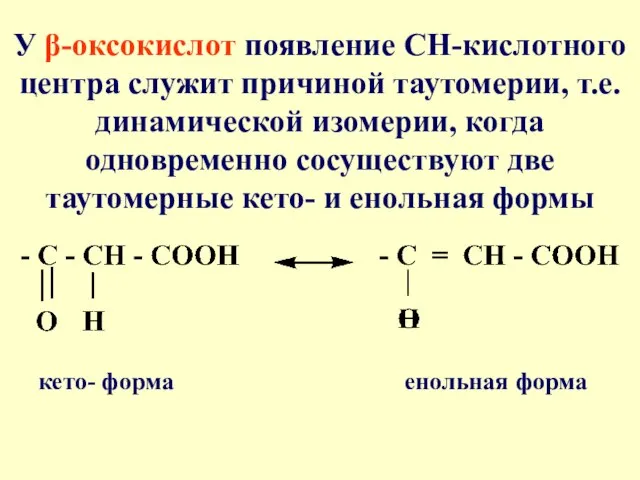
- 62. У β-оксокислот появление СН-кислотного центра служит причиной таутомерии, т.е. динамической изомерии, когда одновременно сосуществуют две таутомерные
- 63. Кето-енольная таутомерия характерна для β-оксокислот. Наиболее удобно рассмотреть кето-енольную таутомерию на примере ацетоуксусного эфира Кето-форма (92,5%)
- 64. Ацетоуксусный эфир используется для синтеза кетонов, карбоновых кислот, гетерофункциональных соединений, ЛС, причем при действии на него
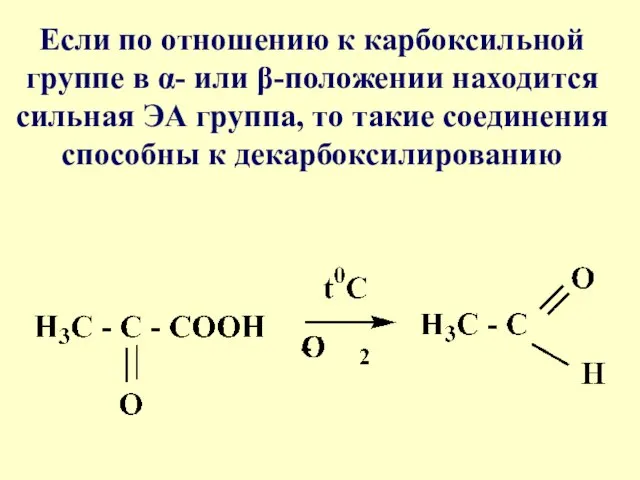
- 65. Если по отношению к карбоксильной группе в α- или β-положении находится сильная ЭА группа, то такие
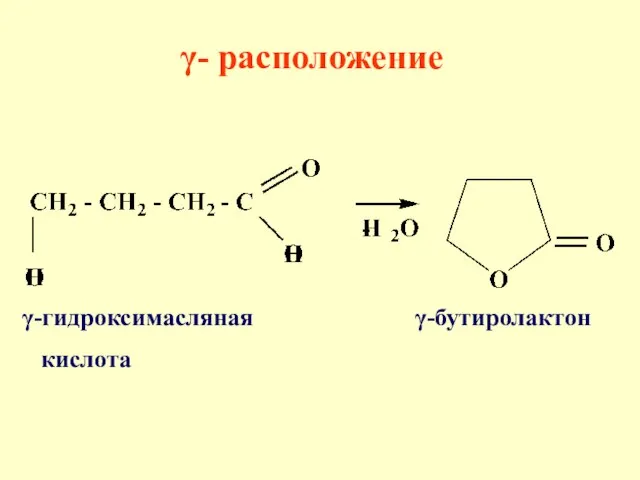
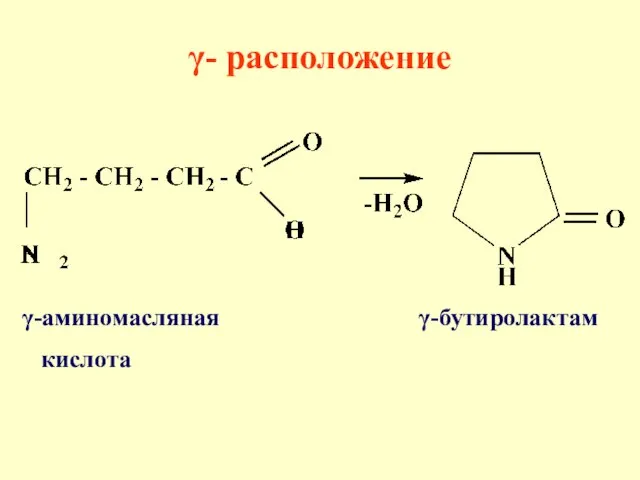
- 66. γ- расположение способствует реакциям внутри-молекулярной циклизации, в результате образуются цикли-ческие сложные эфиры или ами-ды. Определяющим фактором
- 67. γ-гидроксимасляная γ-бутиролактон кислота γ- расположение
- 68. γ-аминомасляная γ-бутиролактам кислота γ- расположение
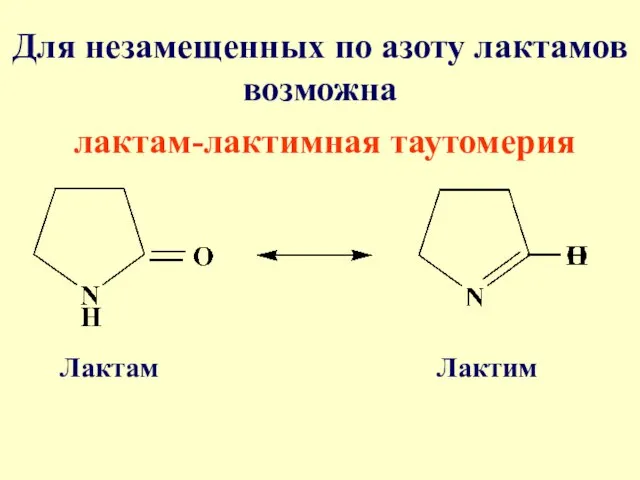
- 69. Для незамещенных по азоту лактамов возможна лактам-лактимная таутомерия Лактам Лактим
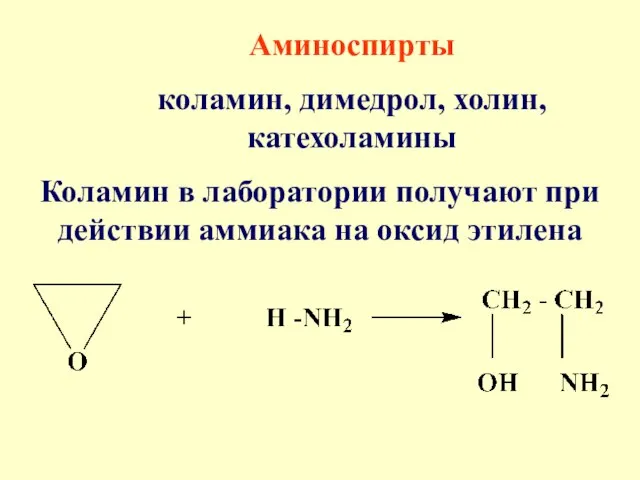
- 70. Аминоспирты коламин, димедрол, холин, катехоламины Коламин в лаборатории получают при действии аммиака на оксид этилена
- 71. Коламин - густая жидкость с характерным запахом аминов Коламин обладает выраженными основными свойствами НО-СН2-CH2-NH2 + HCl
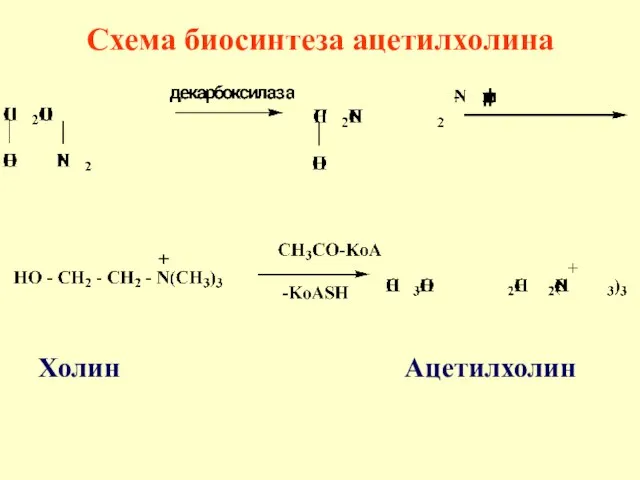
- 72. Холин - [HO – CH2 – CH2 – N(CH3)3]+OH- - гидроксид триметил-2-гидроксиэтиламмония входит в состав сложных
- 73. Холин Ацетилхолин Схема биосинтеза ацетилхолина
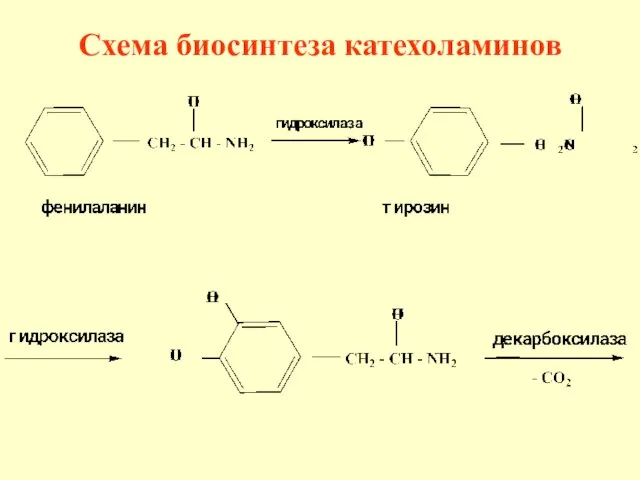
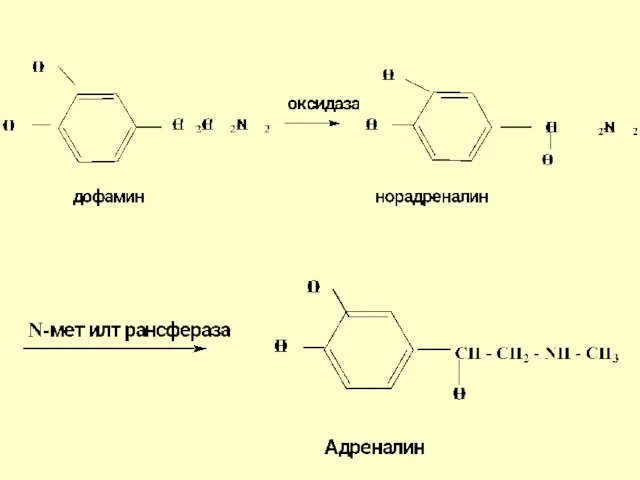
- 74. Катехоламины дофамин, норадреналин и адреналин, являются биогенными аминами, которые образуются в организме из незаменимой аминокислоты фенилаланина
- 75. Схема биосинтеза катехоламинов
- 77. Адреналин (метиламиноэтанолпирокатехин) образуется в надпочечниках, является гормоном, обладающим способностью сужать кровеносные сосуды, применяется в качестве кровоостанавливающего
- 78. Некоторым людям необходим дополнительный адреналин
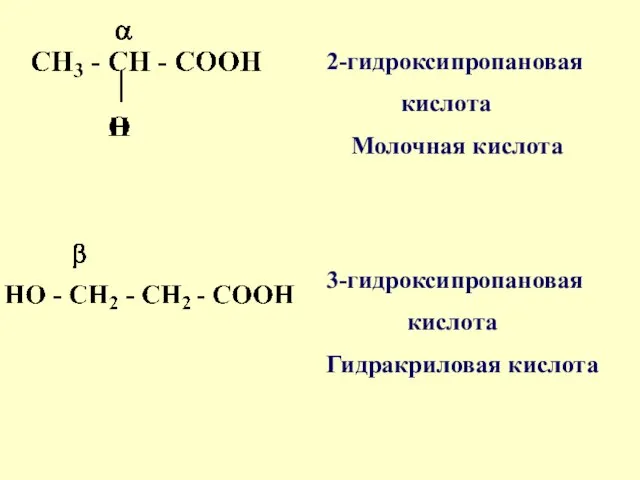
- 79. Гидроксикислоты содержат -ОН с -СООН группы Различают α-,β-, и γ-гидроксикислоты НОСН2СООН 2-гидроксиэтановая кислота , гликолевая кислота
- 80. 2-гидроксипропановая кислота Молочная кислота 3-гидроксипропановая кислота Гидракриловая кислота
- 81. 3-гидроксибутановая кислота β- оксимасляная кислота 4-гидроксибутановая кислота γ–оксимасляная кислота (ГОМК)
- 82. Гидроксикислоты проявляют общие свойства кислот и спиртов, кроме этого для них характерны специфические свойства, связанные с
- 83. Кетоновые (ацетоновые) тела продукты окисления высших жирных кислот, накапливаются в организме у больных сахарным диабетом β-гидроксимасляная
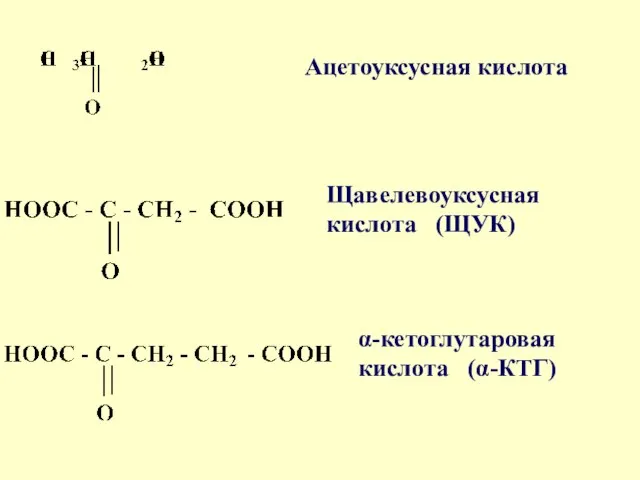
- 84. Оксокислоты Различают альдегидо- и кетокислоты Глиоксиловая кислота Пировиноградная кислота (ПВК)
- 85. Ацетоуксусная кислота Щавелевоуксусная кислота (ЩУК) α-кетоглутаровая кислота (α-КТГ)
- 86. Благодарим за внимание !
- 88. Скачать презентацию












































![Холин - [HO – CH2 – CH2 – N(CH3)3]+OH- - гидроксид триметил-2-гидроксиэтиламмония](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/844046/slide-71.jpg)









 Анатомические и функциональные цепи
Анатомические и функциональные цепи Потомок больших голубых котов – вислоухий британец Луксор
Потомок больших голубых котов – вислоухий британец Луксор Особенности растительного мира Камчатки
Особенности растительного мира Камчатки Общая биология. Тесты про химсостав
Общая биология. Тесты про химсостав Селекция пшеницы, ржи и кукурузы
Селекция пшеницы, ржи и кукурузы Из гусеницы в бабочку. 3 класс
Из гусеницы в бабочку. 3 класс Животный мир Австралии
Животный мир Австралии Общая анатомия и развитие конечного мозга. Плащ, корковые концы анализаторов
Общая анатомия и развитие конечного мозга. Плащ, корковые концы анализаторов Крахмал и его свойства
Крахмал и его свойства Семейство ластоногих. Морж
Семейство ластоногих. Морж Нервная система. Классификация
Нервная система. Классификация Тип кольчатые черви. Классы: малощетинковые, пиявки
Тип кольчатые черви. Классы: малощетинковые, пиявки Обобщение по теме Дыхательная система человека
Обобщение по теме Дыхательная система человека 2
2 Голосеменные растения
Голосеменные растения Тропики. Клуб Подружка
Тропики. Клуб Подружка Положение человека в системе органического мира
Положение человека в системе органического мира Биологические аспекты адаптации населения к условиям жизнедеятельности
Биологические аспекты адаптации населения к условиям жизнедеятельности Эволюция китов
Эволюция китов О растениях и организмов в почве .
О растениях и организмов в почве . Дикие предки коровы
Дикие предки коровы Биополимеры (свойства)
Биополимеры (свойства) Аппарат опоры и движения
Аппарат опоры и движения Железы
Железы Особенности белков
Особенности белков Отряд Чешуйчатые. Семейство Вараны
Отряд Чешуйчатые. Семейство Вараны Надкласс рыбы. Строение и размножение
Надкласс рыбы. Строение и размножение Многообразие насекомых, их роль в природе и практическое значение
Многообразие насекомых, их роль в природе и практическое значение