Содержание
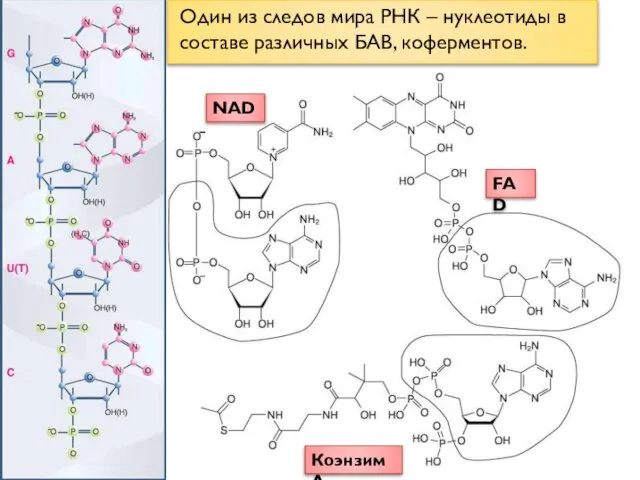
- 2. Один из следов мира РНК – нуклеотиды в составе различных БАВ, коферментов. NAD Коэнзим А FAD
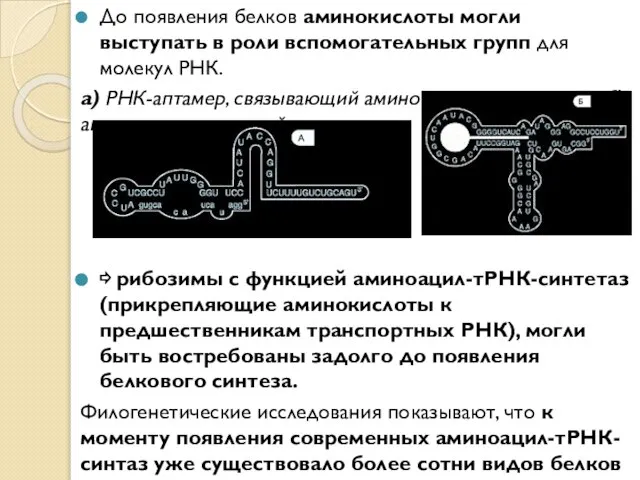
- 3. До появления белков аминокислоты могли выступать в роли вспомогательных групп для молекул РНК. а) РНК-аптамер, связывающий
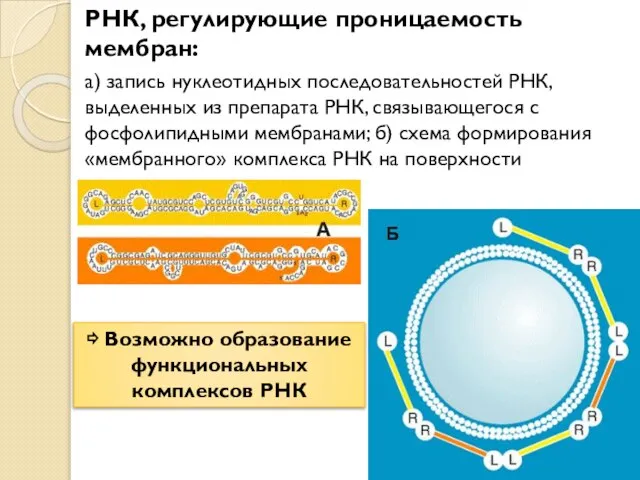
- 4. РНК, регулирующие проницаемость мембран: а) запись нуклеотидных последовательностей РНК, выделенных из препарата РНК, связывающегося с фосфолипидными
- 5. Транспортные РНК – важнейшая деталь системы синтеза белка Посредник между аминокислотами и нуклеотидами; Короче других типов
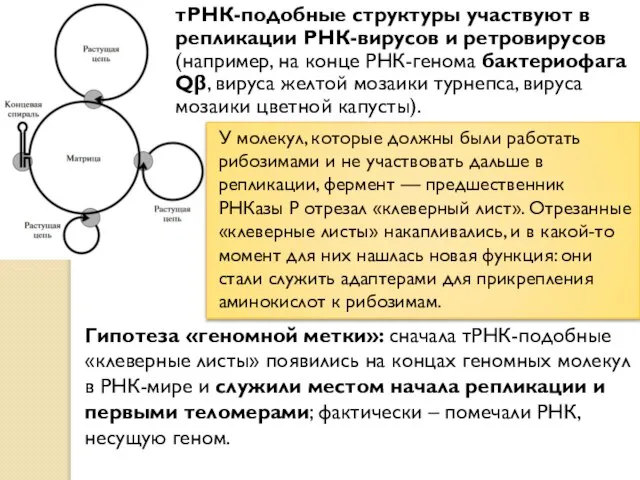
- 6. тРНК-подобные структуры участвуют в репликации РНК-вирусов и ретровирусов (например, на конце РНК-генома бактериофага Qβ, вируса желтой
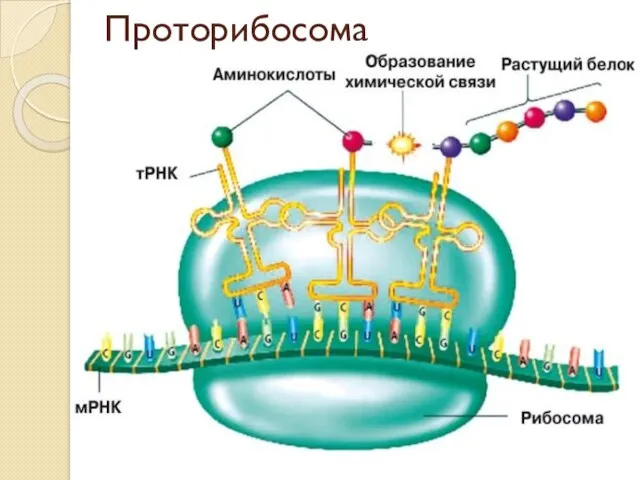
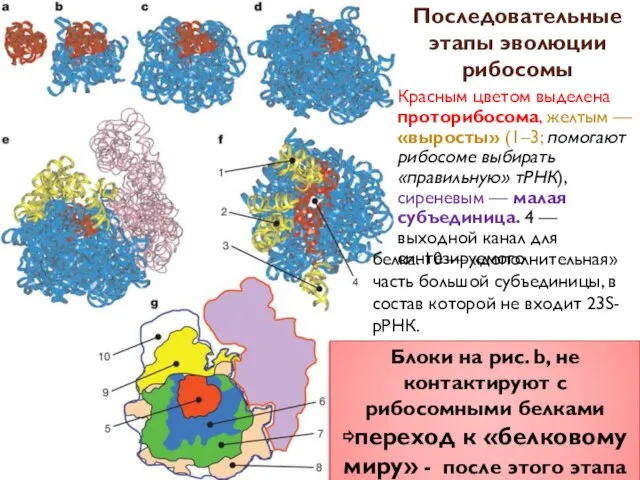
- 7. Проторибосома Рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы»,
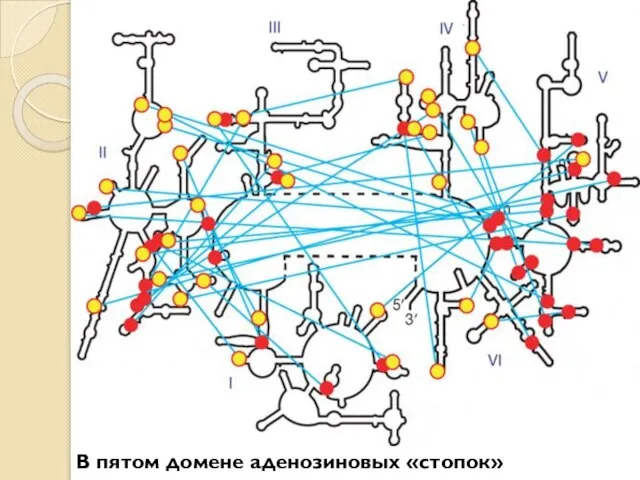
- 8. А-минорные взаимодействия необходимы для поддержания стабильной трехмерной структуры той части молекулы, к которой принадлежит аденозиновая «стопка»,
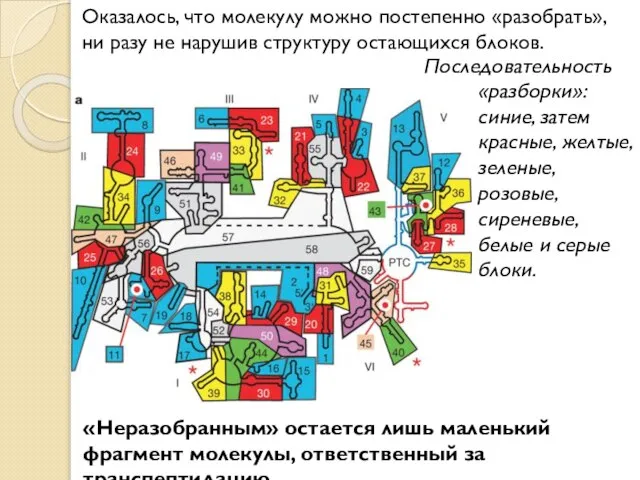
- 9. Оказалось, что молекулу можно постепенно «разобрать», ни разу не нарушив структуру остающихся блоков. «Неразобранным» остается лишь
- 10. Красным цветом выделена проторибосома, желтым — «выросты» (1–3; помогают рибосоме выбирать «правильную» тРНК), сиреневым — малая
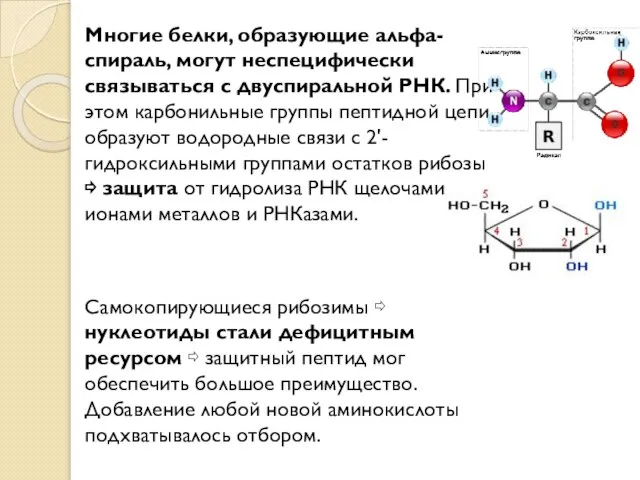
- 11. Многие белки, образующие альфа-спираль, могут неспецифически связываться с двуспиральной РНК. При этом карбонильные группы пептидной цепи
- 12. Теории возникновения связи между аминокислотами и нуклеотидными триплетами: «Застывшая случайность»; Оптимизация на минимум ошибок белкового синтеза:
- 13. Теория оптимизации: Цель – чтобы при ошибках трансляции аминокислоты заменялись на химически похожие. При этом вероятность
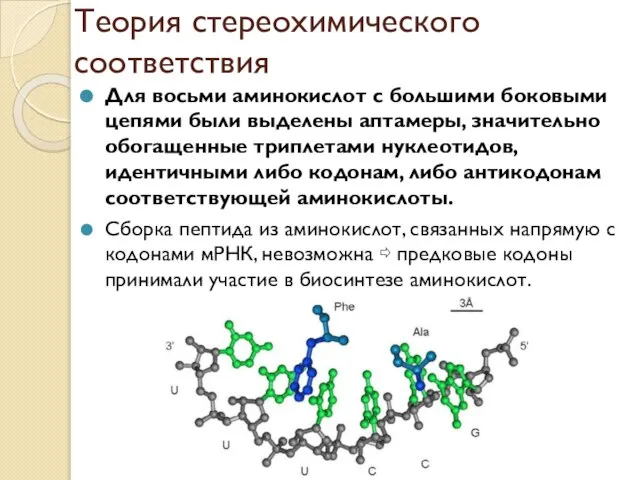
- 14. Теория стереохимического соответствия Для восьми аминокислот с большими боковыми цепями были выделены аптамеры, значительно обогащенные триплетами
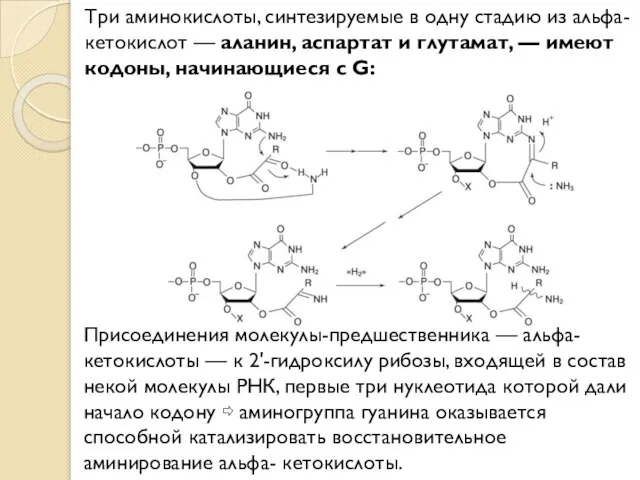
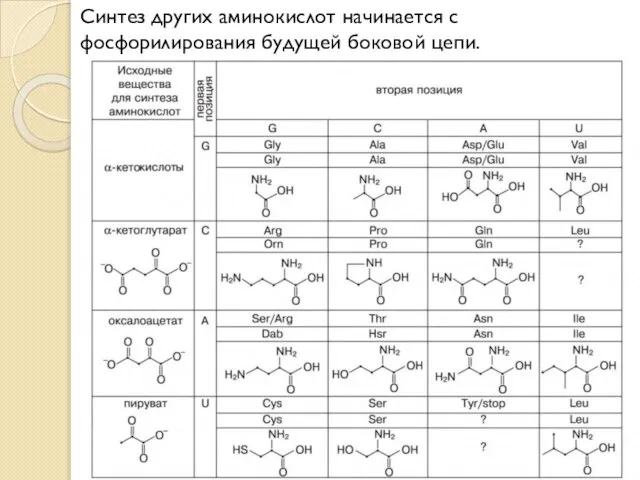
- 15. Три аминокислоты, синтезируемые в одну стадию из альфа-кетокислот — аланин, аспартат и глутамат, — имеют кодоны,
- 16. Синтез других аминокислот начинается с фосфорилирования будущей боковой цепи.
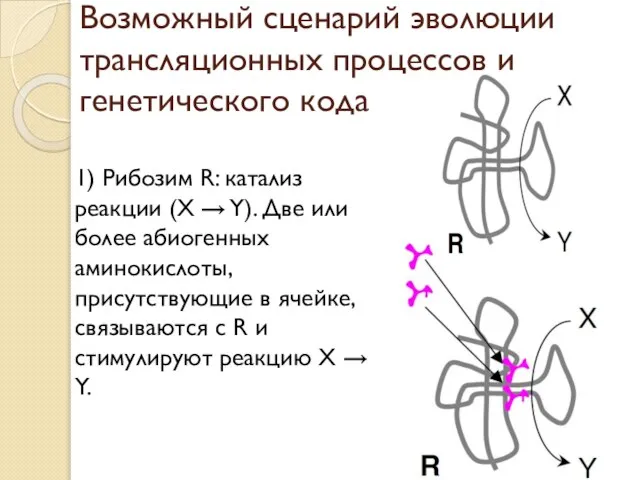
- 17. Возможный сценарий эволюции трансляционных процессов и генетического кода 1) Рибозим R: катализ реакции (X → Y).
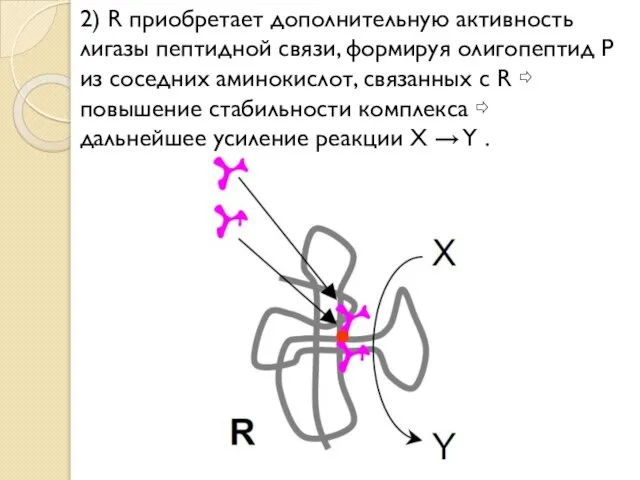
- 18. 2) R приобретает дополнительную активность лигазы пептидной связи, формируя олигопептид P из соседних аминокислот, связанных с
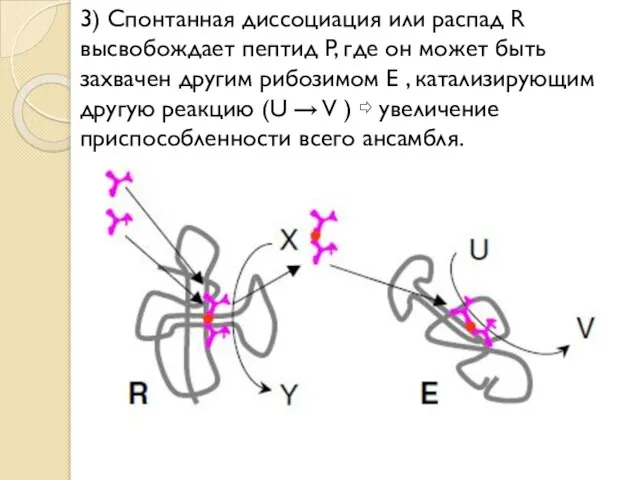
- 19. 3) Спонтанная диссоциация или распад R высвобождает пептид P, где он может быть захвачен другим рибозимом
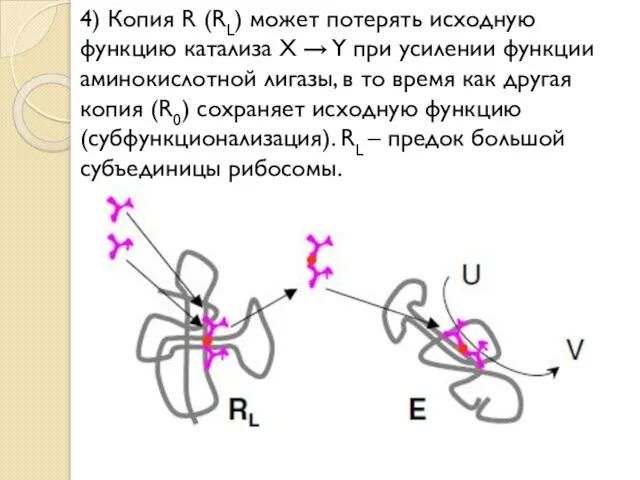
- 20. 4) Копия R (RL) может потерять исходную функцию катализа X → Y при усилении функции аминокислотной
- 21. 5) Катализ при помощи пептидов ⇨ аминокислоты становятся ценным ресурсом ⇨ развиваются малые РНК (T), связывающие
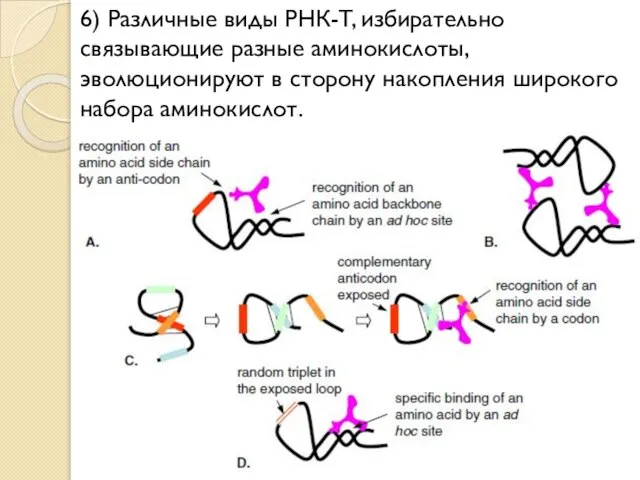
- 22. 6) Различные виды РНК-T, избирательно связывающие разные аминокислоты, эволюционируют в сторону накопления широкого набора аминокислот.
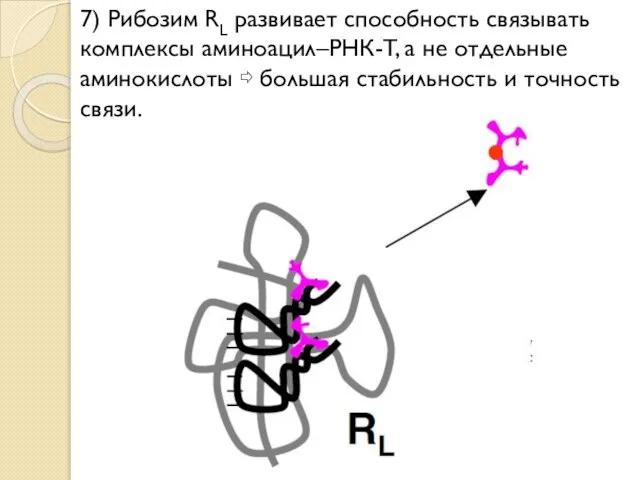
- 23. 7) Рибозим RL развивает способность связывать комплексы аминоацил–РНК-T, а не отдельные аминокислоты ⇨ большая стабильность и
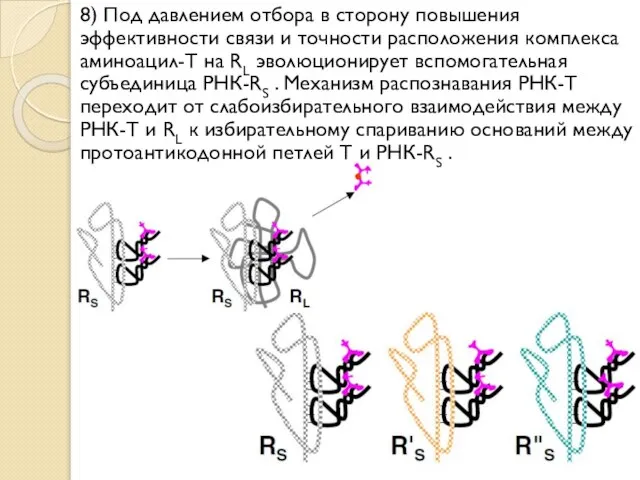
- 24. 8) Под давлением отбора в сторону повышения эффективности связи и точности расположения комплекса аминоацил-T на RL
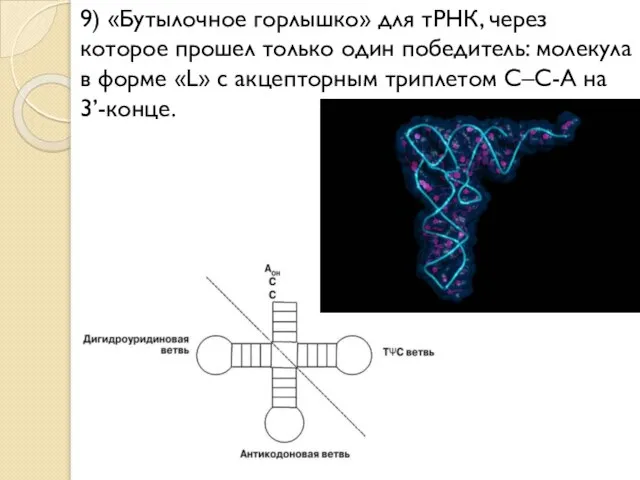
- 25. 9) «Бутылочное горлышко» для тРНК, через которое прошел только один победитель: молекула в форме «L» с
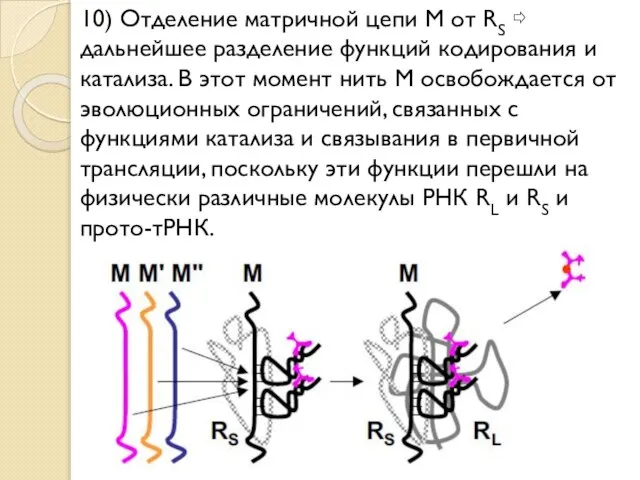
- 26. 10) Отделение матричной цепи M от RS ⇨ дальнейшее разделение функций кодирования и катализа. В этот
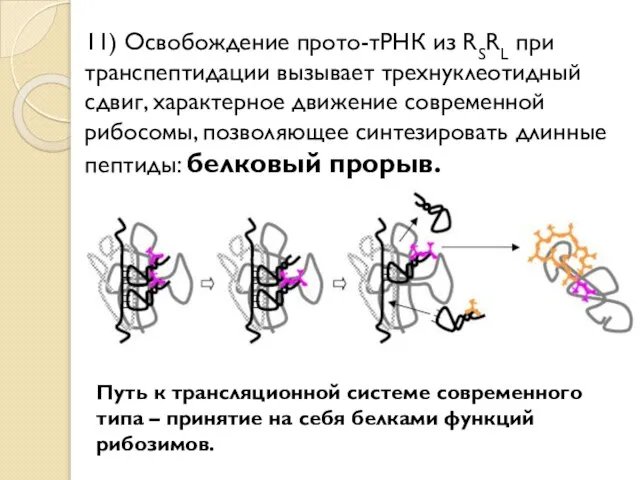
- 27. 11) Освобождение прото-тРНК из RSRL при транспептидации вызывает трехнуклеотидный сдвиг, характерное движение современной рибосомы, позволяющее синтезировать
- 29. Скачать презентацию



 Аминокислоты. Белки аминокислоты
Аминокислоты. Белки аминокислоты Отдел Покрытосеменные растения
Отдел Покрытосеменные растения Эфирные масла – как антисептик!
Эфирные масла – как антисептик! Основные теории антропогинеза
Основные теории антропогинеза Организменный уровень организации биологических систем. Размножение организмов. Лекция 4
Организменный уровень организации биологических систем. Размножение организмов. Лекция 4 Структура и функция аминокислот, белков и нуклеиновых кислот
Структура и функция аминокислот, белков и нуклеиновых кислот Бидайдың біртектілігін анықтау
Бидайдың біртектілігін анықтау Клетки оргнизма
Клетки оргнизма Продукты выделения организмов
Продукты выделения организмов Великаны и карлики в живом мире
Великаны и карлики в живом мире Кошка. Умники и умницы
Кошка. Умники и умницы Виртуальный гербарий
Виртуальный гербарий Витамин F
Витамин F Воздействие окружающей среды на микроорганизмы
Воздействие окружающей среды на микроорганизмы Клуб любителей кошек
Клуб любителей кошек Лекция_2_Анатомия_и_физиология_эндокринной_систем
Лекция_2_Анатомия_и_физиология_эндокринной_систем Презентация на тему Семейство Злаковые
Презентация на тему Семейство Злаковые  Многообразие организмов и их классификация
Многообразие организмов и их классификация Фотосинтез. Ян ван Гельмонт
Фотосинтез. Ян ван Гельмонт Тела, вещества, частицы. Урок окружающего мира, 3 класс
Тела, вещества, частицы. Урок окружающего мира, 3 класс Презентация на тему Увеличительные приборы и правила работы с ними
Презентация на тему Увеличительные приборы и правила работы с ними  Нервная система
Нервная система Внутреннее строение рыбы, на примере дыхательной системы
Внутреннее строение рыбы, на примере дыхательной системы Блоковый нерв
Блоковый нерв Обобщение и систематизация знаний по теме Организм и среда. Вид и популяция. Экосистемы
Обобщение и систематизация знаний по теме Организм и среда. Вид и популяция. Экосистемы Обобщение селекция
Обобщение селекция Презентация на тему Проблема здоровья человека
Презентация на тему Проблема здоровья человека  Отряд пингвинообразные
Отряд пингвинообразные