Содержание
- 2. Ферментами называют биологические катализаторы, построенные из белков, спо-собные высокоизбирательно реагировать с веществами и ускорять их превращения
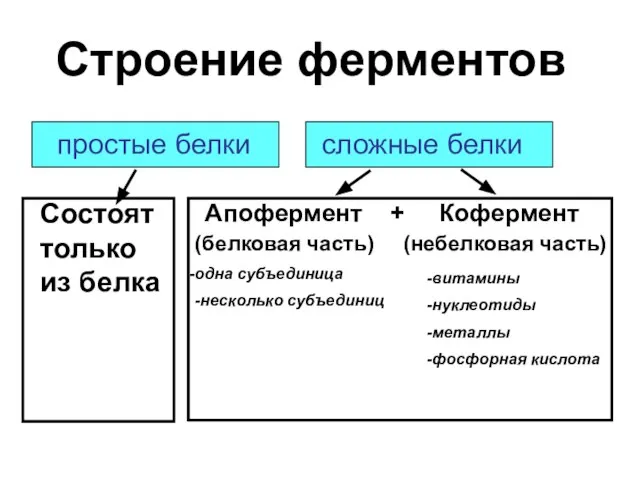
- 3. Строение ферментов Апофермент + Кофермент (белковая часть) (небелковая часть) одна субъединица -несколько субъединиц -витамины -нуклеотиды -металлы
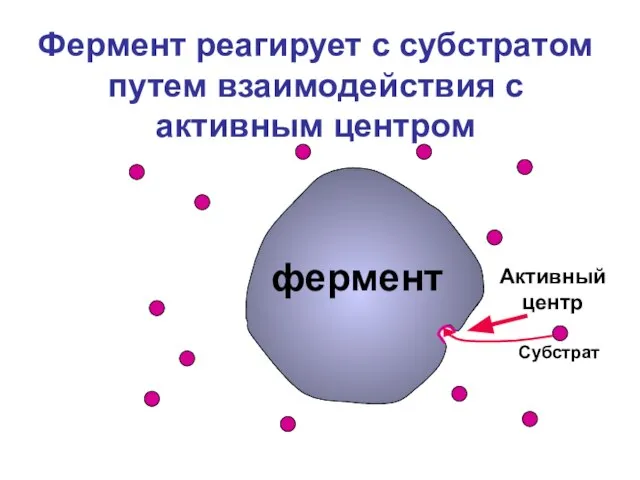
- 4. Фермент реагирует с субстратом путем взаимодействия с активным центром Субстрат фермент Активный центр
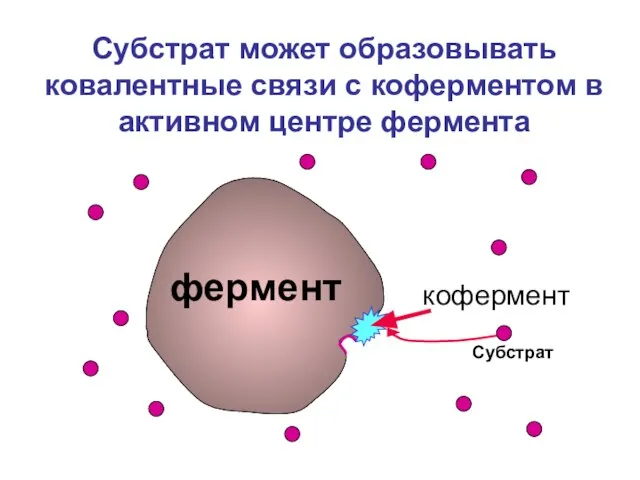
- 5. Субстрат может образовывать ковалентные связи с коферментом в активном центре фермента фермент кофермент Субстрат
- 6. Роль коферментов в ферментативной реакции Улучшают взаимодействие субстрата с ферментом - Образуют связи с субстратом -
- 7. Свойства ферментов
- 8. Специфичность фермента – способность взаимодействовать только с определенным видом молекул (субстратом)
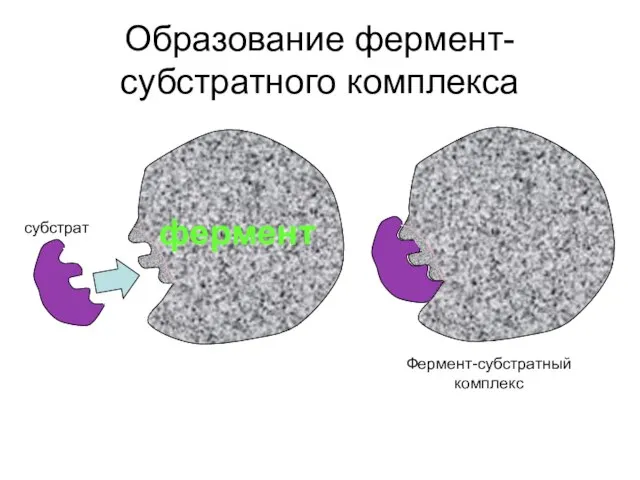
- 9. Образование фермент-субстратного комплекса фермент субстрат Фермент-субстратный комплекс
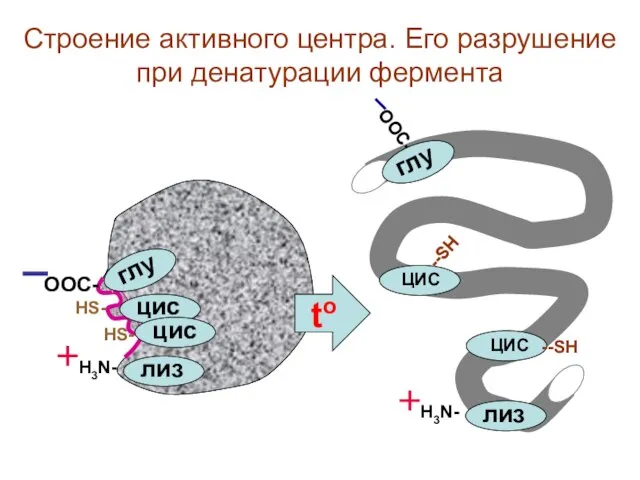
- 10. ООС- глу H3N- лиз --SH ЦИС --SH ЦИС to Строение активного центра. Его разрушение при денатурации
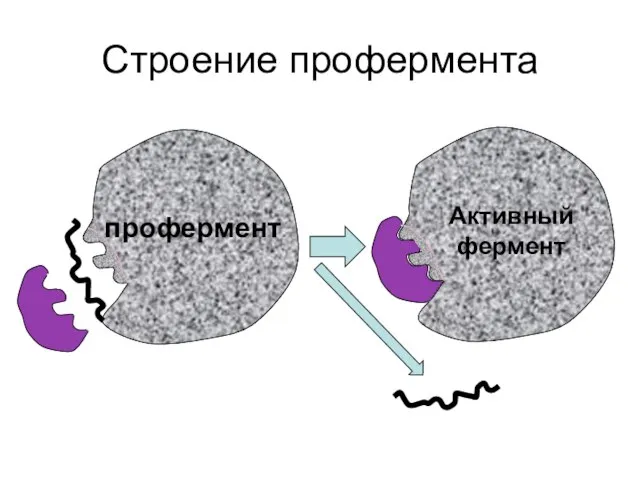
- 11. Строение профермента профермент Активный фермент
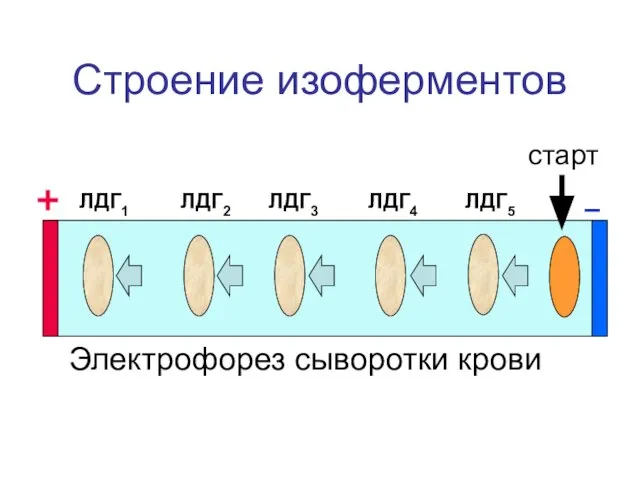
- 12. Строение изоферментов ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5 Электрофорез сыворотки крови старт
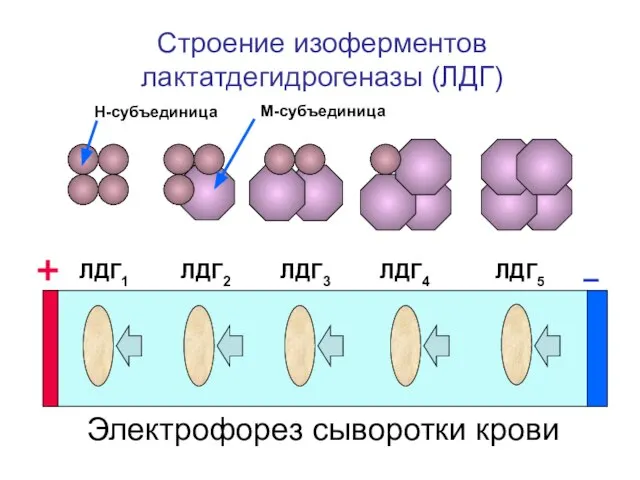
- 13. Строение изоферментов лактатдегидрогеназы (ЛДГ) ЛДГ1 ЛДГ2 ЛДГ3 ЛДГ4 ЛДГ5 Н-субъединица М-субъединица Электрофорез сыворотки крови
- 14. Факторы, влияющие на активность ферментов Температура Кислотность среды Металлы Коферменты Концентрация субстрата Концентрация продукта реакции Ингибиторы
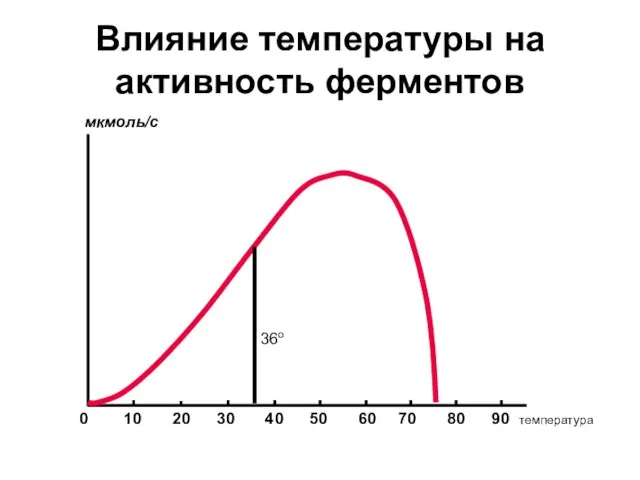
- 15. Влияние температуры на активность ферментов 0 10 20 30 40 50 60 70 80 90 температура
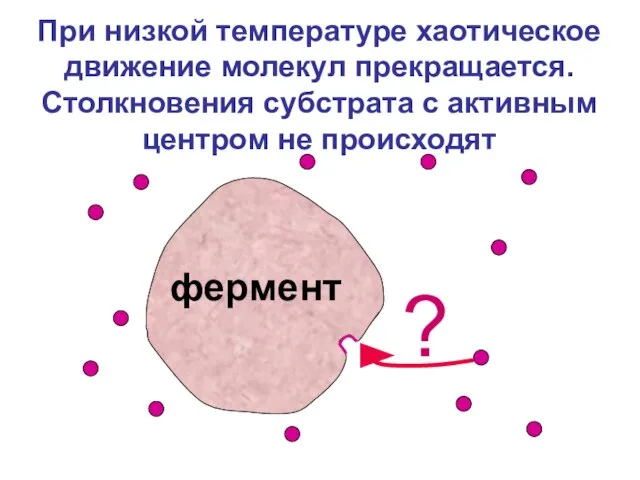
- 16. При низкой температуре хаотическое движение молекул прекращается. Столкновения субстрата с активным центром не происходят фермент ?
- 17. ООС- HS- HS- H3N- глу цис цис лиз ООС- глу H3N- лиз --SH ЦИС --SH ЦИС
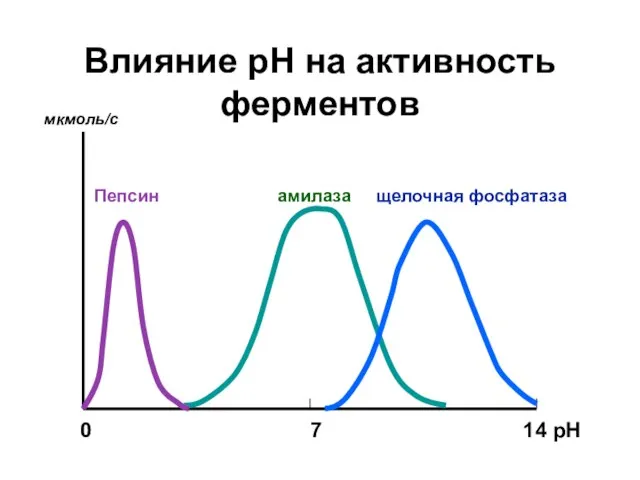
- 18. Влияние рН на активность ферментов 0 7 14 рН мкмоль/с Пепсин амилаза щелочная фосфатаза
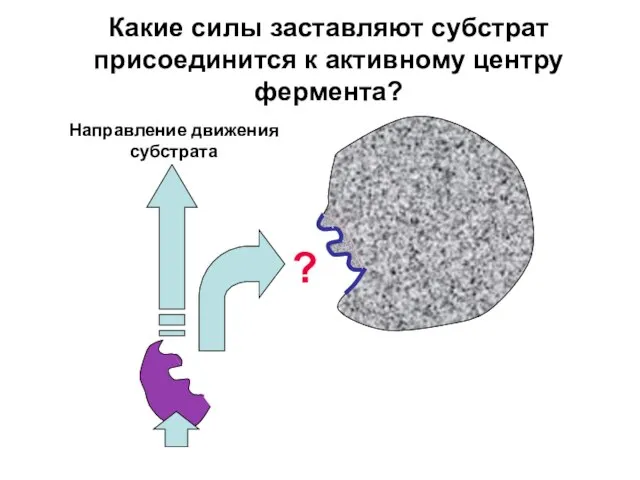
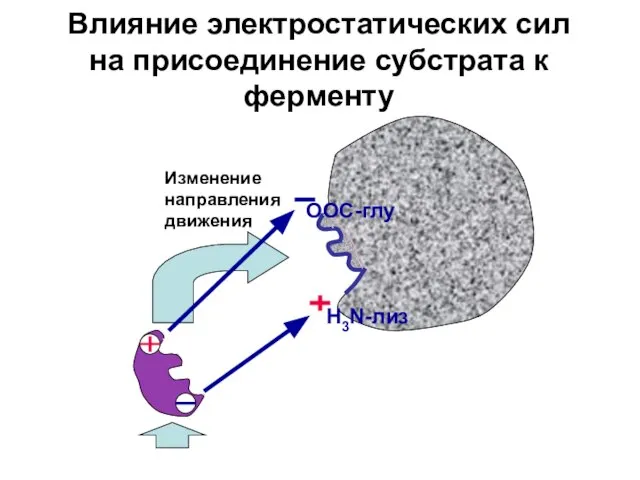
- 19. Какие силы заставляют субстрат присоединится к активному центру фермента? Направление движения субстрата ?
- 20. ООС-глу H3N-лиз Влияние электростатических сил на присоединение субстрата к ферменту Изменение направления движения
- 21. Механизм ингибирования активности фермента при снижении рН внутри клеток
- 22. На активность фермента оказывают влияние металлы, активаторы или ингибиторы ферментов.
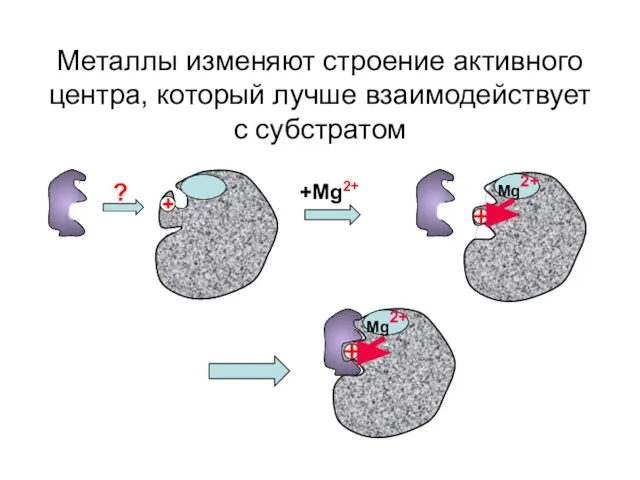
- 23. Металлы изменяют строение активного центра, который лучше взаимодействует с субстратом +Mg2+ ? Mg2+ Mg2+
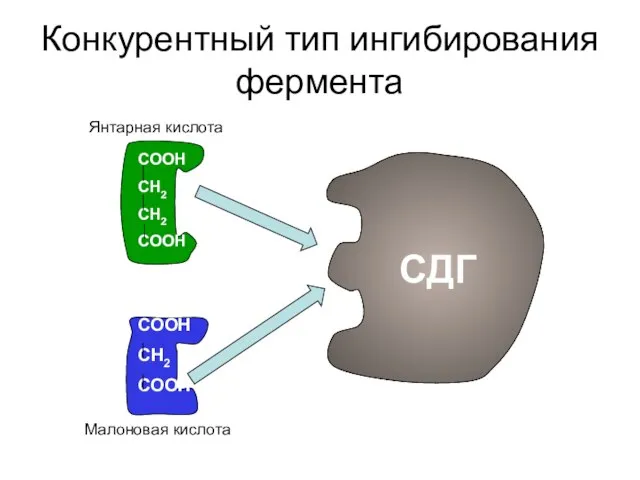
- 24. Конкурентный тип ингибирования фермента СООН СН2 СН2 СООН СООН СН2 СООН СДГ Янтарная кислота Малоновая кислота
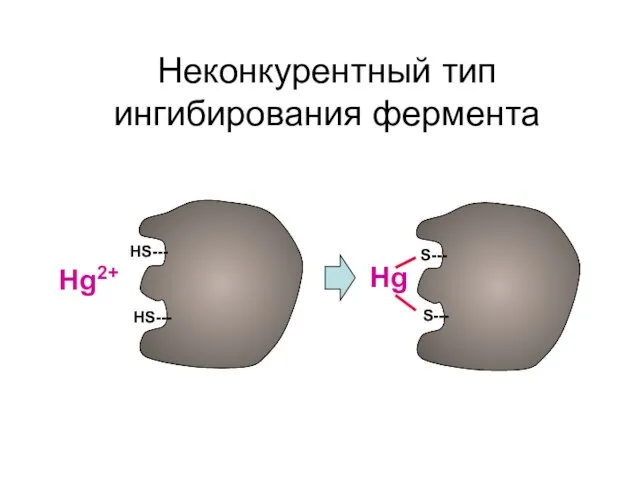
- 25. Неконкурентный тип ингибирования фермента НS--- НS--- S--- S--- Hg2+ Hg
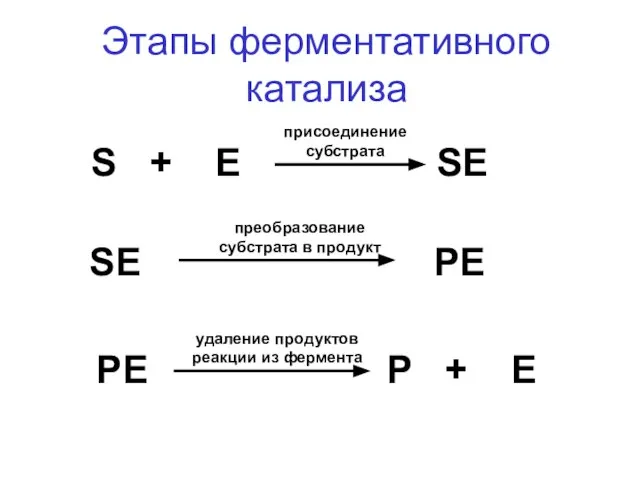
- 26. Этапы ферментативного катализа 1. Присоединение субстрата к активному центру с образованием единого молекулярного комплекса; 2. Конформационная
- 27. S + E SE SE PE PE P + E Этапы ферментативного катализа присоединение субстрата преобразование
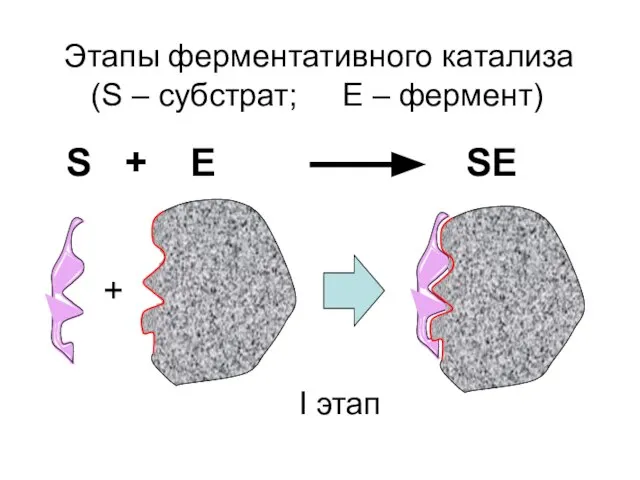
- 28. Этапы ферментативного катализа (S – субстрат; Е – фермент) + S + E SE I этап
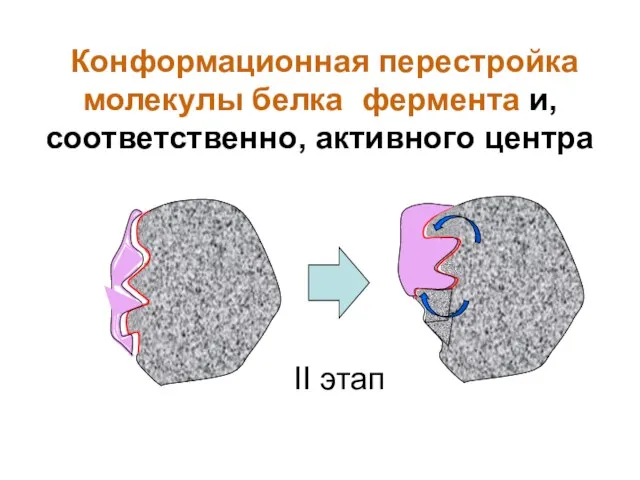
- 29. II этап Конформационная перестройка молекулы белка фермента и, соответственно, активного центра
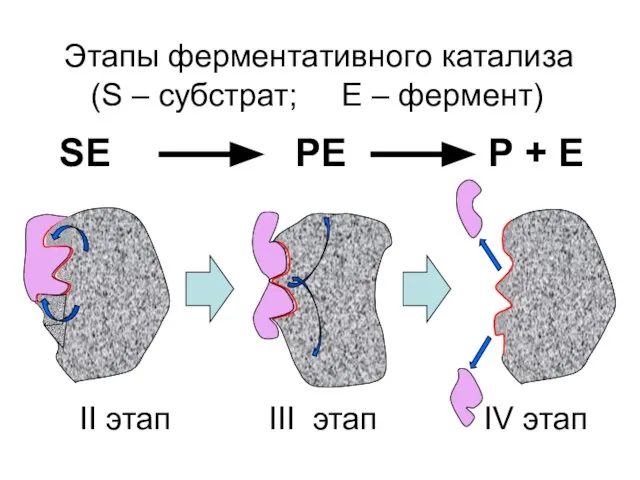
- 30. Этапы ферментативного катализа (S – субстрат; Е – фермент) SE PE P + E II этап
- 31. Динамика изменения активности фермента во время протекании химической реакции
- 32. СКОРОСТЬ РЕАКЦИИ (V) - определяют по количеству молей субстрата превращенного ферментом за секунду (моль/с). КАТАЛ -
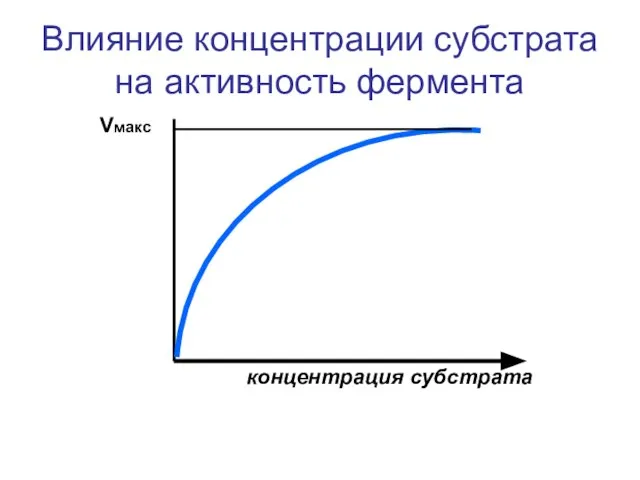
- 33. Влияние концентрации субстрата на активность фермента Vмакс концентрация субстрата
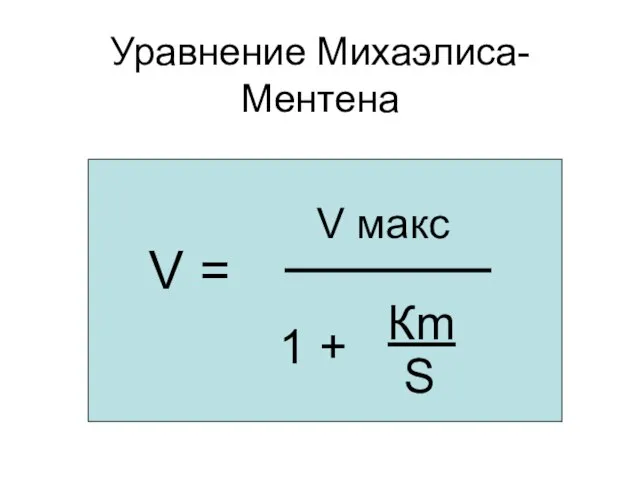
- 34. Уравнение Михаэлиса-Ментена V = V макс 1 + Кm S
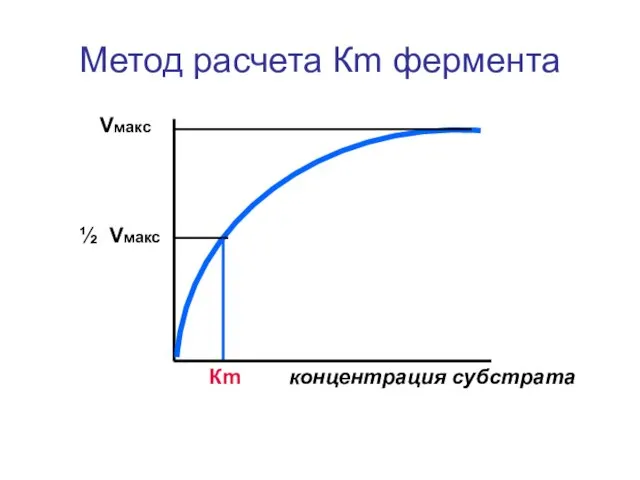
- 35. Метод расчета Кm фермента Vмакс ½ Vмакс Кm концентрация субстрата
- 36. Оценка Кm в биохимической практике позволяет определить величину сродства субстрата к активному центру (чувствительность фермента к
- 37. Механизм ускорения химической реакции ферментом
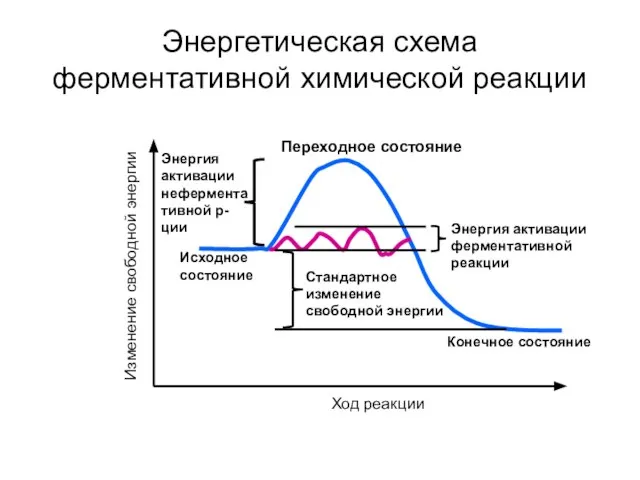
- 38. Энергетическая схема ферментативной химической реакции Изменение свободной энергии Исходное состояние Переходное состояние Конечное состояние Энергия активации
- 39. Регуляция активности ферментов
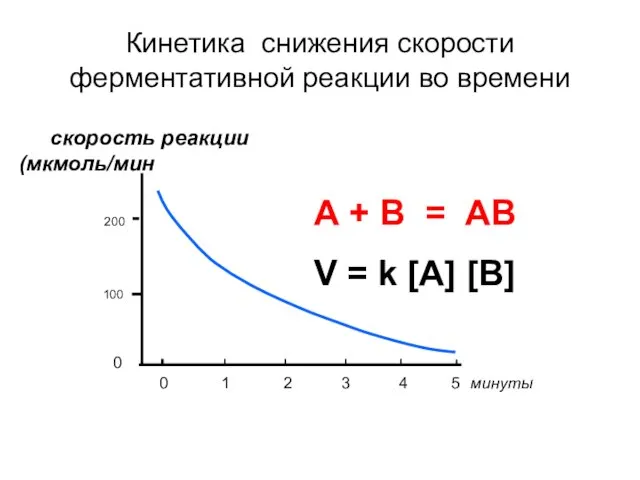
- 40. Кинетика снижения скорости ферментативной реакции во времени скорость реакции (мкмоль/мин 200 100 0 1 2 3
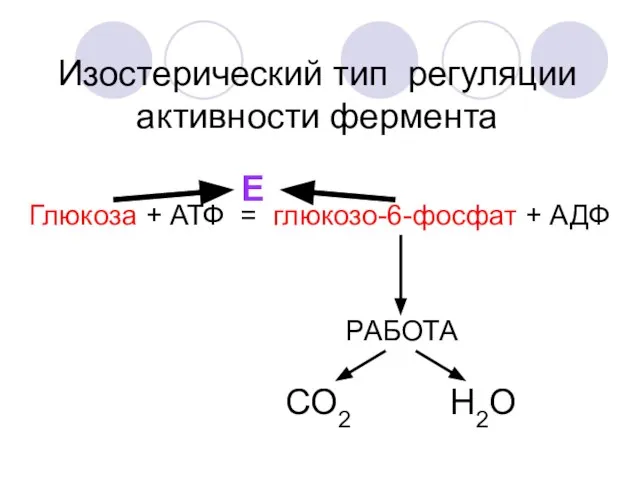
- 41. Глюкоза + АТФ = глюкозо-6-фосфат + АДФ Е Изостерический тип регуляции активности фермента РАБОТА СО2 Н2О
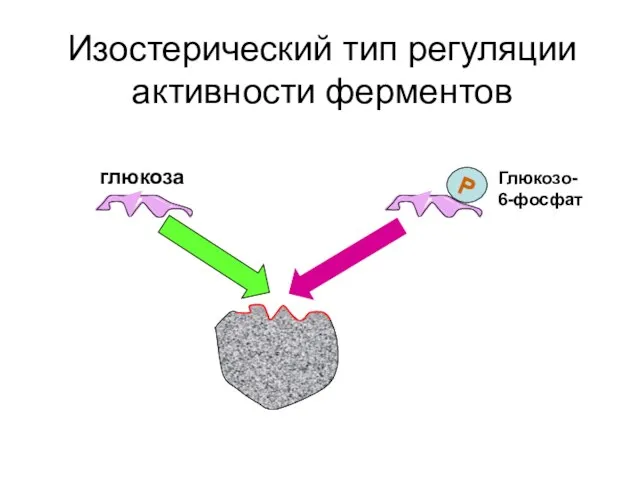
- 42. Изостерический тип регуляции активности ферментов Р глюкоза Глюкозо-6-фосфат
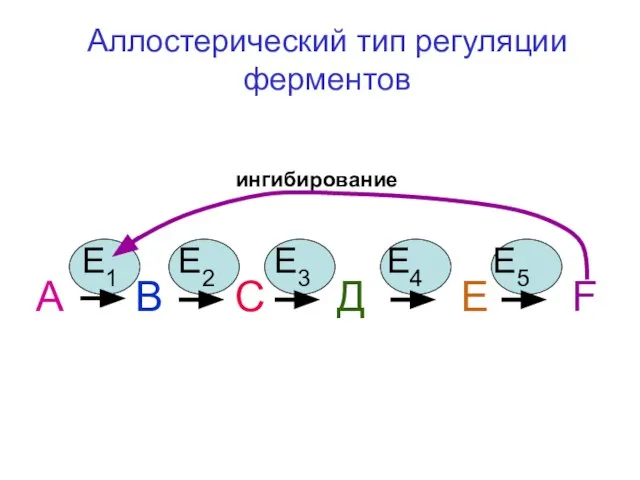
- 43. Аллостерический тип регуляции ферментов А В С Д Е F E1 E2 E3 E4 E5 ингибирование
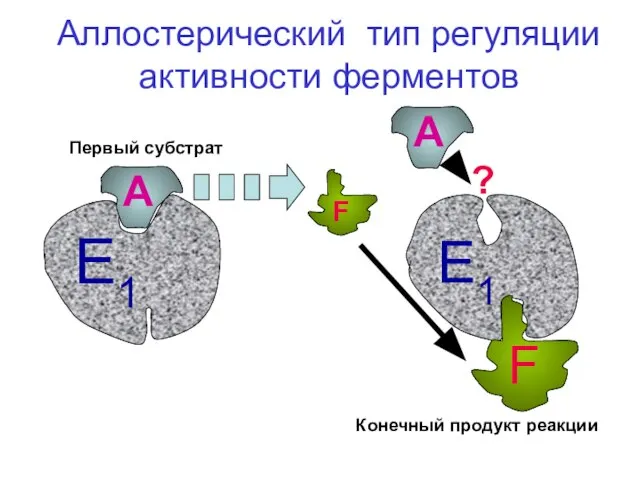
- 44. А F А ? Аллостерический тип регуляции активности ферментов Первый субстрат Конечный продукт реакции Е1 Е1
- 45. Роль аллостерических ферментов в метаболизме клетки Регуляция скорости синтеза веществ; В случае накопления энергии (АТФ), обмен
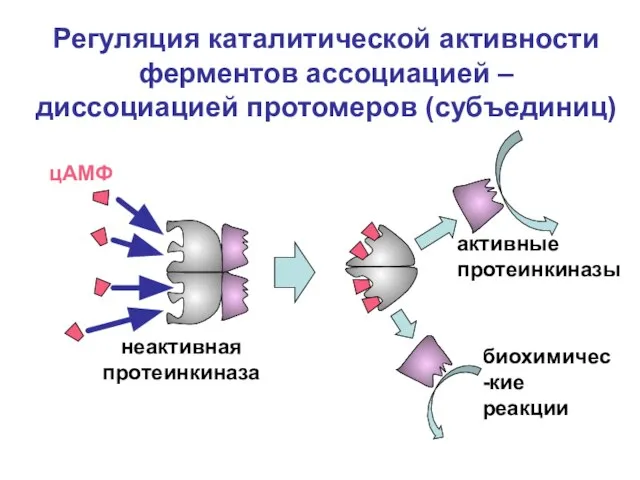
- 46. Регуляция каталитической активности ферментов ассоциацией – диссоциацией протомеров (субъединиц) неактивная протеинкиназа цАМФ активные протеинкиназы биохимичес-кие реакции
- 47. Регуляция активности путем фосфорилирования (дефосфорилирования) фермента ОН О-РО3Н2 + АТФ неактивный фермент активный фермент АДФ субстрат
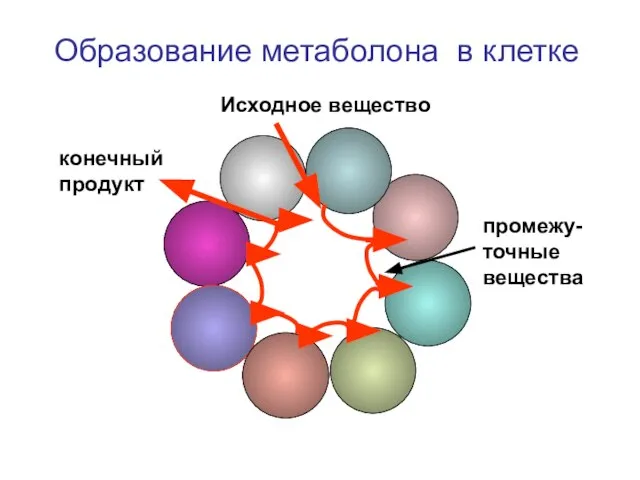
- 48. Образование метаболона в клетке Исходное вещество конечный продукт промежу-точные вещества
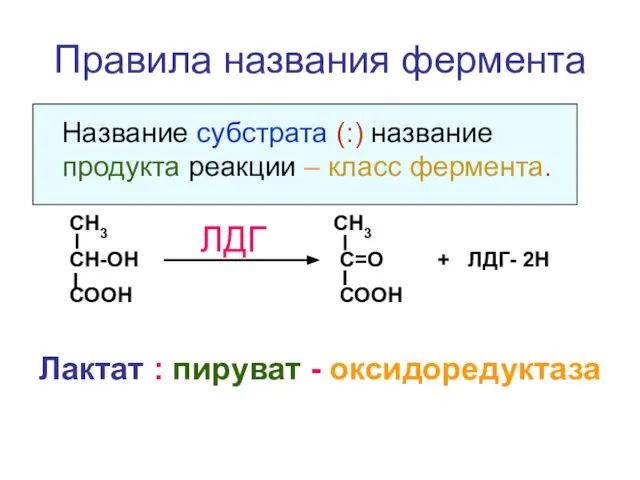
- 49. Правила названия фермента Название субстрата (:) название продукта реакции – класс фермента. Лактат : пируват -
- 50. Классификация ферментов Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы
- 51. 1. Оксидоредуктазы Катализируют окислительно-восстановительные реакции Окисление спиртовых групп; Окисление альдегидов; Окисление кетонов (одновременно с декарбоксилированием); Дегидрирование
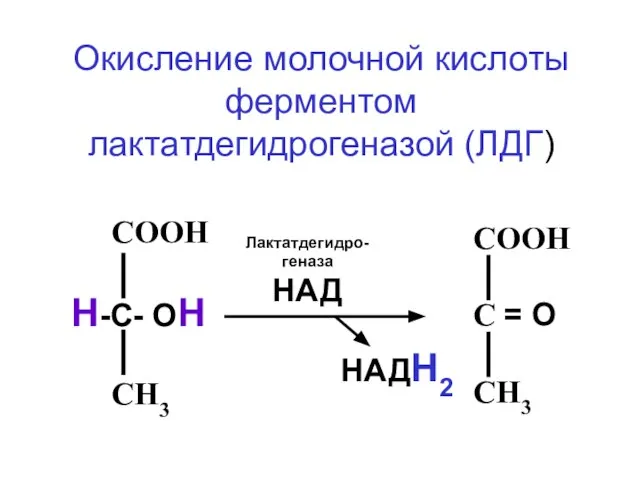
- 52. СООН С = О СН3 СООН Н-С- ОН СН3 Лактатдегидро-геназа НАД НАДН2 Окисление молочной кислоты ферментом
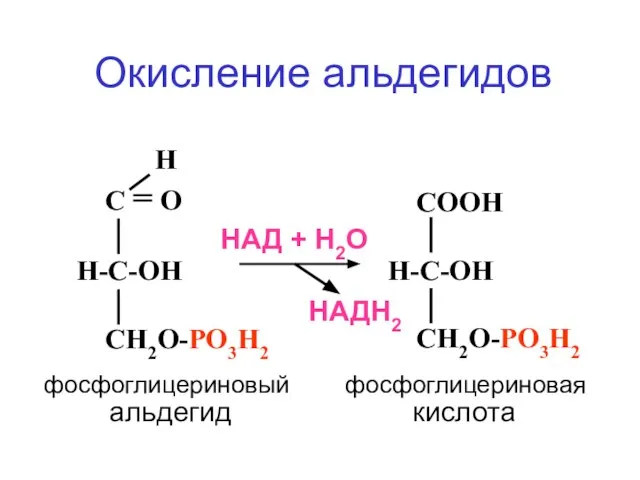
- 53. Н С = О Н-С-ОН СН2О-РО3Н2 СООН Н-С-ОН СН2О-РО3Н2 НАДН2 НАД + Н2О Окисление альдегидов фосфоглицериновый
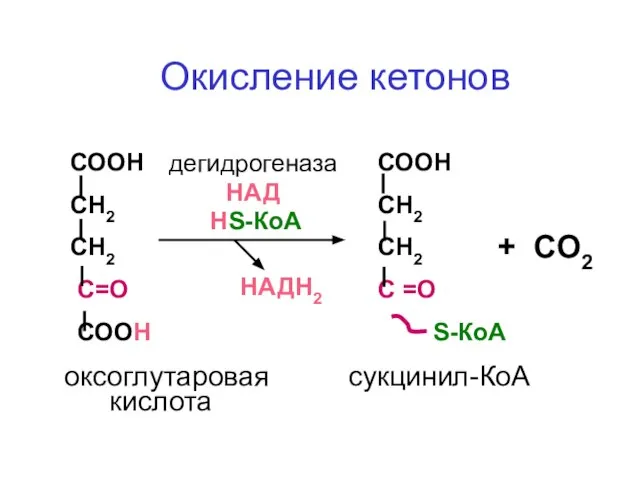
- 54. СООН СН2 СН2 С=О СООН СООН СН2 СН2 С =О S-КоА НS-КоА дегидрогеназа НАД НАДН2 оксоглутаровая
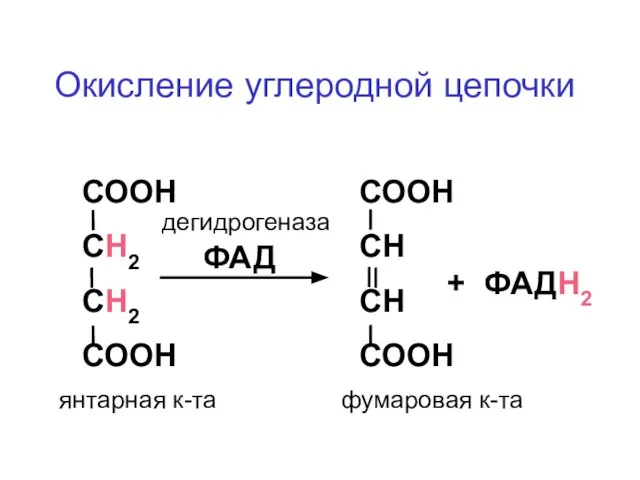
- 55. СООН СН2 СН2 СООН СООН СН СН СООН дегидрогеназа ФАД + ФАДН2 янтарная к-та фумаровая к-та
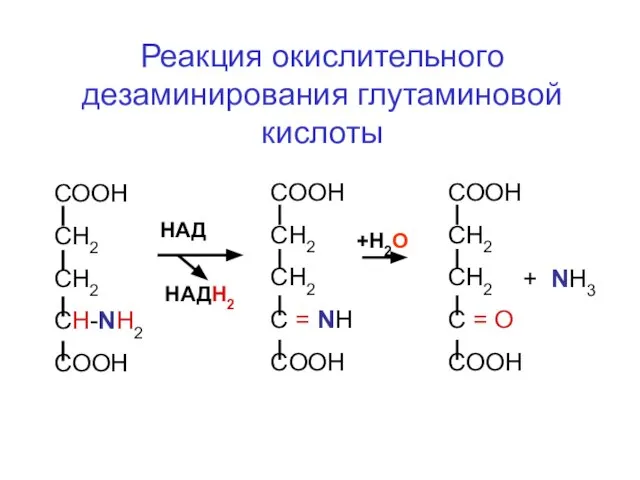
- 56. Реакция окислительного дезаминирования глутаминовой кислоты СООН СН2 СН2 CH-NH2 COOH HАД HАДН2 +Н2О СООН СН2 СН2
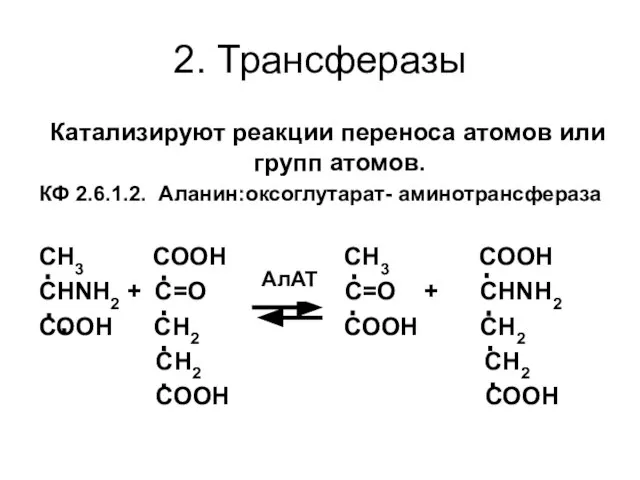
- 57. 2. Трансферазы Катализируют реакции переноса атомов или групп атомов. КФ 2.6.1.2. Аланин:оксоглутарат- аминотрансфераза СН3 СООН СН3
- 58. 3. Гидролазы Расщепляют ковалентные связи с участием молекул воды 3.1.1.3 - липаза 3.2.1.1. - альфа-амилаза 3.4.3.2.
- 59. 4. Лиазы Разрывают ковалентные связи без участия молекул воды 4.1.1.1. – пируватдекарбоксилаза (разрывают связи -С-С-) 4.2.1.1.
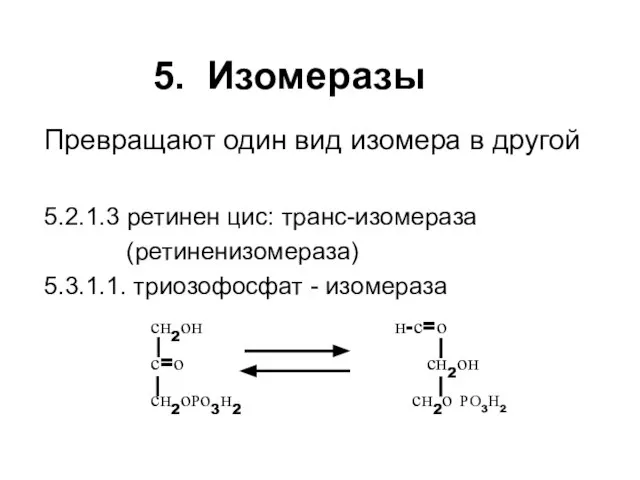
- 60. 5. Изомеразы Превращают один вид изомера в другой 5.2.1.3 ретинен цис: транс-изомераза (ретиненизомераза) 5.3.1.1. триозофосфат -
- 61. 6. Лигазы (синтетазы) Участвуют в синтезе новых веществ, путем соединения молекул друг с другом 6.1.1.1. тирозин:
- 62. Применение ферментов в медицине. 1. Для диагностики заболеваний; 2. Для оценки тяжести протекания болезни; 3. Для
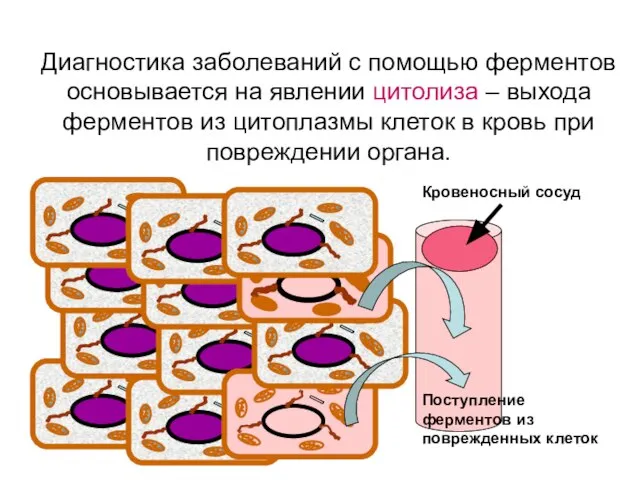
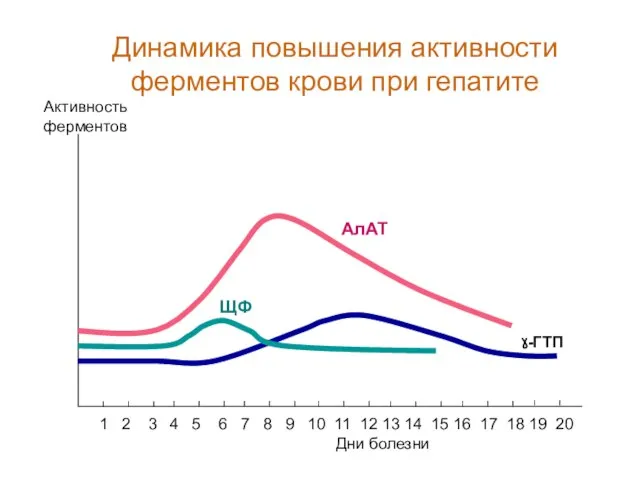
- 63. Диагностика заболеваний с помощью ферментов основывается на явлении цитолиза – выхода ферментов из цитоплазмы клеток в
- 64. ЩФ Дни болезни Активность ферментов 1 2 3 4 5 6 7 8 9 10 11
- 65. Применение ферментов в качестве лекарственных средств Заместительная терапия (пепсин, ферменты поджелудочной железы); В хирургической практике для
- 67. Скачать презентацию























 Osennii_774_e_776_zhik
Osennii_774_e_776_zhik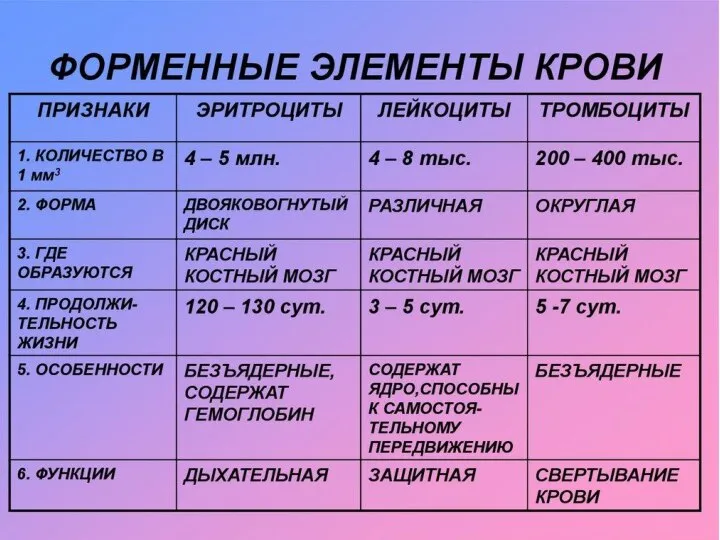 Форменные элементы крови
Форменные элементы крови Боль в спине. Истории пациентов (собак)
Боль в спине. Истории пациентов (собак) Вирусы
Вирусы Продуктивность сообщества. Сукцессии
Продуктивность сообщества. Сукцессии Взаимодействие генов
Взаимодействие генов Физиология возбудимых тканей. Биологические реакции организма
Физиология возбудимых тканей. Биологические реакции организма Пропорции и строение фигуры человека
Пропорции и строение фигуры человека Особенности внутреннего строения птиц в связи с приспособленностью к полету
Особенности внутреннего строения птиц в связи с приспособленностью к полету Зеленое ожерелье Байкала. Биосферные парки
Зеленое ожерелье Байкала. Биосферные парки Насекомоядные. Рукокрылые. Грызуны
Насекомоядные. Рукокрылые. Грызуны Презентация на тему РОГАТЫЕ НАСЕКОМЫЕ
Презентация на тему РОГАТЫЕ НАСЕКОМЫЕ  Презентация на тему Отряд Пингвины
Презентация на тему Отряд Пингвины  Презентация на тему ЧЛЕНИСТОНОГИЕ
Презентация на тему ЧЛЕНИСТОНОГИЕ  Вишня и слива
Вишня и слива Физиология пищеварения в желудке. Лекция № 19
Физиология пищеварения в желудке. Лекция № 19 Надземна частина рослин
Надземна частина рослин Наследственность и изменчивость
Наследственность и изменчивость Прогноз развития вредителей и болезней в 2021 году по Республике Башкортостан
Прогноз развития вредителей и болезней в 2021 году по Республике Башкортостан l2povrezhd
l2povrezhd Отряд голенастые
Отряд голенастые Тип простейшие. Класс споровики
Тип простейшие. Класс споровики Животная клетка
Животная клетка Презентация на тему Деревья и листья
Презентация на тему Деревья и листья  Обобщающий урок-игра И пух, и перо 7 класс
Обобщающий урок-игра И пух, и перо 7 класс Влияние различных условий (температура, pH) на структуру белков. Лабораторная работа 2
Влияние различных условий (температура, pH) на структуру белков. Лабораторная работа 2 Глаз и зрение
Глаз и зрение Высшая нервная деятельность
Высшая нервная деятельность