молекул электролитов на ионы. Этот процесс получил название - электролитическая диссоциация.
Степень диссоциации - доля в растворенном веществе молекул, распавшихся на ионы, зависит от температуры, концентрации раствора и электрических свойств растворителя. С увеличением температуры степень диссоциации возрастает и, увеличивается концентрация положительно и отрицательно заряженных ионов.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся за секунду на ионы, равно числу пар ионов, которые за то же время объединяются в нейтральные молекулы.
Электролитическая диссоциация










 Что изучает физика? (7 класс)
Что изучает физика? (7 класс) Оптика. Раздел 5
Оптика. Раздел 5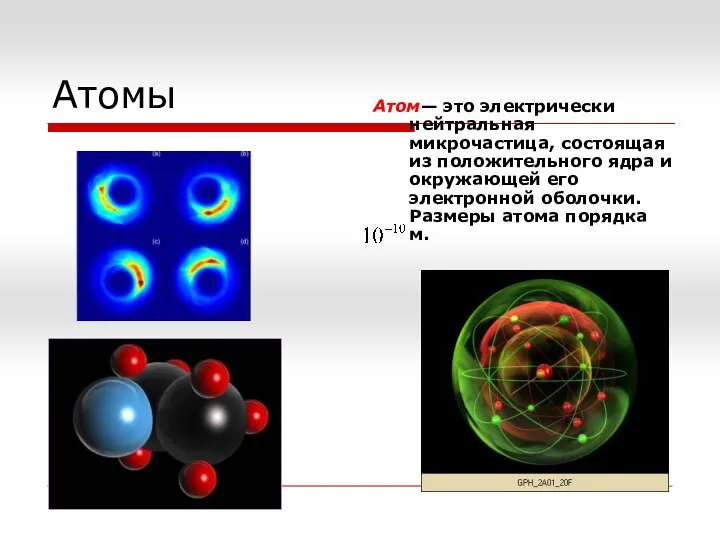 Атомы
Атомы Термометр Галілея
Термометр Галілея Теория суперструн
Теория суперструн Топливо будущего
Топливо будущего Квантовая механика
Квантовая механика Устройство и ремонт унифицированной гидропередачи УГП-1200
Устройство и ремонт унифицированной гидропередачи УГП-1200 Силы, действующие на поезд. Теория электрической тяги
Силы, действующие на поезд. Теория электрической тяги 7 кл Три состояния вещ-ва
7 кл Три состояния вещ-ва Нанотехнологии и их применение
Нанотехнологии и их применение Последовательное и параллельное соединение проводников
Последовательное и параллельное соединение проводников Магнитное взаимодействие Изучение свойств магнита Учитель И.А. Попова
Магнитное взаимодействие Изучение свойств магнита Учитель И.А. Попова Тепловые балансы. Основное уравнение теплопередачи
Тепловые балансы. Основное уравнение теплопередачи Дисперсия света. Интерференция механических волн
Дисперсия света. Интерференция механических волн Знаменитые физики 20 века и их заслуги
Знаменитые физики 20 века и их заслуги Активация в ядерной физике. (Тема 2.8)
Активация в ядерной физике. (Тема 2.8) Концепции современного естествознания
Концепции современного естествознания Принцип относительности Галилея. Инвариантные и относительные физические величины
Принцип относительности Галилея. Инвариантные и относительные физические величины Напряжение в точке включения реактора. Распределение напряжения по линии. Задача
Напряжение в точке включения реактора. Распределение напряжения по линии. Задача Приводные муфты
Приводные муфты Теплофизика процесса резания
Теплофизика процесса резания Инерция. Г. Галилей
Инерция. Г. Галилей Презентация на тему Прямолинейное равномерное движение
Презентация на тему Прямолинейное равномерное движение  Нерезьбовые соединения. Шпоночное соединение
Нерезьбовые соединения. Шпоночное соединение Импульс тела. Решение задач
Импульс тела. Решение задач Интеллектуальная игра. Машины
Интеллектуальная игра. Машины Фундаментальные и прикладные задачи гидромеханики
Фундаментальные и прикладные задачи гидромеханики