Содержание
- 2. Азот и его свойства Строение атома азота Строение молекулы азота Физические свойства Химические свойства Получение Применение
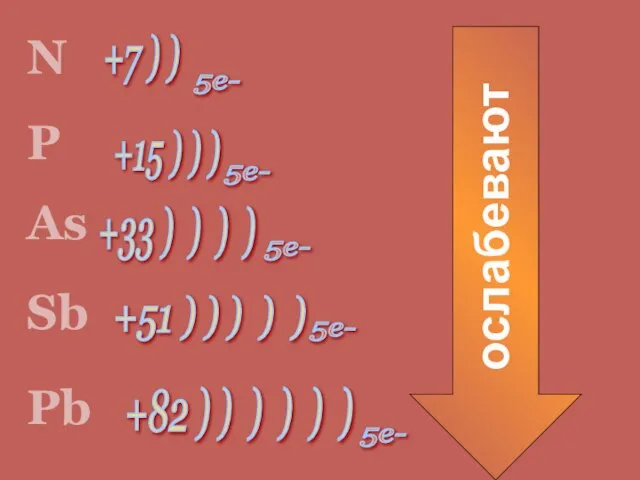
- 3. +7 ) ) +82 ) ) ) ) ) ) +51 ) ) ) ) )
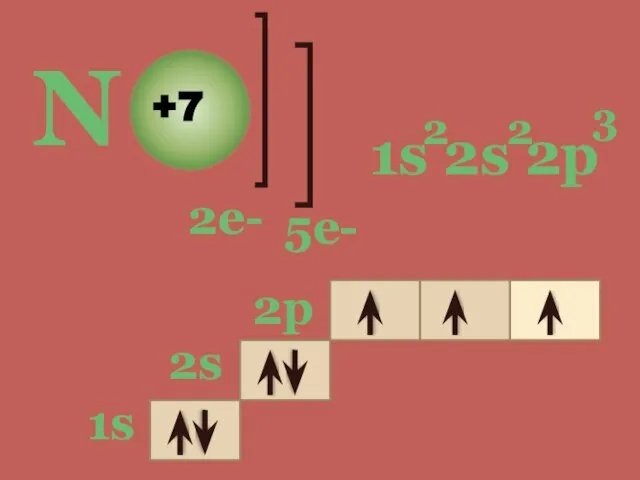
- 4. N +7 2е- 5е- 1s 2s 2p 2 2 3 1s 2s 2p
- 5. Возможные степени окисления 0 +1 +2 +3 +4 +5 -3 N2 N2O3 NO2 N2O5 NH3 NO
- 6. N2 молекулярная формула N N электронная формула структурная формула Ковалентная неполярная связь
- 7. азот - простое вещество , В, Ц, З, М N2 Ткип = - 195 С Тпл
- 8. N2 +6Li = 2Li3N N2 +3H2 ↔ 2NH3+Q Химические свойства аммиак нитрид Fe
- 9. N2 +O2 ↔ 2NO - Q
- 10. получение в лаборатории в промышленности NH4NO2 → N2 + 2H2О t Выделение из сжиженного воздуха
- 11. N2 Жидкий азот в медицине Синтез аммиака Производство удобрений Синтез азотной кислоты Создание инертной среды
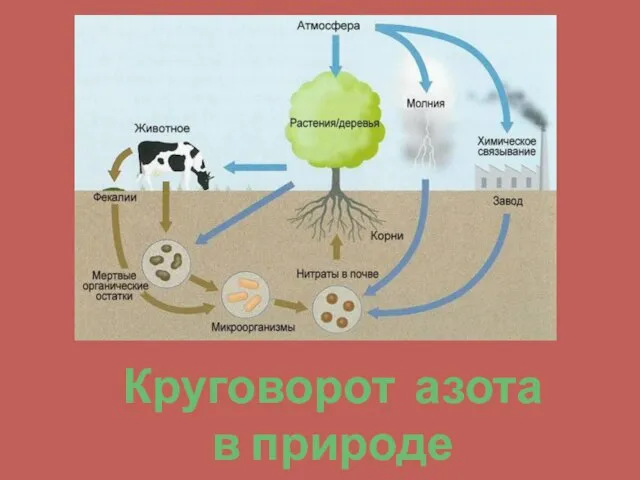
- 12. Круговорот азота в природе
- 13. Тест А1. Сумма протонов, нейтронов, электронов в атоме 14N 1) 7 2) 14 3) 28 4)
- 14. А3. Химическая связь в молекуле азота 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
- 15. А5. Сумма коэффициентов в уравнении реакции между азотом и водородом равна 1) 2 2) 3 4)
- 16. А7. Азот является восстановителем в реакции 1) N2 + 3H2 = 2NH3 2) N2 + O2
- 18. Скачать презентацию












 Презентация на тему Путешествие по Франции (3 класс)
Презентация на тему Путешествие по Франции (3 класс)  Презентация на тему Пётр Первый и его дела (3 класс)
Презентация на тему Пётр Первый и его дела (3 класс)  Презентация на тему Великая отечественная война (4 класс)
Презентация на тему Великая отечественная война (4 класс)  Презентация на тему Для чего нам нужны деревья
Презентация на тему Для чего нам нужны деревья  Презентация на тему Буддизм (4 класс)
Презентация на тему Буддизм (4 класс)  Презентация на тему Стадии развития насекомого (3 класс)
Презентация на тему Стадии развития насекомого (3 класс)  Презентация на тему История русской одежды
Презентация на тему История русской одежды  Презентация на тему Япония (4 класс)
Презентация на тему Япония (4 класс)  Презентация на тему Что мы знаем о своей стране и своём городе
Презентация на тему Что мы знаем о своей стране и своём городе  Презентация на тему Многообразие животных (1 класс)
Презентация на тему Многообразие животных (1 класс)  Презентация на тему Насекомые леса (2 класс)
Презентация на тему Насекомые леса (2 класс)  Презентация на тему История иконы Святителя Николая Чудотворца
Презентация на тему История иконы Святителя Николая Чудотворца  Презентация на тему Природные зоны России (4 класс)
Презентация на тему Природные зоны России (4 класс)  Презентация на тему История жилища
Презентация на тему История жилища  Презентация на тему Правила поведения в магазине
Презентация на тему Правила поведения в магазине  Презентация на тему Весенние изменения в природе (2 класс)
Презентация на тему Весенние изменения в природе (2 класс)  Презентация на тему Пустыня
Презентация на тему Пустыня  Презентация на тему Великие мореплаватели
Презентация на тему Великие мореплаватели  Презентация на тему Расы и народы Земли (4 класс)
Презентация на тему Расы и народы Земли (4 класс)  Презентация на тему Как лечились наши предки (3 класс)
Презентация на тему Как лечились наши предки (3 класс)  Презентация на тему Зачем строят корабли (1 класс)
Презентация на тему Зачем строят корабли (1 класс)  Презентация на тему Все народы воспевают материнство (4 класс)
Презентация на тему Все народы воспевают материнство (4 класс)  Презентация на тему Про воздух и про воду (2 класс)
Презентация на тему Про воздух и про воду (2 класс)  Презентация на тему Система Земля-Луна
Презентация на тему Система Земля-Луна  Презентация на тему Почему на Земле есть жизнь
Презентация на тему Почему на Земле есть жизнь  Презентация на тему Совесть (4 класс)
Презентация на тему Совесть (4 класс)  Презентация на тему Старый Новый год
Презентация на тему Старый Новый год  Презентация на тему Мы едем на море
Презентация на тему Мы едем на море