ФГБУ «НЦ ЭСМП» Минздравсоцразвития РФ Центр экспертизы безопасности лекарственных средств ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ Ле
Содержание
- 2. ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ (англ. – «pharmacovigilance», в России – «фармаконадзор») ОПРЕДЕЛЕНИЯ: Наука и деятельность, направленные на выявление,
- 3. Безопасность ЛС – характеристика ЛС, основанная на сравнительном анализе его эффективности и риска причинения вреда здоровью
- 4. МАСШТАБ ПРОБЛЕМЫ БЕЗОПАСНОСТИ ЛС Осложнения лекарственной терапии (ОЛТ) вошли в первую десятку причин смертности больных, а
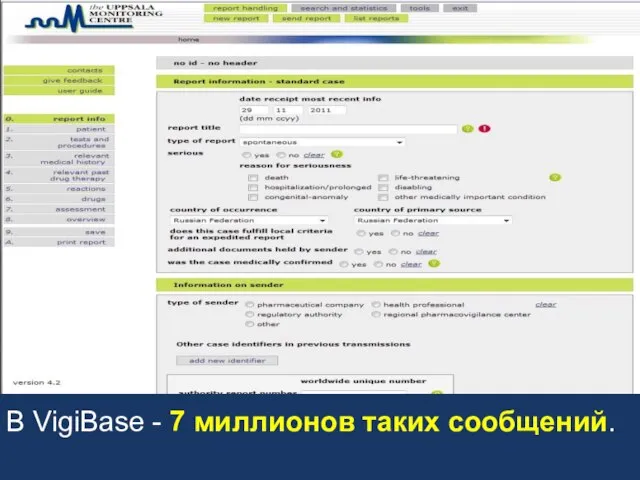
- 5. Более 100 стран (в т.ч. Россия) - участники программы ВОЗ по мониторингу безопасности лекарств. C 1968
- 6. Более 100 стран (в т.ч. Россия) - участники программы ВОЗ по мониторингу безопасности лекарств. C 1968
- 7. США, Япония, и 30 стран ЕЭЗ «Европейской Экономической Зоны» (27 стран-членов Европейского Союза + Исландия +
- 8. США, Япония, и 30 стран ЕЭЗ «Европейской Экономической Зоны» (27 стран-членов Европейского Союза + Исландия +
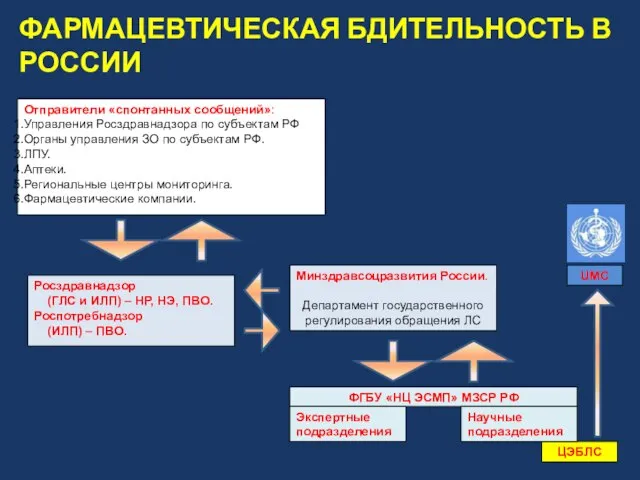
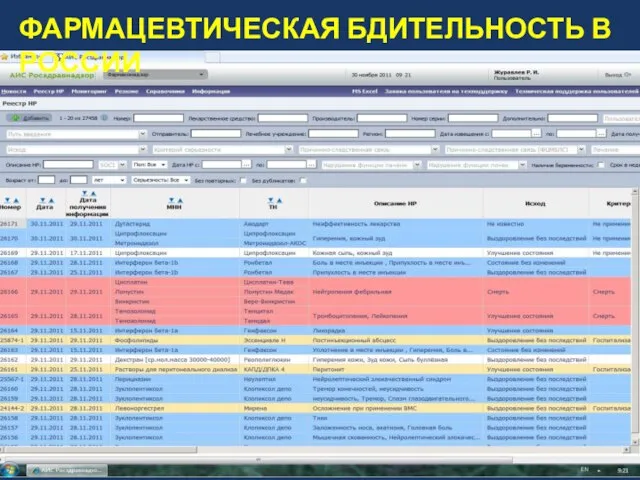
- 9. Росздравнадзор (ГЛС и ИЛП) – НР, НЭ, ПВО. Роспотребнадзор (ИЛП) – ПВО. Отправители «спонтанных сообщений»: Управления
- 10. ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ В РОССИИ
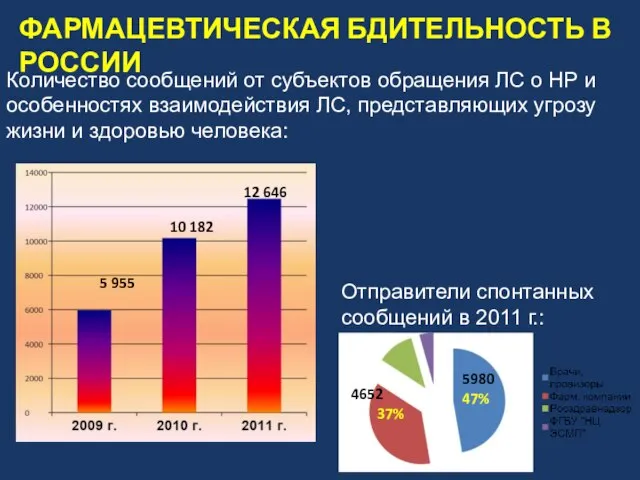
- 11. Количество сообщений от субъектов обращения ЛС о НР и особенностях взаимодействия ЛС, представляющих угрозу жизни и
- 12. Главная проблема - мотивация врачей Некогда Мы НР не встречали Страшно, вдруг накажут?! ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ В
- 13. Наиболее частые НР на ГЛС в 2011 г. Реакции ГНТ – 43% сообщений (антимикробные средства). НР
- 14. ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ В РОССИИ 2011 г. - 134 летальных исходов, предположительно связанных с ЛС, из них
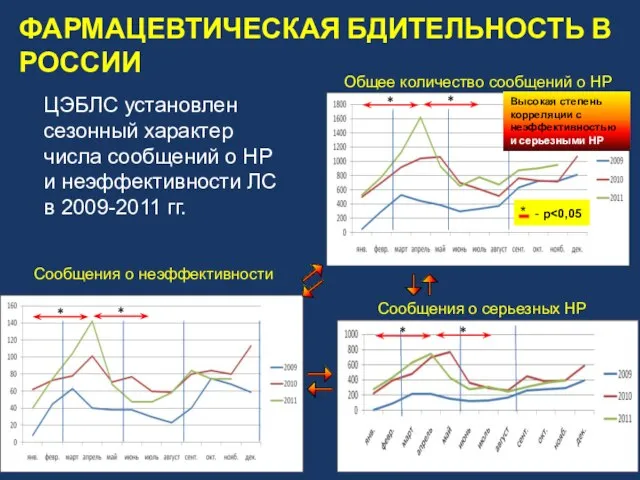
- 15. Общее количество сообщений о НР Сообщения о серьезных НР Сообщения о неэффективности * ЦЭБЛС установлен сезонный
- 16. ФАРМАЦЕВТИЧЕСКАЯ БДИТЕЛЬНОСТЬ В РОССИИ Анализ зарубежной и отечественной информации - 1820 административных решений, 715 статей в
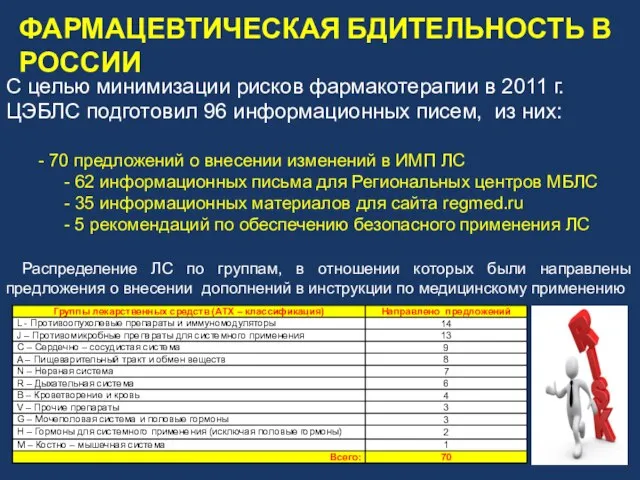
- 17. Распределение ЛС по группам, в отношении которых были направлены предложения о внесении дополнений в инструкции по
- 18. В 2011 г. в ЦЭБЛС подготовлено 3 номера журнала «БЕЗОПАСНОСТЬ ЛЕКАРСТВ И ФАРМАКОНАДЗОР» (8 статей и
- 19. МИБП (ИЛП) и НП в 2011 г. 2011 г. - проведен анализ 1674 сообщений о НР
- 20. В рамках международного сотрудничества - в базу данных ВОЗ (UMC) в 2011 г. передано 495 сообщений
- 21. (в рамках международного сотрудничества) От ВОЗ получен проект практического руководства по оценке эффективности работы Фармаконадзора «Pharmacovigilance
- 23. Скачать презентацию














 Железные дороги России
Железные дороги России Us posters
Us posters Поляков Е.А. Презентация. Психокоррекция
Поляков Е.А. Презентация. Психокоррекция Общие положения. Сигналы на железнодорожном транспорте. Общие положения
Общие положения. Сигналы на железнодорожном транспорте. Общие положения ист мед
ист мед О результатах работы бокса ЦУР Бизнес
О результатах работы бокса ЦУР Бизнес Понятие признаки и виды правоохранительных органов
Понятие признаки и виды правоохранительных органов Презентация на тему Красивые,но смертельно опасные цветы
Презентация на тему Красивые,но смертельно опасные цветы  Ядерный реактор. Принцип работы ядерного реактора
Ядерный реактор. Принцип работы ядерного реактора Старскаясредняяобщеобразовательнаяшкола
Старскаясредняяобщеобразовательнаяшкола Образ сказочной птицы в изобразительном и устном фольклоре
Образ сказочной птицы в изобразительном и устном фольклоре Музеи Санкт-Петербурга
Музеи Санкт-Петербурга Как не болеть в детском саду?Подготовительная группаМБОУ СОШ №35 «Непоседы»
Как не болеть в детском саду?Подготовительная группаМБОУ СОШ №35 «Непоседы» Вещь на уроке изобразительного искусства
Вещь на уроке изобразительного искусства Помоги Маше добраться до клада
Помоги Маше добраться до клада Как выполняли арифметические действия в Древнем Риме?
Как выполняли арифметические действия в Древнем Риме? Презентация на тему Портфолио студента
Презентация на тему Портфолио студента Обществознание
Обществознание изучаем алгоритмы
изучаем алгоритмы Книга рекордов Гиннесса
Книга рекордов Гиннесса Менеджеры в организации
Менеджеры в организации  Средства и методики бизнес-анализа
Средства и методики бизнес-анализа  Алкоголь и его влияние на здоровье человека
Алкоголь и его влияние на здоровье человека Туризм в России: каталог святынь Красногвардейского района Белгородской области
Туризм в России: каталог святынь Красногвардейского района Белгородской области Психоаналитические теории. Питер Блос
Психоаналитические теории. Питер Блос Презентация на тему Контроль за распространением инфекции
Презентация на тему Контроль за распространением инфекции  Игры с дополненной реальностью и вебкам игры
Игры с дополненной реальностью и вебкам игры Вопросы тарифного регулирования в теплоэнергетике и коммунальном комплексе в 2012 – 2013 годах.
Вопросы тарифного регулирования в теплоэнергетике и коммунальном комплексе в 2012 – 2013 годах.