Содержание
- 2. Цель урока
- 3. Содержание
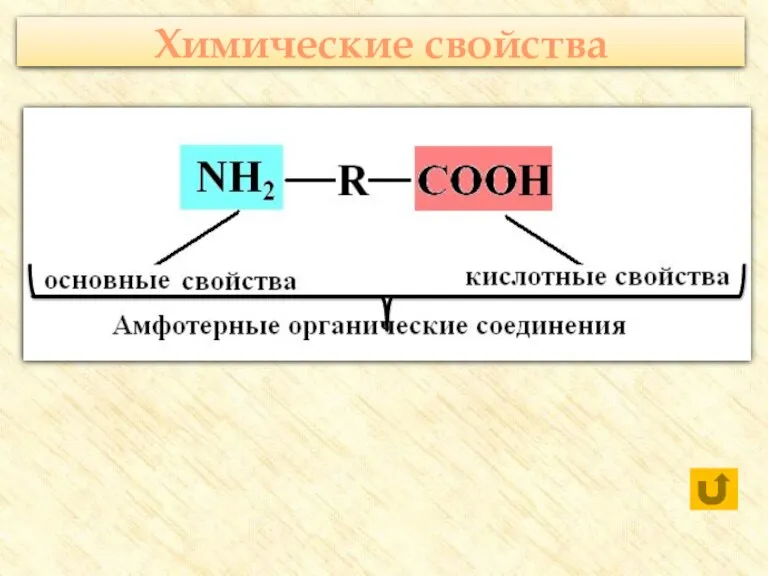
- 4. Определение Аминокислоты – бифункциональные соединения, которые обязательно содержат две функциональные группы: аминогруппу – NH2 и карбоксильную
- 5. Строение Общая формула (NH2)mR(COOH)n, где m и n чаще всего равны 1 или 2. таким образом,
- 6. Классификация По числу функциональных групп: По взаимному расположению карбоксильной и аминогруппы По строению углеводородного радикала Аминокислоты
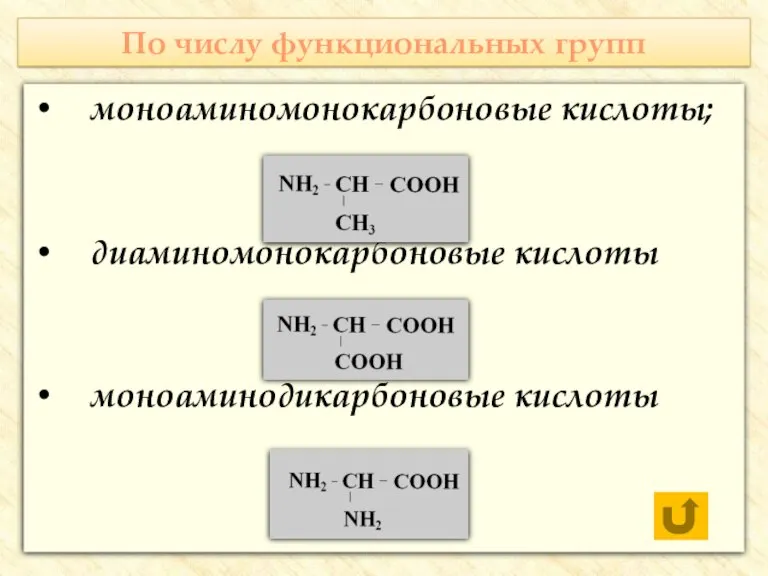
- 7. По числу функциональных групп моноаминомонокарбоновые кислоты; диаминомонокарбоновые кислоты моноаминодикарбоновые кислоты
- 8. По взаимному расположению карбоксильной и аминогруппы α –аминокислоты, β – аминокислоты, γ- аминокислоты, δ – аминокислоты,
- 9. По строению углеводородного радикала Предельные Непредельные Циклические Ароматические
- 10. Аминокислоты делят на: Природные Их около 150, они были обнаружены в живых организмах, около 20 из
- 11. Аминокислоты организма
- 12. Номенклатура Систематическая Рациональная Тривиальное
- 13. Систематическая номенклатура выбрать самую длинную цепь содержащую карбоксильную группу и аминогруппу; пронумеровать начиная с углерода карбоксильной
- 14. Рациональная номенклатура По рациональной номенклатуре положение аминогруппы указывается буквами греческого алфавита, начиная со второго атома углерода
- 15. Тривиальные названия Многие аминокислоты имеют тривиальные названия, например: Аланин
- 16. Изомерия Изомерия углеродного скелета; Изомерия положения функциональных групп; Межклассовая изомерия с нитросоединениями; Оптическая изомерия;
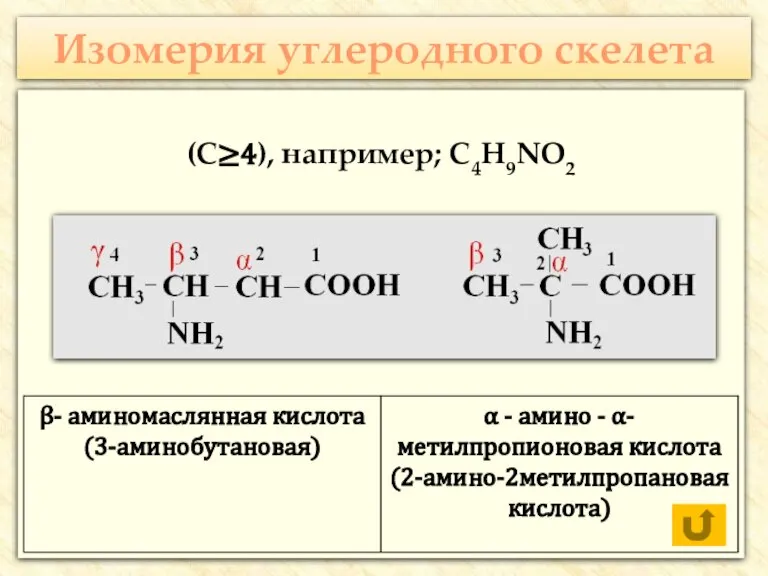
- 17. Изомерия углеродного скелета (С≥4), например; С4H9NO2
- 18. Изомерия положения функциональных групп (С≥3), например; С3H7NO2
- 19. Межклассовая с нитросоединениями (С≥2), например; С3H7NO2
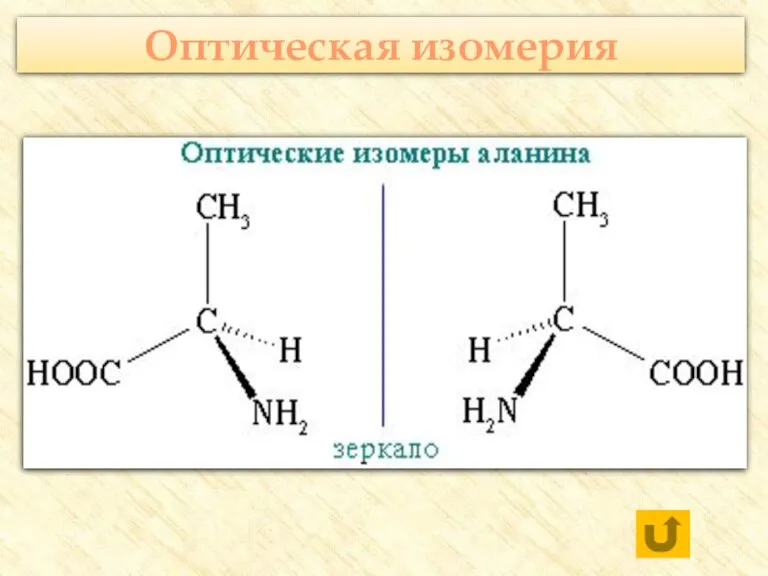
- 20. Оптическая изомерия
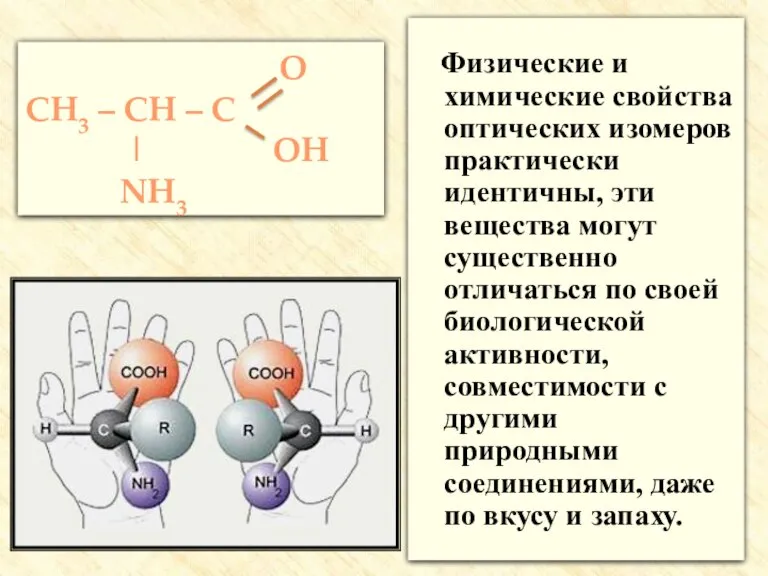
- 21. Физические и химические свойства оптических изомеров практически идентичны, эти вещества могут существенно отличаться по своей биологической
- 22. Физические свойства Аминокислоты – бесцветные кристаллические вещества с высокими температурами плавления. Плавятся с разложением, нелетучие. Хорошо
- 23. Химические свойства
- 24. Реакции с участием карбоксильной группы С активными металлами Оксидами металлов Гидроксидами металлов С солями слабых летучих
- 25. 1. Mg + 2NH2 – CH2 – COOH → (NH2 – CH2 – COO)2Mg + H2
- 26. Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-
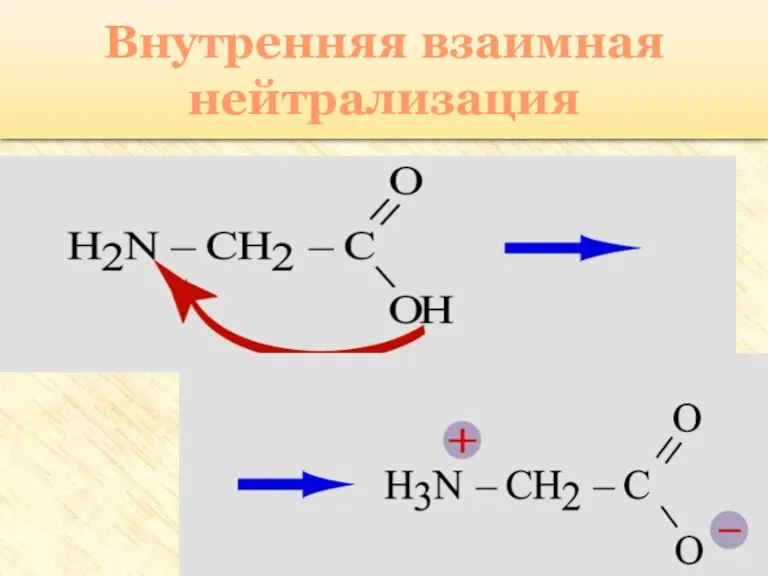
- 27. Особые свойства аминокислот Образование внутренней соли при диссоциации NH2 – CH2 – COOH ⇄ +NH3 –
- 28. Внутренняя взаимная нейтрализация
- 30. Особые свойства аминокислот 3. Декарбоксилирование : NH2 – CH2 – CH2 – COOH → NH2 –
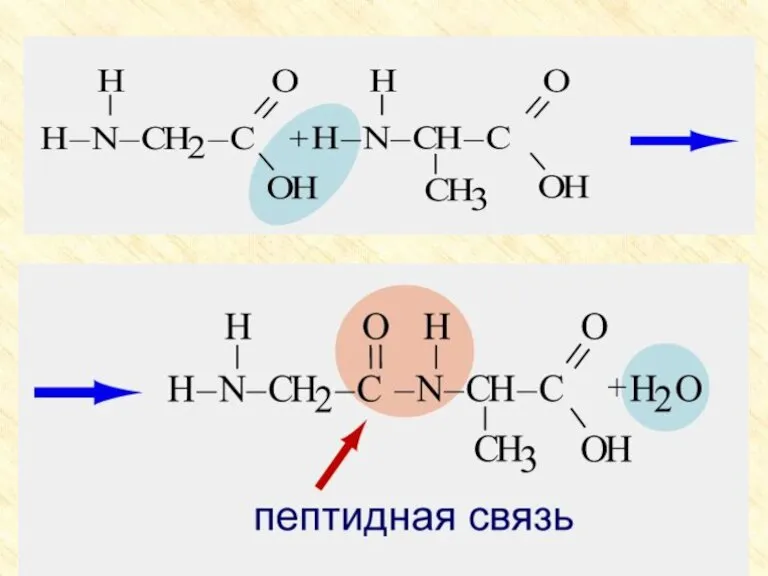
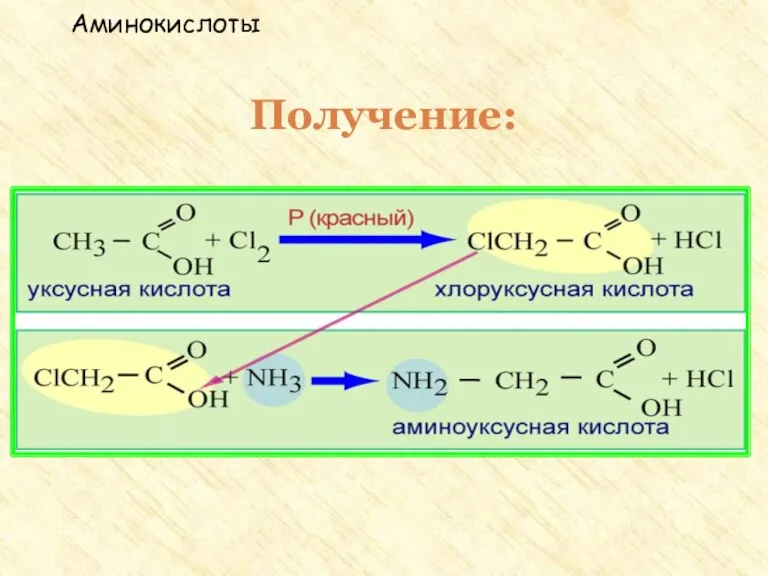
- 31. Получение аминокислот Гидролиз белков под влиянием ферментов, кислот или щелочей. Действие аммиака на хлорзамещенные органические кислоты:
- 32. Получение: 1. Гидролиз белков. Белок – полимер под действием воды распадается на мономеры - аминокислоты Аминокислоты
- 33. Применение аминокислот
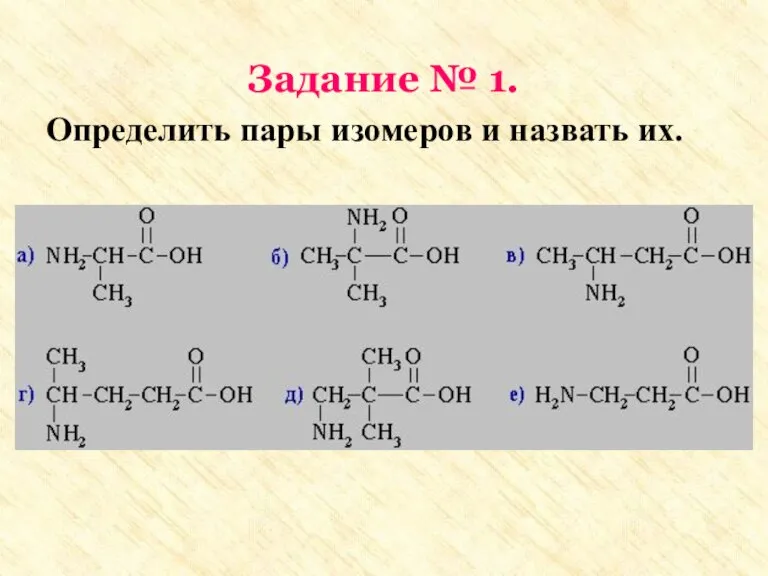
- 34. Задание № 1. Определить пары изомеров и назвать их.
- 35. Задача. Определите формулу аминокислоты, если массовые доли углерода, водорода, кислорода и азота соответственно равны: 48%, 9,34%,
- 37. Скачать презентацию



















![Реакции с участием аминогруппы Взаимодействуют с кислотами: H2N–CH2–COOH + HCl → [H3N+–CH2–COOH] Cl-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/336369/slide-25.jpg)





 Боевые традиции вооружённых сил России
Боевые традиции вооружённых сил России Рекомендации по подготовке доклада
Рекомендации по подготовке доклада Тайны русского слова
Тайны русского слова Лингвистический компонент обучения: спектр возможностей по обновлению содержания образования
Лингвистический компонент обучения: спектр возможностей по обновлению содержания образования Мисс Гуманитарный Институт 2020. Конкурс красоты, таланта и ума
Мисс Гуманитарный Институт 2020. Конкурс красоты, таланта и ума Основные рекомендации к разработке и проведению здоровьесберегающего урока
Основные рекомендации к разработке и проведению здоровьесберегающего урока Воспитательная программа «Любознайки»
Воспитательная программа «Любознайки» Традиции празднования Рождества в США
Традиции празднования Рождества в США pervaya_mirovaya_voyna_-_oruzhie
pervaya_mirovaya_voyna_-_oruzhie Презентация на тему Интересные факты о пресмыкающихся
Презентация на тему Интересные факты о пресмыкающихся  Зона рецепшена. Минималистичный легкий стул
Зона рецепшена. Минималистичный легкий стул Обращение в кризисный центр женщинам
Обращение в кризисный центр женщинам Агентство рекламы полного циклаРАНДАР
Агентство рекламы полного циклаРАНДАР Электромобиль - машина будущего или уже реальность
Электромобиль - машина будущего или уже реальность Третьяковская галерея (3 класс)
Третьяковская галерея (3 класс) C:\Documents and Settings\Администратор\Рабочий стол\Рисунок1.pngВелика Россия, а отступать некуда: позади- Москва!
C:\Documents and Settings\Администратор\Рабочий стол\Рисунок1.pngВелика Россия, а отступать некуда: позади- Москва! Система управления ключевыми показателями эффективности в энергосбытовых компаниях
Система управления ключевыми показателями эффективности в энергосбытовых компаниях Природа. Фото
Природа. Фото Смена по предпринимательству
Смена по предпринимательству Порушка-Пораня
Порушка-Пораня Объемы тел
Объемы тел Латвийская Советская Социалистическая Республика
Латвийская Советская Социалистическая Республика Творческий проект Декоративное панно «Весна-красна на землю пришла» Кружевоплетение
Творческий проект Декоративное панно «Весна-красна на землю пришла» Кружевоплетение Рекорды планеты
Рекорды планеты Образ лирической героини в поэтическом цикле А. Блока «Кармен»
Образ лирической героини в поэтическом цикле А. Блока «Кармен» Этот многоликий стресс
Этот многоликий стресс Bientôt les vacances, venez visiter Paris
Bientôt les vacances, venez visiter Paris Музей воды в Киеве
Музей воды в Киеве