Содержание
- 2. Цинк – это… …элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических элементов Д. И.
- 3. История Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем Египте,
- 4. Происхождение названия Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл словом «zincum» или
- 5. Нахождение в природе Известно 66 минералов цинка, в частности цинкит , сфалерит, виллемит, каламин, смитсонит, франклинит.
- 6. Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его несколько больше (1,3·10-2%),
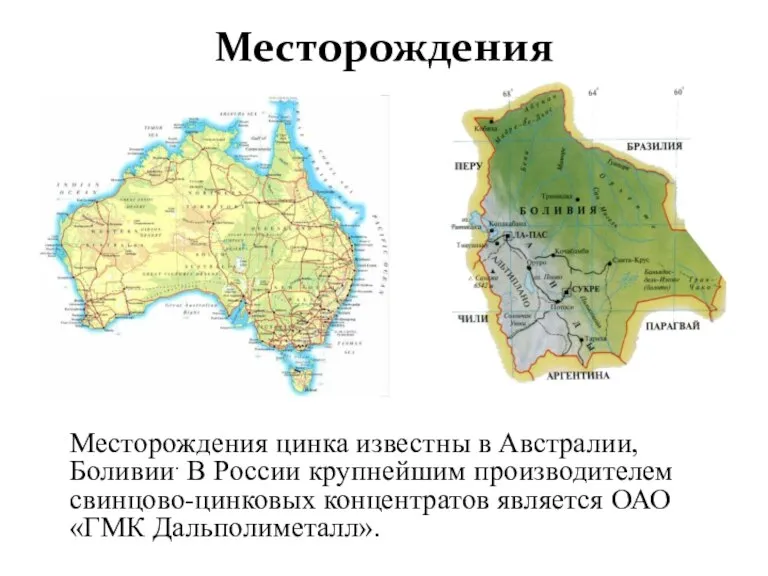
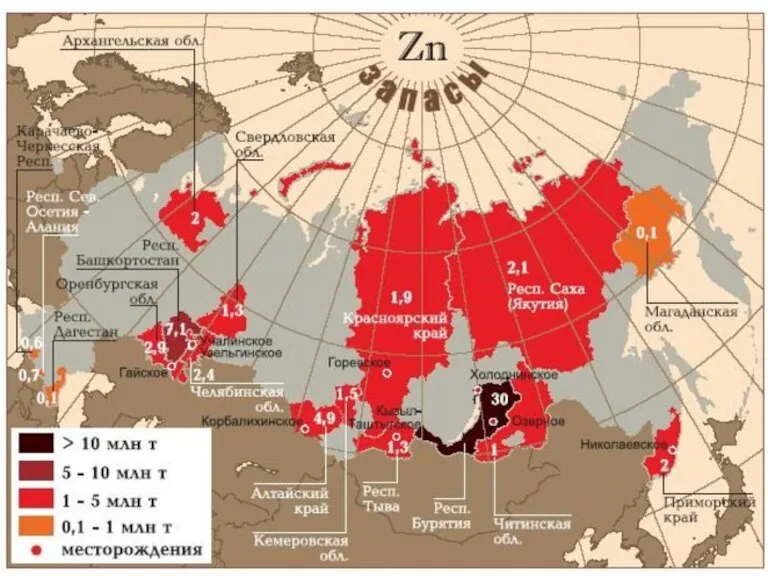
- 7. Месторождения Месторождения цинка известны в Австралии, Боливии. В России крупнейшим производителем свинцово-цинковых концентратов является ОАО «ГМК
- 9. Получение Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических руд, содержащих 1-4
- 10. Физические свойства В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с параметрами а
- 11. Химические свойства Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO и Zn(OH)2. Стандартный
- 12. Применение Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото, серебро). Кроме того,
- 14. Скачать презентацию
Слайд 2Цинк – это…
…элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических
Цинк – это…
…элемент побочной подгруппы второй группы, четвёртого периода периодической системы химических

Слайд 3История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем
История
Сплав цинка с медью — латунь — был известен ещё в Древней Греции, Древнем

Слайд 4Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл
Происхождение названия
Слово «цинк» впервые встречается в трудах Парацельса, который назвал этот металл

Слайд 5Нахождение в природе
Известно 66 минералов цинка, в частности цинкит , сфалерит, виллемит,
Нахождение в природе
Известно 66 минералов цинка, в частности цинкит , сфалерит, виллемит,

Слайд 6 Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его
Среднее содержание цинка в земной коре — 8,3·10-3%, в основных извержённых породах его

Цинк — важный биогенный элемент, в живых организмах содержится в среднем 5·10-4% цинка. Но есть и исключения — так называемые организмы-концентраторы (например, некоторые фиалки).
Слайд 7Месторождения
Месторождения цинка известны в Австралии, Боливии. В России крупнейшим производителем свинцово-цинковых концентратов
Месторождения
Месторождения цинка известны в Австралии, Боливии. В России крупнейшим производителем свинцово-цинковых концентратов
Слайд 9Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических
Получение
Цинк в природе как самородный металл не встречается. Цинк добывают из полиметаллических
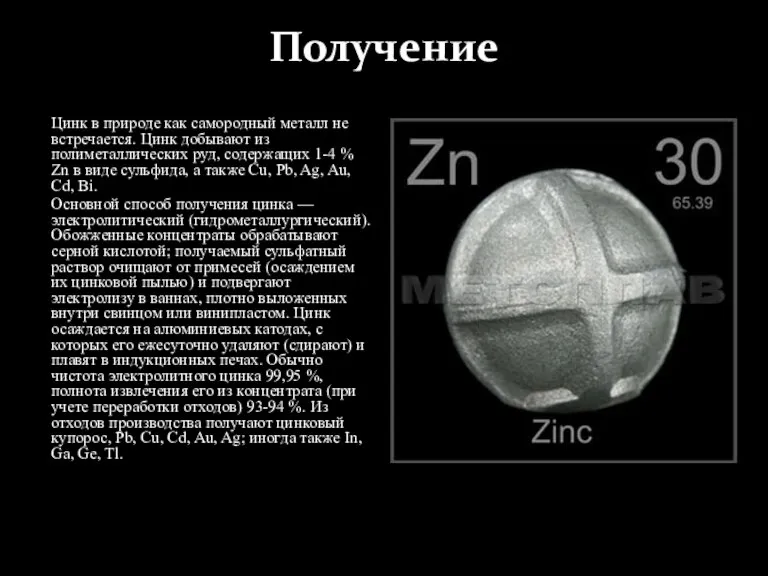
Основной способ получения цинка — электролитический (гидрометаллургический). Обожженные концентраты обрабатывают серной кислотой; получаемый сульфатный раствор очищают от примесей (осаждением их цинковой пылью) и подвергают электролизу в ваннах, плотно выложенных внутри свинцом или винипластом. Цинк осаждается на алюминиевых катодах, с которых его ежесуточно удаляют (сдирают) и плавят в индукционных печах. Обычно чистота электролитного цинка 99,95 %, полнота извлечения его из концентрата (при учете переработки отходов) 93-94 %. Из отходов производства получают цинковый купорос, Pb, Cu, Cd, Au, Ag; иногда также In, Ga, Ge, Tl.
Слайд 10Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с
Физические свойства
В чистом виде — довольно пластичный серебристо-белый металл. Обладает гексагональной решеткой с

Слайд 11Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO
Химические свойства
Типичный пример металла, образующего амфотерные соединения. Амфотерными являются соединения цинка ZnO

На воздухе цинк покрывается тонкой пленкой оксида ZnO. При сильном нагревании сгорает с образованием амфотерного белого оксида ZnO:
Оксид цинка реагирует как с растворами кислот:
так и щелочами:
Цинк обычной чистоты активно реагирует с растворами кислот:
и растворами щелочей:
образуя гидроксоцинкаты. С растворами кислот и щелочей очень чистый цинк не реагирует. Взаимодействие начинается при добавлении нескольких капель раствора сульфата меди CuSO4.
При нагревании цинк реагирует с галогенами с образованием галогенидов ZnHal2. С фосфором цинк образует фосфиды Zn3P2 и ZnP2. С серой и её аналогами — селеном и теллуром — различные халькогениды, ZnS, ZnSe, ZnSe2 и ZnTe.
С водородом, азотом, углеродом, кремнием и бором цинк непосредственно не реагирует. Нитрид Zn3N2 получают реакцией цинка с аммиаком при 550—600 °C.
В водных растворах ионы цинка Zn2+ образуют аквакомплексы [Zn(H2O)4]2+ и [Zn(H2O)6]2+
Слайд 12Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото,
Применение
Чистый металлический цинк используется для восстановления благородных металлов, добываемых подземным выщелачиванием (золото,

Применяется для защиты стали от коррозии (оцинковка поверхностей, не подверженных механическим воздействиям, или металлизация — для мостов, емкостей, металлоконструкций).
Цинк используется в качестве материала для отрицательного электрода в химических источниках тока, то есть в батарейках и аккумуляторах, например: марганцево-цинковый элемент, серебряно-цинковый аккумулятор (ЭДС 1,85 В, 150 Вт·ч/кг, 650 Вт·ч/дм³, малое сопротивление и колоссальные разрядные токи), ртутно-цинковый элемент (ЭДС 1,35 В, 135 Вт·ч/кг, 550—650 Вт·ч/дм³), диоксисульфатно-ртутный элемент, йодатно-цинковый элемент, медно-окисный гальванический элемент (ЭДС 0,7—1,6 Вольт, 84—127 Вт·ч/кг, 410—570 Вт·ч/дм³), хром-цинковый элемент, цинк-хлоросеребряный элемент, никель-цинковый аккумулятор (ЭДС 1,82 Вольт, 95—118 Вт·ч/кг, 230—295 Вт·ч/дм³), свинцово-цинковый элемент, цинк-хлорный аккумулятор, цинк-бромный аккумулятор и др.
Очень важна роль цинка в цинк-воздушных аккумуляторах, которые отличаются весьма высокой удельной энергоёмкостью. Они перспективны для пуска двигателей (свинцовый аккумулятор — 55 Вт·ч/кг, цинк-воздух — 220—300 Вт·ч/кг) и для электромобилей (пробег до 900 км).
 Строение и функции мышц
Строение и функции мышц Конференция для родителей будущих первоклассников.
Конференция для родителей будущих первоклассников. Целеполагание, планирование
Целеполагание, планирование Применение специальных условных знаков при оформлении графической части технического плана
Применение специальных условных знаков при оформлении графической части технического плана Презентация на тему Маяковский биография
Презентация на тему Маяковский биография Государственные символы Российской Федерации и Москвы(исследовательская и творческая работа)
Государственные символы Российской Федерации и Москвы(исследовательская и творческая работа) Экскурсия по магазинам города Псков
Экскурсия по магазинам города Псков ПРОЕКТ«Время выбрало нас»
ПРОЕКТ«Время выбрало нас» Работа с одаренными детьми сквозь призму интересов государства
Работа с одаренными детьми сквозь призму интересов государства Нормативные акты и законотворческий процесс в РФ
Нормативные акты и законотворческий процесс в РФ Демонстрационная лабораторная работа
Демонстрационная лабораторная работа Презентация Снижение Цены (3)
Презентация Снижение Цены (3) Виды жилых помещений (5 класс)
Виды жилых помещений (5 класс) Использование коми-орнамента в изделиях из валяной шерсти
Использование коми-орнамента в изделиях из валяной шерсти Орфоэпия
Орфоэпия Презентация на тему Устройство и действие гранатометов и ручных гранат
Презентация на тему Устройство и действие гранатометов и ручных гранат  Школа вновь зовет в дорогу…
Школа вновь зовет в дорогу… Любохонская средняя общеобразовательная школа имени дважды Героя Советского Союза А.А. Головачева
Любохонская средняя общеобразовательная школа имени дважды Героя Советского Союза А.А. Головачева Число День недели Событие Участие 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 План событий на месяц _______________.
Число День недели Событие Участие 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 План событий на месяц _______________. Изготовление розы из бересты
Изготовление розы из бересты Сводка и группировкастатистическихданных
Сводка и группировкастатистическихданных Новый год в картинах художников
Новый год в картинах художников Уважаемые Руководители предприятий! Главные инженеры! Главные энергетики! Уделив несколько минут этой презентации, Вы сможете у
Уважаемые Руководители предприятий! Главные инженеры! Главные энергетики! Уделив несколько минут этой презентации, Вы сможете у Основные направления византийского стиля живописи
Основные направления византийского стиля живописи Конечные и бесконечные множества (домашняя)
Конечные и бесконечные множества (домашняя) Семейные факторы формирования отклоняющегося поведения
Семейные факторы формирования отклоняющегося поведения Карьерный рост в обучающей системе. Альянс Лидеров
Карьерный рост в обучающей системе. Альянс Лидеров Техника FBC
Техника FBC