Содержание
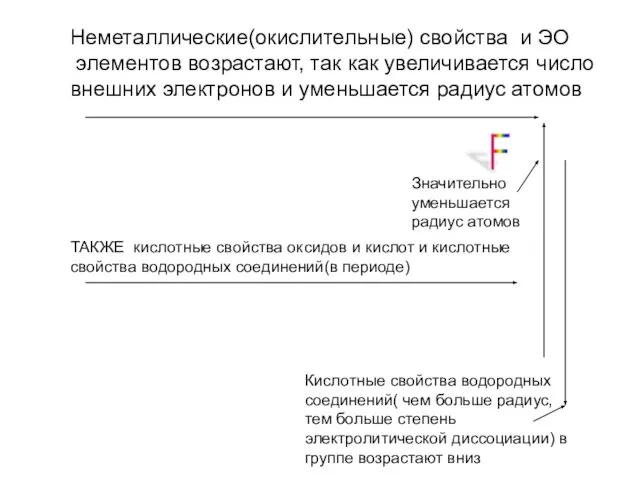
- 2. Неметаллические(окислительные) свойства и ЭО элементов возрастают, так как увеличивается число внешних электронов и уменьшается радиус атомов
- 3. Металлические(восстановительные) свойства элементов возрастают, так как уменьшается число внешних электронов и увеличивается радиус атомов Значительно увеличивается
- 4. A 1 Одинаковое число электронов содержат частицы 1) Al и N 2) Ca и Cl 3)
- 5. A 2 В ряду элементов Na Mg Al Si 1) уменьшаются радиусы атомов 2) уменьшается число
- 6. A 3 Верны ли следующие суждения о соединениях металлов? А. Степень окисления бериллия в высшем оксиде
- 7. А 1Элемент проявляет в соединениях высшую степень окисления +6. Конфигурация валентных электронов элемента 1) 2s2 2p4
- 8. A2 В ряду химических элементов Si – P – S увеличиваются кислотные свойства высшего гидроксида 2)
- 9. Электронная конфигурация соответствует иону Mg S Al N 1s2 2s2 2p6 3s2 3p6 2+ 2- 3-
- 10. A2 В каком ряду химические элементы расположены в порядке возрастания их атомного радиуса? Li, Be, B,
- 11. A2 Свойства оксидов в ряду Al2O3 → SiO2 → P2O5 изменяются 1) от амфотерных к кислотным
- 12. A1 Заряд ядра атома равен числу 1) протонов 2) электронов во внешнем электронном слое 3) нейтронов
- 13. Радиус атомов увеличивается в ряду элементов: K, Na, Li Na, Mg, Al Be, Ca, Mg 4.
- 14. В ряду химических элементов Al----Si---- P Возрастают кислотные свойства образуемых гидроксидов 2)Увеличивается число электронных уровней 3)Уменьшается
- 16. Скачать презентацию












 Новейшие технологии, средства защиты и очистки атмосферного воздуха от выбросов газа.
Новейшие технологии, средства защиты и очистки атмосферного воздуха от выбросов газа. Title
Title  Портрет. Жанры ИЗО. 3 класс
Портрет. Жанры ИЗО. 3 класс МЕРОПРИЯТИЯ ПРОЕКТА «ШКОЛЬНАЯ СПОРТИВНАЯ ЛИГА» ПРОВЕСТИ В КАЖДОЙ ШКОЛЕ Л.Э. Исаева.
МЕРОПРИЯТИЯ ПРОЕКТА «ШКОЛЬНАЯ СПОРТИВНАЯ ЛИГА» ПРОВЕСТИ В КАЖДОЙ ШКОЛЕ Л.Э. Исаева. Панькина Наталья Михеевна
Панькина Наталья Михеевна Моё хобби
Моё хобби Встреча со Святыней. Сияние Афона
Встреча со Святыней. Сияние Афона Курс: «Социальные коммуникации»
Курс: «Социальные коммуникации» Tuborg НАЦИОНАЛЬНОЕ ПРОМО 2011
Tuborg НАЦИОНАЛЬНОЕ ПРОМО 2011 Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс) Александр Александрович Дейнека, картина Оборона Севастополя
Александр Александрович Дейнека, картина Оборона Севастополя Шаги для достижения цели
Шаги для достижения цели Инновационная система и политика в РФ
Инновационная система и политика в РФ Презентация на тему Деньги, кредит, банки
Презентация на тему Деньги, кредит, банки  ДИСФОР (ДИалог на языке Структурных ФОРмул)
ДИСФОР (ДИалог на языке Структурных ФОРмул) Организация работы кассовых центровОпыт ОАО «Сбербанк России»
Организация работы кассовых центровОпыт ОАО «Сбербанк России» Презентация на тему Генеалогический метод исследования
Презентация на тему Генеалогический метод исследования  Презентация на тему Организационная структура ФТС России
Презентация на тему Организационная структура ФТС России  Теоретические основы регулирования инвестиционной деятельности в россии. Лекция 1
Теоретические основы регулирования инвестиционной деятельности в россии. Лекция 1 Титан Инжиниринг - проектирование, разработка и строительство энергообъектов. Возможности сотрудничества молодых специалистов
Титан Инжиниринг - проектирование, разработка и строительство энергообъектов. Возможности сотрудничества молодых специалистов Особенности сопровождения детей из различных групп риска
Особенности сопровождения детей из различных групп риска Итоги районной и областной астрономической олимпиады
Итоги районной и областной астрономической олимпиады Экзерсис на середине зала (балет)
Экзерсис на середине зала (балет) И.А. Башмаков Центр по эффективному использованию энергии
И.А. Башмаков Центр по эффективному использованию энергии Бизнес план парикмахерской Лиана
Бизнес план парикмахерской Лиана Оренбургский пуховый платок
Оренбургский пуховый платок Otchet_po_praktike_Serdyukova_A
Otchet_po_praktike_Serdyukova_A Учреждение образования «Белорусский государственный университет физической культуры»
Учреждение образования «Белорусский государственный университет физической культуры»