Содержание
- 2. ОГЛАВЛЕНИЕ 11.1. Электролитическая диссоциация 11.2. Проводимость электролитов 11.3. Законы Фарадея для электролиза 11.4. Определение заряда иона
- 3. 11.1. Электролитическая диссоциация Электролиз обязан своему существованию явлению электролитической диссоциации. Электролитическая диссоциация — явление распада нейтральных
- 4. 11.2. Проводимость электролитов Рассмотрим протекание электрического тока через раствор электролита. На примере В водном растворе диссоциирует
- 5. Плотность тока можно представить как Физические величины называются подвижностью ионов, это физическая величина численно равная скорости
- 6. 11.3. Законы Фарадея для электролиза. Для электролиза были получены экспериментально законы, которые открыл Майкл Фарадей. Первый
- 7. 11.4. Определение заряда иона. Пусть заряд иона q1 и масса иона m1, на электроде выделяется вещество
- 8. 11.5. Техническое применение электролиза В металлургической промышленности электролизом из расплавленных соединений и водных растворов получают металлы,
- 9. Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда – концентрат – подвергается обработке
- 10. Металлические примеси, содержащиеся в полученной (черновой) меди, можно разделить на две группы. Fe, Zn, Ni, Co.
- 12. Скачать презентацию
Слайд 2ОГЛАВЛЕНИЕ
11.1. Электролитическая диссоциация
11.2. Проводимость электролитов
11.3. Законы Фарадея для электролиза
11.4. Определение заряда иона
11.5.
ОГЛАВЛЕНИЕ
11.1. Электролитическая диссоциация
11.2. Проводимость электролитов
11.3. Законы Фарадея для электролиза
11.4. Определение заряда иона
11.5.

Слайд 311.1. Электролитическая диссоциация
Электролиз обязан своему существованию явлению электролитической диссоциации. Электролитическая диссоциация
11.1. Электролитическая диссоциация
Электролиз обязан своему существованию явлению электролитической диссоциации. Электролитическая диссоциация
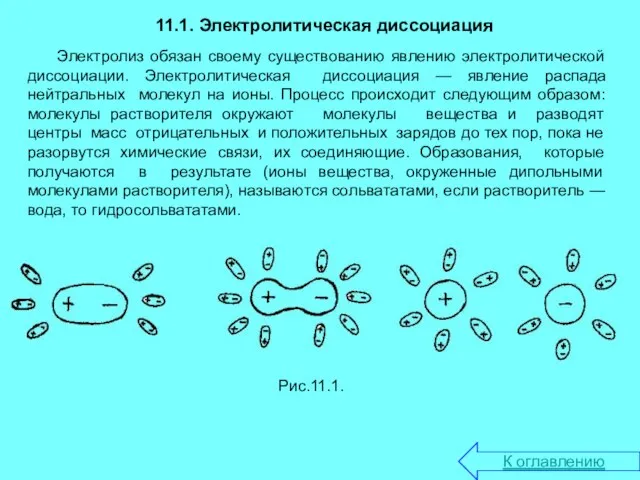
Рис.11.1.
К оглавлению
Слайд 411.2. Проводимость электролитов
Рассмотрим протекание электрического тока через раствор электролита. На примере
В
11.2. Проводимость электролитов
Рассмотрим протекание электрического тока через раствор электролита. На примере
В
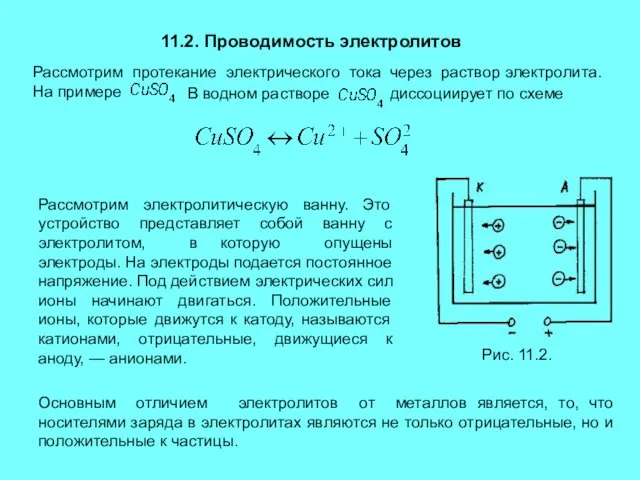
диссоциирует по схеме
Рассмотрим электролитическую ванну. Это устройство представляет собой ванну с электролитом, в которую опущены электроды. На электроды подается постоянное напряжение. Под действием электрических сил ионы начинают двигаться. Положительные ионы, которые движутся к катоду, называются катионами, отрицательные, движущиеся к аноду, — анионами.
Рис. 11.2.
Основным отличием электролитов от металлов является, то, что носителями заряда в электролитах являются не только отрицательные, но и положительные к частицы.
Слайд 5Плотность тока можно представить как
Физические величины называются подвижностью ионов, это физическая величина
Плотность тока можно представить как
Физические величины называются подвижностью ионов, это физическая величина

К оглавлению
(11.1)
(11.2)
Слайд 611.3. Законы Фарадея для электролиза.
Для электролиза были получены экспериментально законы,
11.3. Законы Фарадея для электролиза.
Для электролиза были получены экспериментально законы,

Первый закон Фарадея гласит, что масса вещества, выделяемая на электродах, прямопропорциональна заряду, протекающему через электролит.
Электрохимический эквивалент — физическая величина, численно равная массе вещества, выделившегося на электродах при пропускании единичного заряда через электролит.
2.Второй закон Фарадея гласит, что электрохимический эквивалент вещества, прямо пропорционален его химическому эквиваленту, т. е.
химический эквивалент вещества,
А – атомная (молярная) масса, F=96500 Кл/моль – число Фарадея.
Объединяя I и II законы Фарадея, можно записать
К оглавлению
(11.3)
(11.4)
(11.5)
-где k электрохимический эквивалент вещества.
Слайд 711.4. Определение заряда иона.
Пусть заряд иона q1 и масса иона m1, на
11.4. Определение заряда иона.
Пусть заряд иона q1 и масса иона m1, на

(11.6)
ν – число ионов.
Через электролит проходит заряд, равный
Подставим (11.7) в (11.1), получим
Согласуя данное выражение со вторым законом Фарадея, видим, что отношение m1/q1 равно электрохимическому эквиваленту. Умножим числитель и знаменатель данного выражения на постоянную Авогадро.
Получаем
Заряд иона
К оглавлению
(11.7)
Слайд 811.5. Техническое применение электролиза
В металлургической промышленности электролизом из расплавленных соединений и
11.5. Техническое применение электролиза
В металлургической промышленности электролизом из расплавленных соединений и

Электролизом расплавов получают металлы, имеющие сильно отрицательные электродные потенциалы, и некоторые их сплавы.
При высокой температуре электролит и продукты электролиза могут вступать во взаимодействие друг с другом, с воздухом, а также материалами электродов и электролизера. В результате этого простая, в принципе, схема электролиза (например, электролиз MgCl2 при получении магния) усложняется.
Электролитом обычно служат не индивидуально расплавленные соединения, а их смеси. Важнейшим преимуществом смесей является их относительная легкоплавкость, позволяющая проводить электролиз при более низкой температуре.
В настоящее время электролизом расплавов получают алюминий, магний, натрий, литий и кальций. Для получения калия, бария, рубидия и цезия электролиз расплавов практически не применяется из-за высокой химической активности этих металлов и большой их растворимости в расплавленных солях. В последние годы электролиз расплавленных сред начинает приобретать значение для получения некоторых тугоплавких металлов.
Слайд 9 Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда
Электролитическое выделение металла из раствора называется электроэкстракцией. Руда или обогащенная руда

Электролитическому рафинированию металлы подвергаются для удаления из них примесей и для перевода содержащихся в них компонентов в удобные для переработки продукты. Из металла, подлежащего очистке, отливают пластины и помещают их в качестве анодов в электролизер. При прохождении тока металл подвергается анодному растворению, переходя в виде катионов в раствор. Далее катионы металла разряжаются на катоде, образуя компактный осадок чистого металла. Содержащиеся в аноде примеси либо остаются нерастворенными, выпадая в виде анодного шлама, либо переходят в электролит, откуда периодически или непрерывно удаляются.
Рассмотрим в качестве примера электрорафинирование меди, основным компонентом раствора служит сульфат меди – наиболее распространенная и дешевая соль этого металла. Но раствор CuSO4 обладает низкой электролитической проводимостью. Для ее увеличения в электролит добавляют серную кислоту. Кроме того, вводят небольшие количества добавок, способствующих получению более компактного осадка металла.
Слайд 10 Металлические примеси, содержащиеся в полученной (черновой) меди, можно разделить на две
Металлические примеси, содержащиеся в полученной (черновой) меди, можно разделить на две

Fe, Zn, Ni, Co. Эти металлы имеют значительно более отрицательные электродные потенциалы, чем медь. Поэтому они анодно растворяются вместе с медью, но не осаждаются на катоде, а накапливаются в электролите. В связи с этим электролит периодически подвергается очистке.
Au, Ag, Pb, Sn. Благородные металлы (Au, Ag) не претерпевают анодного растворения, а в ходе процесса оседают у анода, образуя вместе с другими примесями анодный хлам, который периодически извлекается. Олово же и свинец растворяются вместе с медью, но в электролите образуют малорастворимые соединения, выпадающие в осадок и также удаляемые.
Электролитическому рафинированию подвергают медь, никель, свинец, олово, серебро, золото.
К гавальнотехнике относятся гальваностегия и гальванопластика. Процессы гальваностегии представляют собой нанесение путем электролиза на поверхность металлических изделий слоев других металлов для предохранения этих изделий от коррозии, для придания их поверхности твердости, а также в декоративных целях. Из многочисленных применяемых в технике гальванотехнических процессов важнейшими являются хромирование, цинкование и никелирование.
 Стипендия Правительства области
Стипендия Правительства области المالية االستدامة المالية
المالية االستدامة المالية Объемы перевозок по городской маршрутной сети
Объемы перевозок по городской маршрутной сети День инвалида
День инвалида Презентация на тему Интернет и его возможности
Презентация на тему Интернет и его возможности Extenzionálne modely. Algebraická teória. Transformácie intervalov. Definícia funkcie Glob. (Téma 5)
Extenzionálne modely. Algebraická teória. Transformácie intervalov. Definícia funkcie Glob. (Téma 5) Культура Древней Греции
Культура Древней Греции Штриховая гладь
Штриховая гладь Профессия Повар-кондитер
Профессия Повар-кондитер Организационное стимулирование. Условия для внедрения мотивации персонала
Организационное стимулирование. Условия для внедрения мотивации персонала Что такое бенилюкс?
Что такое бенилюкс? Презентация на тему Здоровьесберегающие технологии на уроках в начальной школе. Окружающий мир 3 класс
Презентация на тему Здоровьесберегающие технологии на уроках в начальной школе. Окружающий мир 3 класс  FOOD SAFETY
FOOD SAFETY  Ассирия
Ассирия Презентация на тему Кометы и метеоры
Презентация на тему Кометы и метеоры Руководство Ernst&Young по составления бизнес-планов
Руководство Ernst&Young по составления бизнес-планов Куклы из махровых носков
Куклы из махровых носков Конституционные суды Приволжского Федерального округа
Конституционные суды Приволжского Федерального округа Японская каллиграфия - диалог культур Токио - Красноярск
Японская каллиграфия - диалог культур Токио - Красноярск «Пилот»: Маркетинг в компании
«Пилот»: Маркетинг в компании Устный журнал. В мире имён и названий
Устный журнал. В мире имён и названий Баскетбол. Тест по физической культуре
Баскетбол. Тест по физической культуре Материаловедение 5-6р
Материаловедение 5-6р Применение приборов серии IVS для решения задач вибродиагностики
Применение приборов серии IVS для решения задач вибродиагностики Композиционное решение для предприятий автомобилестроительной отрасли на основе системы MFG/PRO
Композиционное решение для предприятий автомобилестроительной отрасли на основе системы MFG/PRO Никола Тесла-повелитель молний
Никола Тесла-повелитель молний Проверка понимания озвученного текста
Проверка понимания озвученного текста Представление графической информации в компьютере
Представление графической информации в компьютере