Содержание
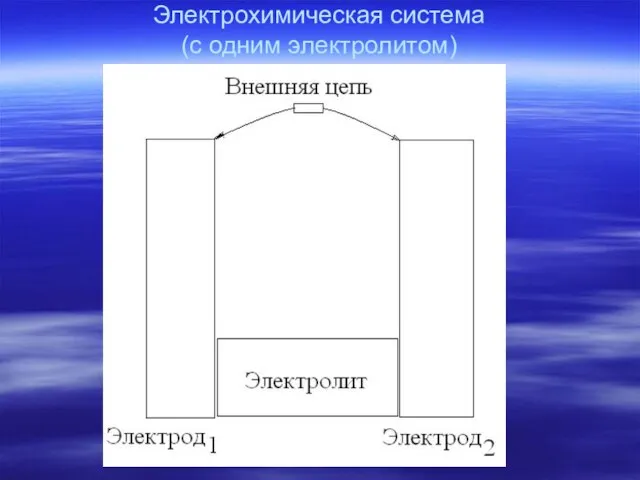
- 3. Электрохимическая система (с одним электролитом)
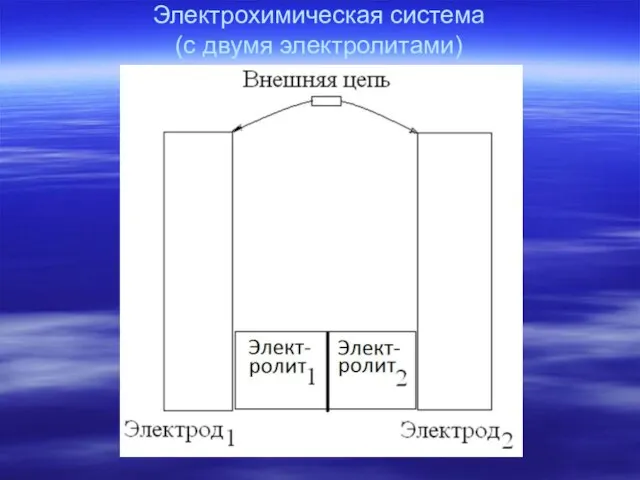
- 4. Электрохимическая система (с двумя электролитами)
- 5. Электрохимическая схема Система с одним электролитом – Система с двумя электролитами – электрод1| электролит | электрод2
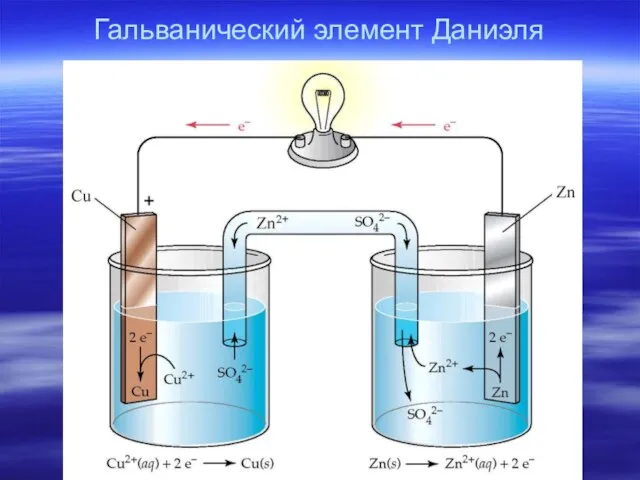
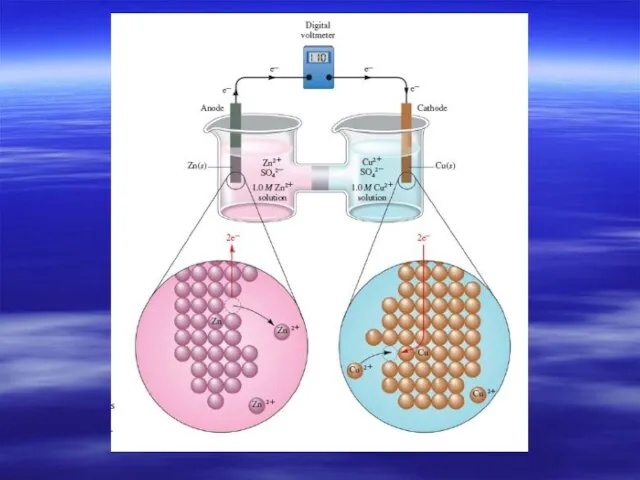
- 6. Гальванический элемент Даниэля
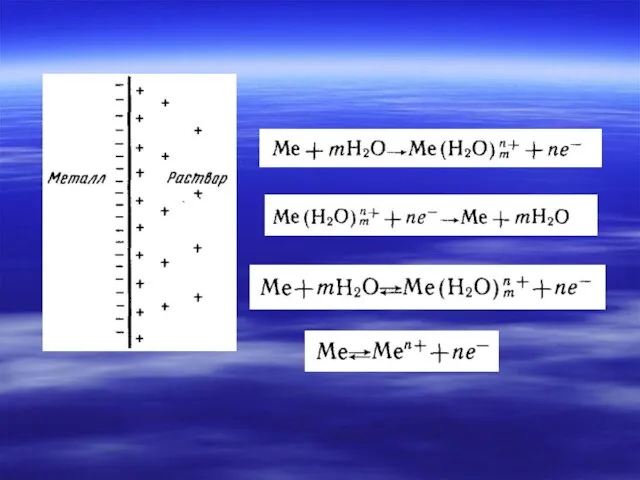
- 7. Электрохимические термины и процессы в гальваническом элементе Анод – электрод, на котором происходит окисление. Катод -
- 8. Схема: анод| электролит1 ¦¦ электролит2 | катод Полная: Zn | ZnSO4 ¦¦ CuSO4 | Cu Краткая:
- 9. Электродвижущая сила (ЭДС) – разность потенциалов (напряжение) между электродами: E = φ2 - φ1. E связана
- 10. Измерения электродных потенциалов E = φкатода – φанода Принято: электродный потенциал = = E = φэлектрода
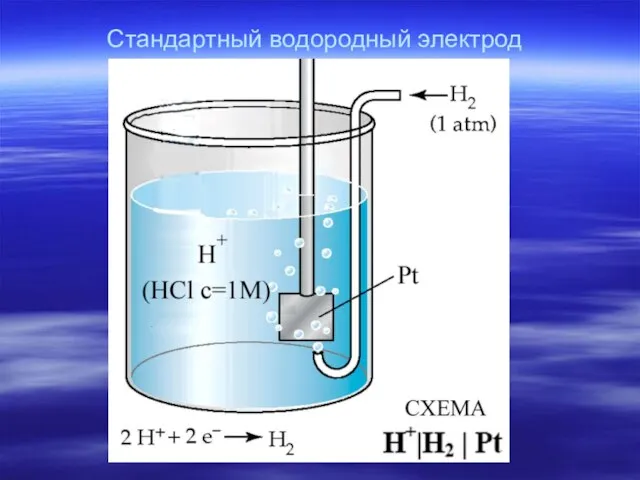
- 11. Стандартный водородный электрод
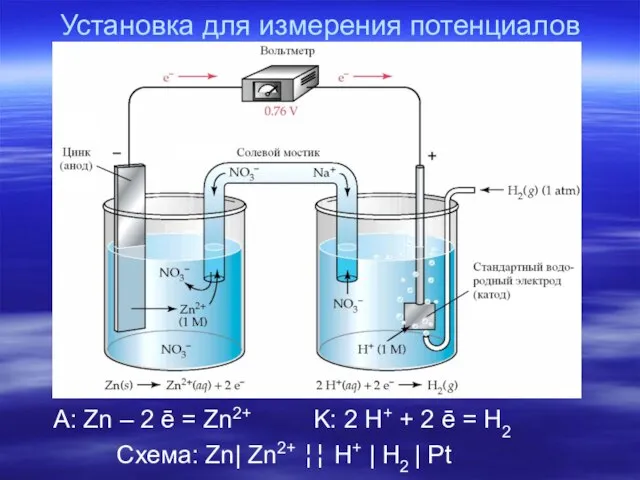
- 12. Установка для измерения потенциалов A: Zn – 2 ē = Zn2+ K: 2 H+ + 2
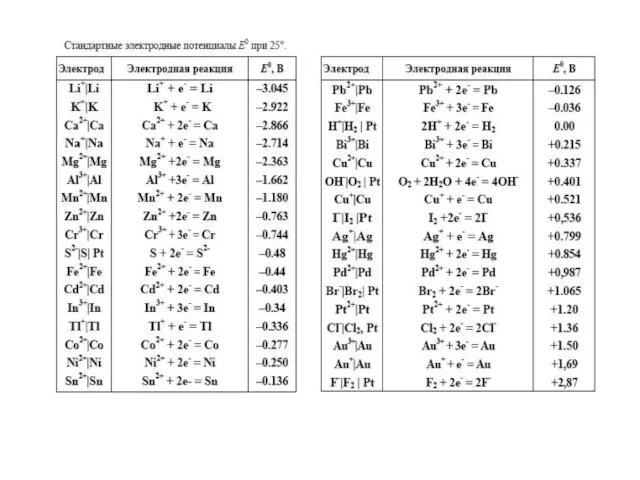
- 13. Стандартный электродный потенциал Измеряется Е = φэлектрод – φСВЭ = = ЕOx/Red ЕOx/Red = f(природы реагентов,
- 15. Ряд напряжений металлов
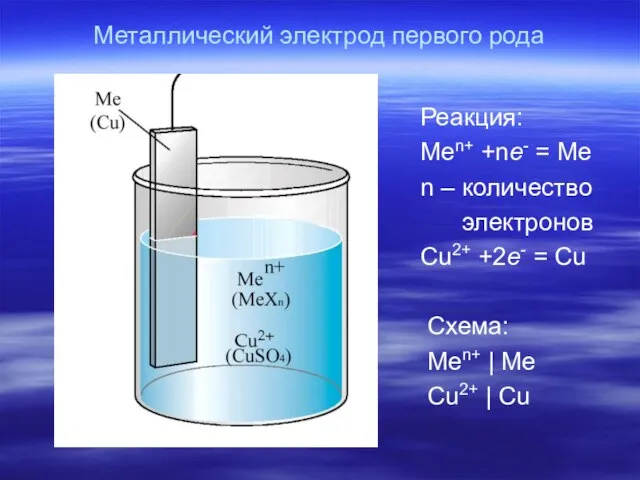
- 17. Металлический электрод первого рода Реакция: Men+ +ne- = Me n – количество электронов Cu2+ +2e- =
- 18. Зависимость Е от с - уравнение Нернста F – число Фарадея F = 96500 Кл/моль При
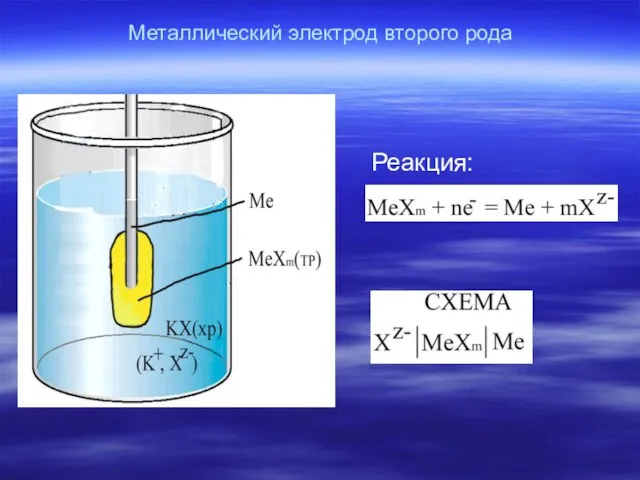
- 19. Металлический электрод второго рода Реакция:
- 20. Уравнение потенциала:
- 21. хлорсеребряный электрод Ag | AgCl | Cl- AgCl + ē = Ag + Cl- кадмий-оксидный электрод
- 22. Окислительно-восстановительный электрод Реакция: Пример: Пример: Схема:
- 23. Уравнение потенциала Пример:
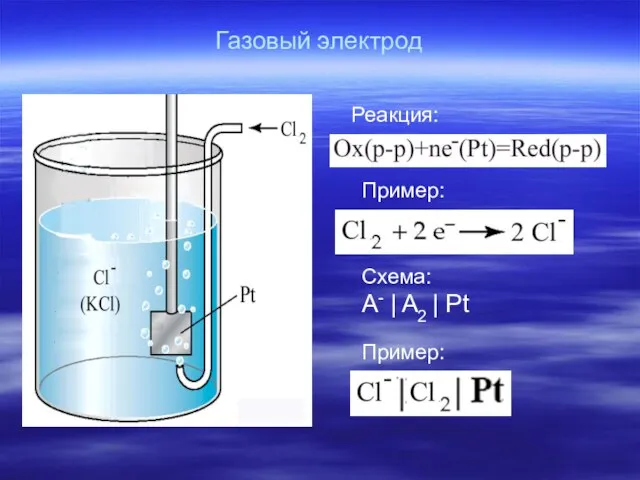
- 24. Газовый электрод Реакция: Пример: Пример: Схема: A- | A2 | Pt
- 25. Уравнение потенциала кислородный электрод Pt | О2 | OH- O2 + 2Н2O + 4e- = 4OH-
- 29. Скачать презентацию















 Первичная переработка нефти
Первичная переработка нефти  День школьных библиотек
День школьных библиотек Модуль 3.3: Происшествия в любой клинике
Модуль 3.3: Происшествия в любой клинике Реабилитация детей с ограниченными возможностями здоровья (нарушение интеллекта)
Реабилитация детей с ограниченными возможностями здоровья (нарушение интеллекта) Конституция РФ
Конституция РФ Презентация (1)
Презентация (1) Полуектов Иван Фёдорович (29.08.1903 - 12.07.1944)
Полуектов Иван Фёдорович (29.08.1903 - 12.07.1944) Презентация на тему ТОЛПА И ЧЕЛОВЕК
Презентация на тему ТОЛПА И ЧЕЛОВЕК  Всё про Деда Мороза и Новый год
Всё про Деда Мороза и Новый год Формирование основ толерантного сознания и поведения, как основного фактора улучшения психологического климата. Подготовили: Вас
Формирование основ толерантного сознания и поведения, как основного фактора улучшения психологического климата. Подготовили: Вас Сувенирная кукла
Сувенирная кукла Гражданское право как отрасль права, его предмет и метод
Гражданское право как отрасль права, его предмет и метод BrainWare
BrainWare Схема процесса внедрения комплекса ГТО через программу Партнеры ГТО
Схема процесса внедрения комплекса ГТО через программу Партнеры ГТО Электромагнитное поле. Компьютер как источник электромагнитных полей
Электромагнитное поле. Компьютер как источник электромагнитных полей Общие должностные и специальные обязанности военнослужащих
Общие должностные и специальные обязанности военнослужащих Презентация на тему Внутренняя энергия. Способы изменения внутренней энергии
Презентация на тему Внутренняя энергия. Способы изменения внутренней энергии Восемнадцатое мая.Изложение.Друг детства.
Восемнадцатое мая.Изложение.Друг детства. Государство и право
Государство и право Размножение. Способы размножения
Размножение. Способы размножения Тестирование без требований
Тестирование без требований Информационные технологии
Информационные технологии ООО «СДС инжиниринг»ваш надежный партнер в вопросах:
ООО «СДС инжиниринг»ваш надежный партнер в вопросах: С 8 Марта, Дорогие женщины!!!
С 8 Марта, Дорогие женщины!!! Искусство намека в Китае
Искусство намека в Китае Дебат - пікісайрыс ойыны
Дебат - пікісайрыс ойыны Библиотека МОУ СОШ № 36
Библиотека МОУ СОШ № 36 Медицина во время Великой Отечественной войны
Медицина во время Великой Отечественной войны