Содержание
- 2. Протекающая реакция описывается следующим уравнением 2KOH + H2SO4 = K2SO4 + 2H2O
- 3. 2KOH + H2SO4 = K2SO4 + 2H2O Отражает ли эта запись в истинном свете проведенную реакцию?
- 4. В растворе ионы 2KOH = 2K+ + 2OH- H2SO4 = 2H+ + SO42- K2SO4 = 2K+
- 5. Поэтому реакция записывается в ионном виде 2K+ +2OH- +2H+ +SO42- = = 2K+ + SO42- +
- 7. Реакция нейтрализации между H2SO4 и Ba(OH)2 это другая реакция, так как в результате образуется нерастворимая соль
- 8. Молекулярное уравнение H2SO4 + Ba(OH)2 = = BaSO4↓ + 2H2O Ионный вид 2H+ + SO42- +
- 9. Проделаем реакцию между карбонатом калия и соляной кислотой.
- 10. Что мы наблюдаем ?
- 11. Запишем уравнение реакции. Проверим.
- 12. Молекулярное уравнение K2CO3 + 2HCl = 2KCl + H2O + CO2↑ Полный ионный вид 2K+ +
- 13. Правила составления ионных уравнений реакции Сильные электролиты записывают в виде образующих их ионов ( с учетом
- 14. Формулы слабых электролитов ( в т.ч. H2O ), нерастворимых и газообразных веществ записываются в молекулярной форме
- 15. Если вещество выпадает в осадок, то рядом с его формулой ставят стрелку, направленную вниз ( ↓
- 16. Проделаем реакцию между сульфатом меди(2) и гидроксидом натрия.
- 17. Что мы наблюдаем ?
- 18. Запишем уравнение реакции. Проверим.
- 19. Молекулярное уравнение: CuSO4 + 2NaOH = = Cu(OH)2↓ + Na2SO4 Полное ионное уравнение: Cu2+ + SO42-
- 20. Реакции ионного обмена в растворах электролитов практически осуществимы (протекают до конца) только в тех случаях, когда
- 21. Тестовый контроль № 1 Дополните. Частицы заряженные положительно называются ________________________________ Частицы заряженные отрицательно называются _____________________________
- 22. № 2 Продукты реакции нейтрализации 1. Соль и вода 2. Соль и основание 3. Соль и
- 23. № 3 Реакция ионного обмена, идущая до конца 1. MgSO4 + Ba(NO3)2 → 2. MgCl2 +
- 24. № 4 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие три равные группы их
- 25. № 5 Внимательно рассмотрите перечисленные в задании схемы электролитической диссоциации. На какие две равные группы их
- 26. Ответы № 1 Частицы заряженные положительно называются Катионы Частицы заряженные отрицательно называются Анионы № 2 1.
- 27. № 3 1. MgSO4 + Ba(NO3)2 → № 4 1-я группа (схемы электролитической диссоциации щелочей) :
- 28. № 5 1-я группа (схемы электролитической диссоциации соединений натрия) : а) NaOH → Na+ + OH-
- 30. Скачать презентацию



























 Новогодняя открытка. Оригами
Новогодняя открытка. Оригами Консульский отдел
Консульский отдел Презентация на тему Моя будущая профессия - врач-психиатр
Презентация на тему Моя будущая профессия - врач-психиатр  Умножение обыкновенных дробей
Умножение обыкновенных дробей DevicePro® Ultimate обзор продуктовУправлять устройствами легко и просто!
DevicePro® Ultimate обзор продуктовУправлять устройствами легко и просто! Ostern in Deutschland
Ostern in Deutschland  Презентация на тему Край, в котором ты живёшь (1 класс)
Презентация на тему Край, в котором ты живёшь (1 класс) Искусство и костюм стиля МОДЕРН
Искусство и костюм стиля МОДЕРН Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности»
Приобщение дошкольников к народной культуре в разных видах музыкальной деятельности» Аэродинамическая компоновка и аэродинамические характеристики учебно-боевого самолёта
Аэродинамическая компоновка и аэродинамические характеристики учебно-боевого самолёта Презентация на тему Электрические явления в атмосфере
Презентация на тему Электрические явления в атмосфере  Страна Африки: Нигерия
Страна Африки: Нигерия Правильные и полуправильные многогранники
Правильные и полуправильные многогранники Даунинг Тэйт, Роберт Эшер. Рисуночный тест Внутренняя часть тела
Даунинг Тэйт, Роберт Эшер. Рисуночный тест Внутренняя часть тела Презентация на тему Пётр Первый и его дела
Презентация на тему Пётр Первый и его дела  Індукційні варильні поверхні
Індукційні варильні поверхні Социология как наука
Социология как наука Кузьменко Н.А. учитель начальных классов МОСШ № 8
Кузьменко Н.А. учитель начальных классов МОСШ № 8 Курсовая работа
Курсовая работа Революционное народничество второй половины 60-х начала 80-х годов XIX века
Революционное народничество второй половины 60-х начала 80-х годов XIX века Формирование учебной мотивации у младших школьников
Формирование учебной мотивации у младших школьников Спряжение глаголов (задания)
Спряжение глаголов (задания) Презентация на тему Экосистема. Структура экосистемы
Презентация на тему Экосистема. Структура экосистемы Кольцо Всевластия
Кольцо Всевластия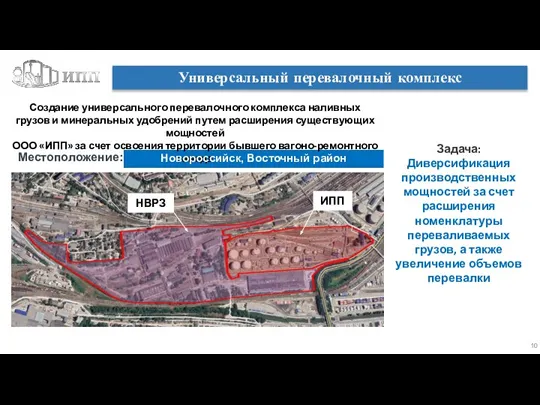 Универсальный перевалочный комплекс
Универсальный перевалочный комплекс Игра «Хочу все знать».
Игра «Хочу все знать».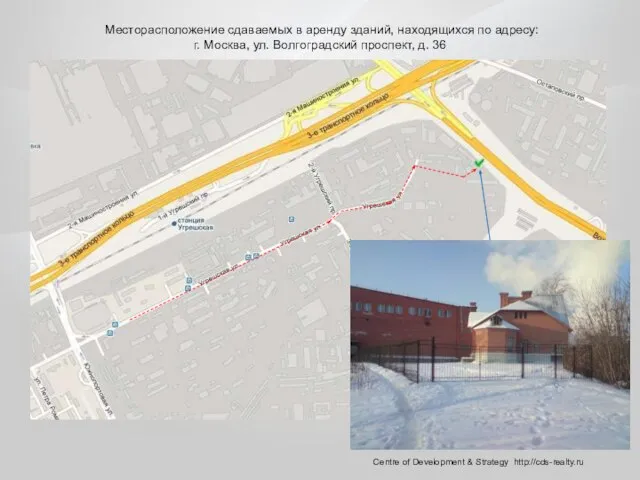 Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36
Месторасположение сдаваемых в аренду зданий, находящихся по адресу: г. Москва, ул. Волгоградский проспект, д. 36 Отечественная война 1812 года
Отечественная война 1812 года