Содержание
- 2. Цель Сформировать понятие о кислотах как классе электролитов; Рассмотреть их классификацию по разным признакам; Представить химические
- 3. Что такое кислоты? Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком Электролиты, диссоциирующие с
- 4. Классификация кислот
- 5. Химические свойства кислот Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с
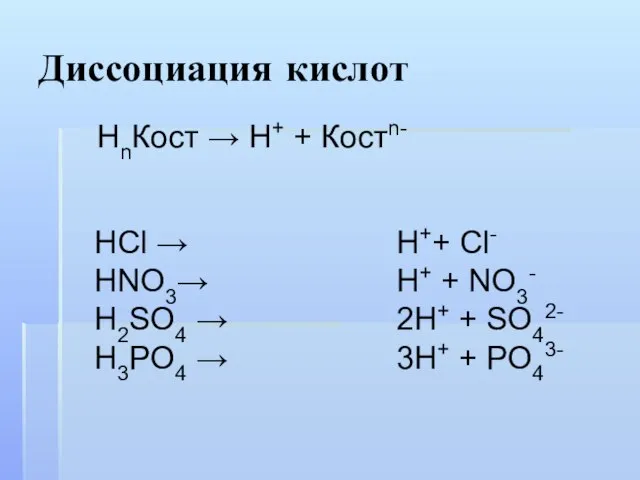
- 6. Диссоциация кислот HCl → HNO3→ H2SO4 → H3PO4 → НnКост → Н+ + Костn- H++ Cl-
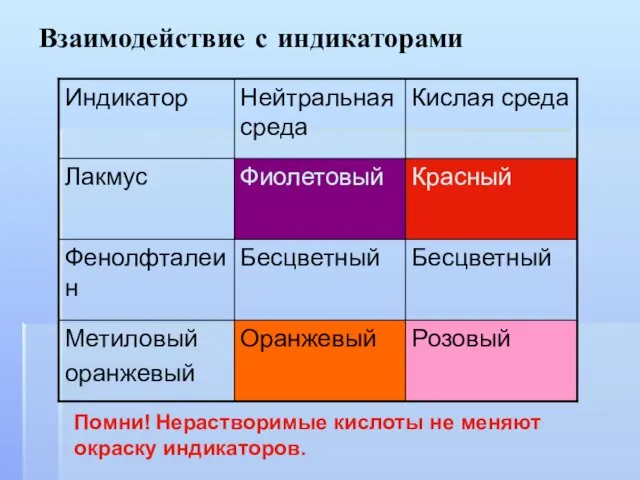
- 7. Взаимодействие с индикаторами Помни! Нерастворимые кислоты не меняют окраску индикаторов.
- 8. Взаимодействие с металлами Ме + НnКост → МеnКостm+ Н2 металл + кислота→соль + водород 2 Al
- 9. Взаимодействие с основными оксидами МеxOy + HnКост → МеnКостy + H2O Основный оксид + кислота →
- 10. Взаимодействие с основаниями Ме(ОН)m + НnКост → MenКостm + H2O Основание + кислота → соль +
- 11. Взаимодействие с солями МеxКостy + HnКост → HхКост + МеnКостy Соль + кислота → новая кислота
- 13. Скачать презентацию








 Презентация на тему Культура и Цивилизация
Презентация на тему Культура и Цивилизация Презентация на тему Проведение коммерческих переговоров
Презентация на тему Проведение коммерческих переговоров  М.Ю.Лермонтов. Личность поэта. Стихотворение «Парус»
М.Ю.Лермонтов. Личность поэта. Стихотворение «Парус» 1С: ТОРГОВЛЯ И СКЛАД
1С: ТОРГОВЛЯ И СКЛАД МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СИДОРОВСКАЯ СРЕДНЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА
МУНИЦИПАЛЬНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СИДОРОВСКАЯ СРЕДНЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА Техника высоких напряжений
Техника высоких напряжений Информационное моделирование
Информационное моделирование Презентация на тему Серебряный век российской литературы
Презентация на тему Серебряный век российской литературы  Учебный центр Softline
Учебный центр Softline Камчатка
Камчатка Понятой в уголовном процессе России
Понятой в уголовном процессе России Съемка ТФП
Съемка ТФП Родительское собрание«О введении комплексного учебного курса «Основы религиозных культур и светской этики» : цели, задачи, прин
Родительское собрание«О введении комплексного учебного курса «Основы религиозных культур и светской этики» : цели, задачи, прин ОбразП в искусстве
ОбразП в искусстве Объединение «Художественное моделирование, квиллинг»
Объединение «Художественное моделирование, квиллинг» Кризис современных политических партий
Кризис современных политических партий Проектная и исследовательская деятельность .
Проектная и исследовательская деятельность . Особенности деятельности театральных, творческих коллективов и фольклорных студий города Москвы
Особенности деятельности театральных, творческих коллективов и фольклорных студий города Москвы Лучший по строительной профессии
Лучший по строительной профессии ИСТОРИЯ ОРУЖИЯ
ИСТОРИЯ ОРУЖИЯ Компьютерные сети Адресация в Интернете
Компьютерные сети Адресация в Интернете Пыль и здоровье человека
Пыль и здоровье человека Презентация на тему Дроби в Вавилоне, Египте, Риме. Открытие десятичных дробей
Презентация на тему Дроби в Вавилоне, Египте, Риме. Открытие десятичных дробей Опера. История и строение оперы
Опера. История и строение оперы Знаю! Умею! Действую! ЕИД ОГЭ-2022
Знаю! Умею! Действую! ЕИД ОГЭ-2022 Композиционный анализ произведения живописи
Композиционный анализ произведения живописи Человек собаке друг
Человек собаке друг И|Н|Ф|Р|А|К|Р|А|С|Н|Ы|Е С|И|С|Т|Е|М|Ы О|Б|О|Г|Р|Е|В|А
И|Н|Ф|Р|А|К|Р|А|С|Н|Ы|Е С|И|С|Т|Е|М|Ы О|Б|О|Г|Р|Е|В|А