Слайд 2Одним из основателей химии комплексных соединений считается швейцарский химик А.Вернер, предложивший координационную
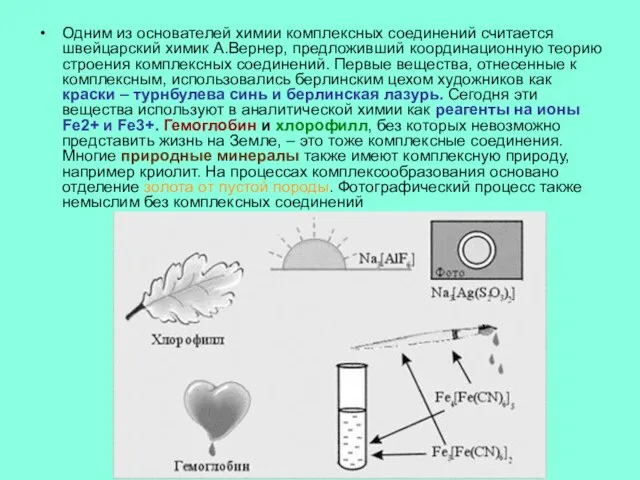
теорию строения комплексных соединений. Первые вещества, отнесенные к комплексным, использовались берлинским цехом художников как краски – турнбулева синь и берлинская лазурь. Сегодня эти вещества используют в аналитической химии как реагенты на ионы Fe2+ и Fe3+. Гемоглобин и хлорофилл, без которых невозможно представить жизнь на Земле, – это тоже комплексные соединения. Многие природные минералы также имеют комплексную природу, например криолит. На процессах комплексообразования основано отделение золота от пустой породы. Фотографический процесс также немыслим без комплексных соединений
Слайд 3Главное действующее лицо в комплексном ионе – комплексообразователь. Это положительный ион, имеющий
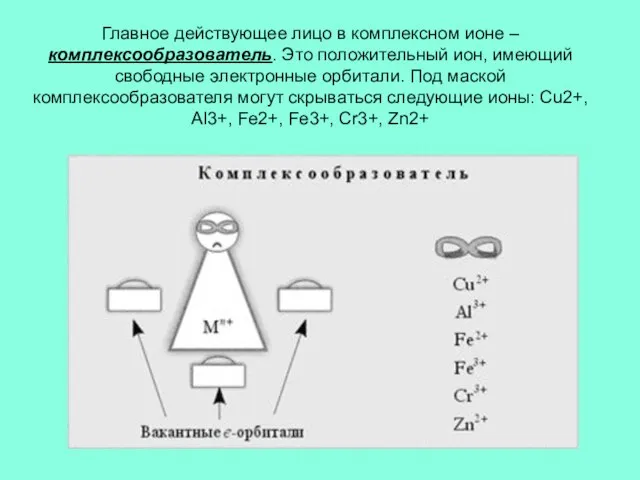
свободные электронные орбитали. Под маской комплексообразователя могут скрываться следующие ионы: Cu2+, Al3+, Fe2+, Fe3+, Cr3+, Zn2+
Слайд 4Кроме комплексообразователя в состав комплексного иона входят лиганды (от лат. ligo –

привязываю). Лиганды буквально «связаны по рукам и ногам» своими неподеленными электронными парами, которые они несут как тяжкий груз. Лигандами могут быть нейтральные молекулы и отрицательные ионы
Слайд 5Если комплексообразователь принимает неподеленные электронные пары лигандов на свои свободные электронные орбитали,
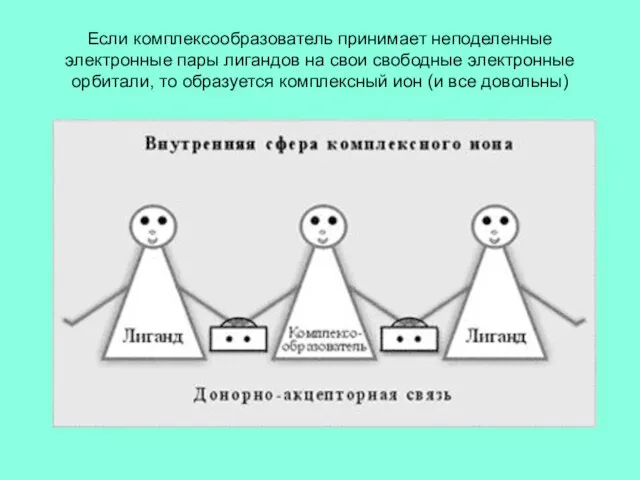
то образуется комплексный ион (и все довольны)
Слайд 6Число лигандов, связанных с комплексообразователем, называется координационным числом (КЧ). («Лиганды, по порядку
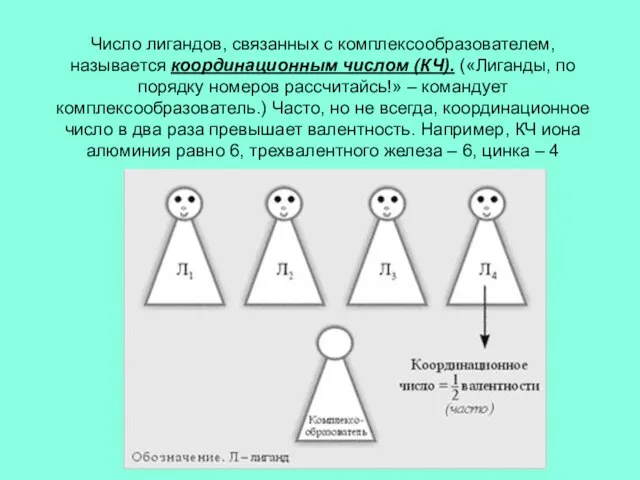
номеров рассчитайсь!» – командует комплексообразователь.) Часто, но не всегда, координационное число в два раза превышает валентность. Например, КЧ иона алюминия равно 6, трехвалентного железа – 6, цинка – 4
Слайд 7Комплексный ион, состоящий из комплексообразователя и лигандов, образует внутреннюю сферу комплексного соединения,

как бы его дом. А вокруг дома – сад, т. е. внешняя сфера.
Если комплексный ион – катион, то внешнюю сферу составляют анионы – галогениды, сульфат, гидроксид, нитрат . Если комплексный ион – анион, то внешнюю сферу составляют катионы – калий, натрий и др. Если внутренняя сфера образована донорно-акцепторным взаимодействием, то внешняя связана с внутренней электростатическим притяжением. Заряд внешней сферы по величине совпадает с зарядом внутренней сферы.
Слайд 8В квадратные скобки ставят собственно комплекс. Внутри скобок - внутренняя координационная сфера,
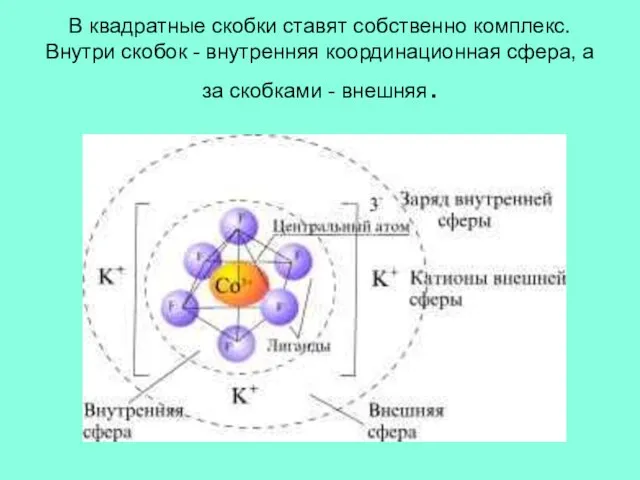
а за скобками - внешняя.
Слайд 9Комплексы (комплексные, координационные соединения) - это молекулы или ионы, обладающие высокой симметрией,

имеющие атом в центре симметрии - центральный атом, комплексообразователь. Вокруг центрального атома располагаются атомы или группы атомов - лиганды, которые и образуют симметричную фигуру.
Слайд 10Квадратный комплекс [Pt(NH3)2Cl2]
![Квадратный комплекс [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-9.jpg)
Слайд 11Октаэдрмический комплексный ион [CoF6]3-
![Октаэдрмический комплексный ион [CoF6]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-10.jpg)
Слайд 12Комплексные соединения классифицируются по заряду комплексов: катионные - [Ni(NH3)4]2+, анионные - [Co(CN)6
![Комплексные соединения классифицируются по заряду комплексов: катионные - [Ni(NH3)4]2+, анионные - [Co(CN)6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-11.jpg)
]3-, нейтральные - [Co(NH3)4Сl2]0;
по составу и химическим свойствам: кислоты - H[AuCl4], основания - [Ag(NH3)2]OH, соли - [Ni(NH3)6]SO4;
по типу лигандов: гидроксокомплексы - K2[Zn(OH)4], аквакомплексы - [Fe(H2O)6]Cl3, ацидокомплексы (лиганды - анионы кислот) - K4[Fe(CN)6], комплексы смешанного типа - K[Co(NH3)2Cl4], [Pt(NH3)4(H2O)2]Cl4.
Названия комплексов строятся по общим правилам IUPAC : читаются и записываются справа налево,
лиганды - с окончанием - о,
анионы - с окончанием - ат.
Некоторые лиганды могут иметь особые названия. Например, молекулы - лиганды Н2О и NH3 называют акво- и аммин, соответственно.
Слайд 13Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе
![Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-12.jpg)
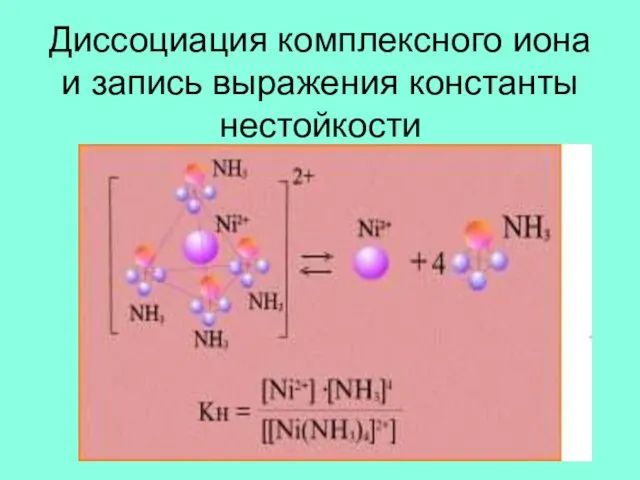
Слайд 14Диссоциация комплексного иона и запись выражения константы нестойкости
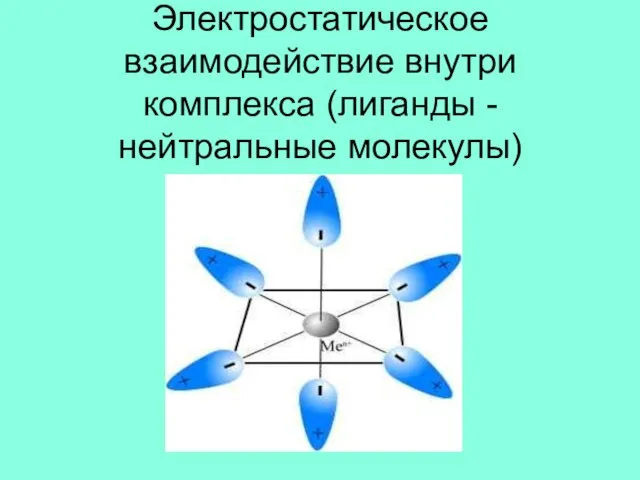
Слайд 15Электростатическое взаимодействие внутри комплекса (лиганды -нейтральные молекулы)








![Квадратный комплекс [Pt(NH3)2Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-9.jpg)
![Октаэдрмический комплексный ион [CoF6]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-10.jpg)
![Комплексные соединения классифицируются по заряду комплексов: катионные - [Ni(NH3)4]2+, анионные - [Co(CN)6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-11.jpg)
![Диссоциация комплексного соединения [Ni(NH3)4]SO4 в водном растворе](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/405757/slide-12.jpg)


 Туристско-спортивная смена Турист готов к труду и обороне!
Туристско-спортивная смена Турист готов к труду и обороне! 14 жовтня
14 жовтня Cloud game 8/19
Cloud game 8/19 В гостях у самовара
В гостях у самовара Духовное краеведение Подмосковья
Духовное краеведение Подмосковья Сочинение – сравнительная характеристика
Сочинение – сравнительная характеристика Новые и старые медиа, консерватизм и новации Кто ближе к цели?
Новые и старые медиа, консерватизм и новации Кто ближе к цели?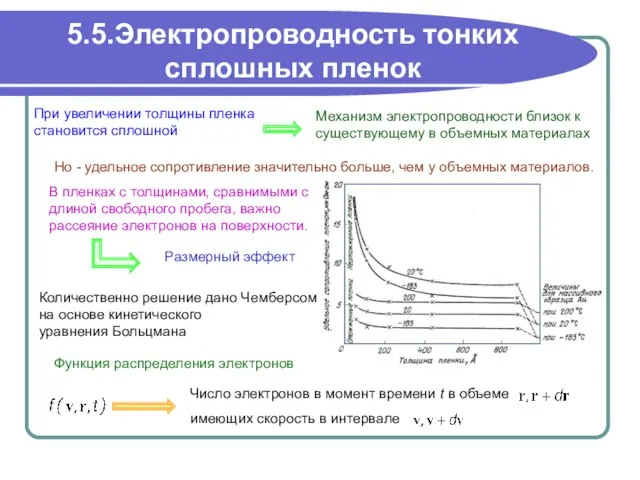 5.5.Электропроводность тонких сплошных пленок
5.5.Электропроводность тонких сплошных пленок liǎng zhī lǎo hǔ liǎng zhī lǎo hǔ 两 只 老 虎 两
liǎng zhī lǎo hǔ liǎng zhī lǎo hǔ 两 只 老 虎 两 Автоматизация звука [Ж] в интервокальной позиции
Автоматизация звука [Ж] в интервокальной позиции Презентация на тему Рынок недвижимости и особенности его функционирования
Презентация на тему Рынок недвижимости и особенности его функционирования  Олимпийские зимние игры
Олимпийские зимние игры Леди-фуршет« Изысканный вкус самой избирательной публики »
Леди-фуршет« Изысканный вкус самой избирательной публики » Виды толерантности
Виды толерантности КЛУБ ИНВЕСТОРОВ И КРЕДИТОРОВ VI-ое ЗАСЕДАНИЕ Портал инвестиционных проектов.
КЛУБ ИНВЕСТОРОВ И КРЕДИТОРОВ VI-ое ЗАСЕДАНИЕ Портал инвестиционных проектов. Latte Soft Touch Antibacterial. Материалы
Latte Soft Touch Antibacterial. Материалы черчение (3)
черчение (3) Preposition
Preposition Разработка web -приложений для фирмы
Разработка web -приложений для фирмы Направления развития производства
Направления развития производства LOIVA MJ-3400_Presentation 21_12_RU
LOIVA MJ-3400_Presentation 21_12_RU Муниципальный конкурс «Будущее уже наступило»
Муниципальный конкурс «Будущее уже наступило» Раз, два, три, книга оживи…
Раз, два, три, книга оживи… Сложение и вычитание в пределах 20
Сложение и вычитание в пределах 20 Папка мои достижения
Папка мои достижения Аксессуары на а/м Chevrolet DAT
Аксессуары на а/м Chevrolet DAT День Рождения Деда Мороза
День Рождения Деда Мороза «Лебедь, рак, щука»… Простая басня или противоречие механики?Вопрос рассматривал: Иванов Иван
«Лебедь, рак, щука»… Простая басня или противоречие механики?Вопрос рассматривал: Иванов Иван