Слайд 2ОПРЕДЕЛЕНИЕ
Раствор – это термодинамически устойчивая гомогенная система (фаза) переменного состава

Слайд 3СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Мольная доля – отношение числа молей i-го компонента раствора

к общему числу молей:
ВОПРОС: чему равна сумма мольных долей всех компонентов?
Молярная концентрация (молярность) – число молей растворенного вещества в одном литре (кубическом дециметре) раствора:
ВОПРОС: какова размерность молярности раствора?
Слайд 4СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРОВ
Моляльность – число молей i-го компонента, приходящееся на 1000

г растворителя:
ВОПРОС: какова размерность моляльности раствора?
Слайд 5ИДЕАЛЬНЫЙ РАСТВОР
раствор, в котором молекулы растворителя взаимодействуют с растворенным веществом так же,

как взаимодействуют между собой молекулы растворителя и между собой - молекулы растворенного вещества
энергия взаимодействия разнородных молекул равна средней энергии взаимодействия однородных молекул:
Слайд 6ОБРАЗОВАНИЕ ИДЕАЛЬНОГО РАСТВОРА
не сопровождается тепловым эффектом
ΔHсмеш=0
не сопровождается изменением объема
ΔVсмеш=0
изменение энтропии равно

изменению энтропии при смешении идеальных газов
ΔSсмеш=ΔSид
Слайд 7МОДЕЛИ НЕИДЕАЛЬНЫХ РАСТВОРОВ
предельно разбавленный раствор, в котором растворитель подчиняется законам идеальных растворов,

а растворенное вещество не подчиняется
регулярный раствор, в котором взаимодействие частиц приводит к изменению энтальпии и объема системы, в то время как изменение энтропии соответствует изменению при смешении идеальных газов
Слайд 8МОДЕЛИ НЕИДЕАЛЬНЫХ РАСТВОРОВ
атермальный раствор, в котором взаимодействие частиц приводит к изменению объема,

к изменени энтропии, не отвечающему смешению идеальных газов, в то время как тепловой эффект смешения равен нулю
ассоциированный раствор, в котором наряду с ван-дер-ваальсовыми межмолекулярными взаимодействиями имеются специфические, близкие по характеру к слабой химической связи
Слайд 9КОЛЛИГАТИВНЫЕ СВОЙСТВА ИДЕАЛЬНЫХ И НЕИДЕАЛЬНЫХ РАСТВОРОВ
1. Давление пара летучего компонента (например, растворителя)

над идеальным раствором пропорционально мольной доле этого компонента в растворе (закон Рауля)
ЗАДАНИЕ. Запишите уравнение закона Рауля и рассчитайте давление пара растворителя над раствором, в котором мольная доля растворенного вещества равна 0,01, а давление пара чистого растворителя равно 6000 Па.
Слайд 101А. ОТКЛОНЕНИЯ ОТ ЗАКОНА РАУЛЯ
Положительные: давление пара летучего компонента превышает рассчитанное по

закону Рауля
ВОПРОС: каким тепловым эффектом сопровождается образование неидеального раствора с положительными отклонениями от идеальности? Почему?
Отрицательные: давление пара летучего компонента ниже рассчитанного по закону Рауля
ВОПРОС: каким тепловым эффектом сопровождается образование неидеального раствора с положительными отклонениями от идеальности? Почему?
Слайд 112. ДАВЛЕНИЕ ПАРА РАСТВОРЕННОГО ВЕЩЕСТВА
Растворимость двухатомных газов в металлах пропорциональна корню квадратному

из их парциального давления (закон Сивертса)
ЗАДАНИЕ: Выведите уравнение закона Сивертса.
Растворимость газа в жидкости пропорциональна его парциальному давлению (закон Генри)
ЗАДАНИЕ: Объясните, как меняется растворимость газа в воде при повышении температуры
Слайд 123. ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ И ПОВЫШЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ РАСТВОРА
Изменение химического потенциала растворителя
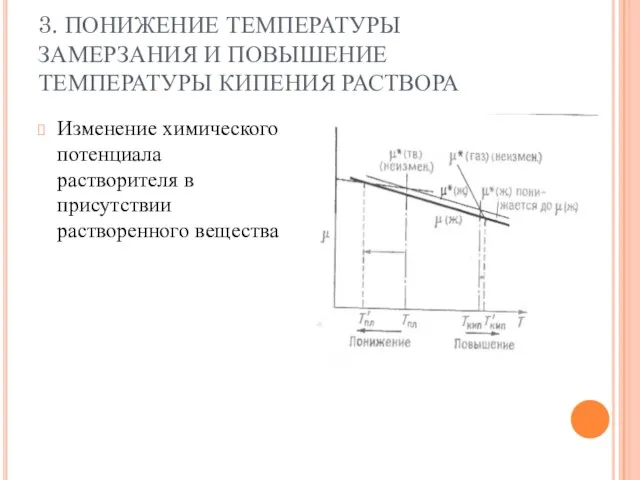
в присутствии растворенного вещества
Слайд 133А. КРИОСКОПИЧЕСКИЙ И ЭБУЛИОСКОПИЧЕСКИЙ ЭФФЕКТЫ
ΔТ(замерзания) = Кm
К – криоскопическая константа (зависит только

от свойств растворителя)
m – моляльность раствора
ΔТ(кипения) = Еm
Е – эбулиоскопическая константа (зависит только от свойств растворителя)
m – моляльность раствора
ВОПРОС: каково практическое значение этих эффектов? Приведите два-три примера.












 Учебный Центр БИТ
Учебный Центр БИТ Торф
Торф Представление корректирующих сведений персонифицированного учета
Представление корректирующих сведений персонифицированного учета Voľba študijného odboru
Voľba študijného odboru Технология .NET Remoting
Технология .NET Remoting Награды в сфере нанотехнологий
Награды в сфере нанотехнологий Global Trading St. Petersburg
Global Trading St. Petersburg Калькуляция
Калькуляция Python_-_задача_на_пару__HiNjSk
Python_-_задача_на_пару__HiNjSk Музыка эпохи классицизма
Музыка эпохи классицизма Международная транспортная инфраструктура, региональная интеграция и развитие (на примере Украины)
Международная транспортная инфраструктура, региональная интеграция и развитие (на примере Украины) Формирование международной проектной команды для выполнения многоцелевого проекта в области ИТ. Игорь Ковалев Директор по ИТ про
Формирование международной проектной команды для выполнения многоцелевого проекта в области ИТ. Игорь Ковалев Директор по ИТ про Оплата частями от Target Finance
Оплата частями от Target Finance AutoProcessor UPGRADED Integration
AutoProcessor UPGRADED Integration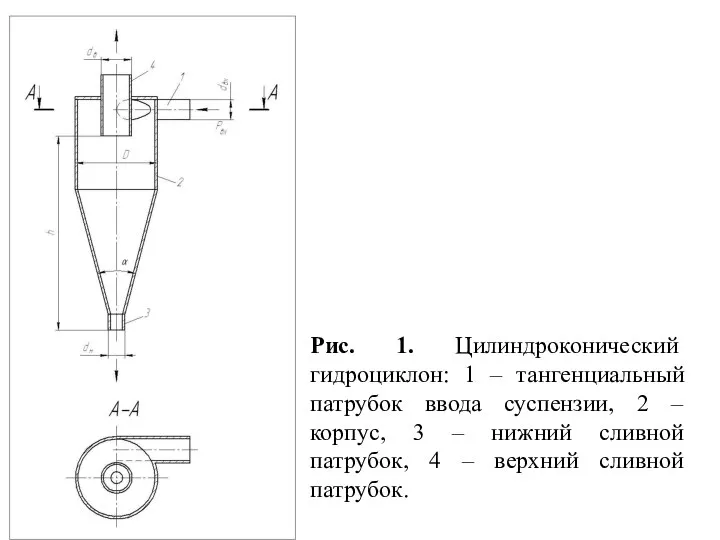 Гидромеханические установки. Цилиндроконический гидроциклон. (Лекция 5)
Гидромеханические установки. Цилиндроконический гидроциклон. (Лекция 5) Old English Grammar
Old English Grammar Равновесие тел
Равновесие тел Казахские национальные блюда
Казахские национальные блюда Сайт: http://www.ruschudo.ru/ Цель проекта: возраждение чувства патриотизма и любви к своему Отечеству.1-ый тур. Из 380 претендентов выбрано 49,
Сайт: http://www.ruschudo.ru/ Цель проекта: возраждение чувства патриотизма и любви к своему Отечеству.1-ый тур. Из 380 претендентов выбрано 49,  «Виды речевых нарушений у дошкольников»
«Виды речевых нарушений у дошкольников» Maxim Calujac
Maxim Calujac Проектирование образовательных кейсов с использованием дистанционных технологий
Проектирование образовательных кейсов с использованием дистанционных технологий Геополитика Узбекистана
Геополитика Узбекистана Юдина Татьяна Владимировна
Юдина Татьяна Владимировна Презентация на тему Различные группы антибиотиков: характеристика, получение, применение
Презентация на тему Различные группы антибиотиков: характеристика, получение, применение  Использование технологии развития критического мышления на уроке английского языка по теме:«Телевидение: за и против».
Использование технологии развития критического мышления на уроке английского языка по теме:«Телевидение: за и против». Пейзаж в линейной перспективе
Пейзаж в линейной перспективе игра
игра