Содержание
- 2. Біофізика білків Білки – молекулярні “машини”. Структурна організація білків. Ферменти – як представники групи білків. Механізм
- 3. Білки – молекулярні “машини”
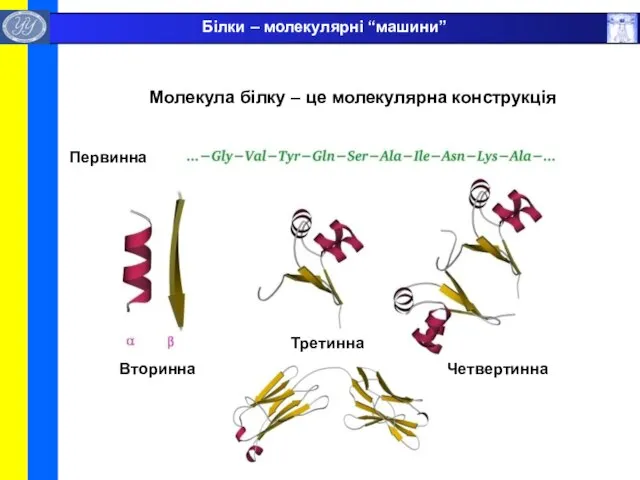
- 4. Молекула білку – це молекулярна конструкція Первинна Вторинна Третинна Четвертинна Білки – молекулярні “машини”
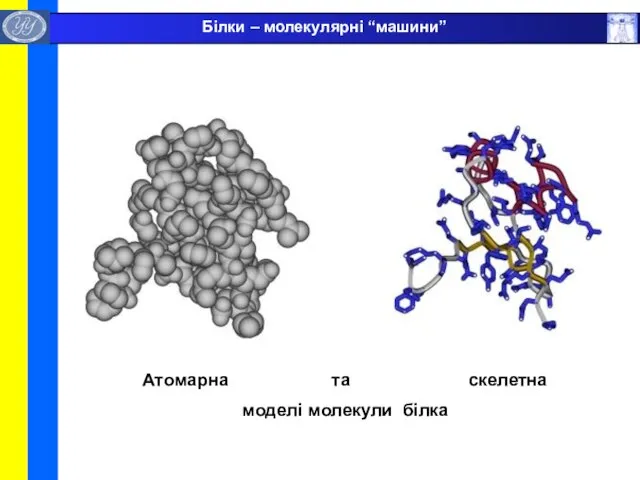
- 5. Атомарна та скелетна моделі молекули білка Білки – молекулярні “машини”
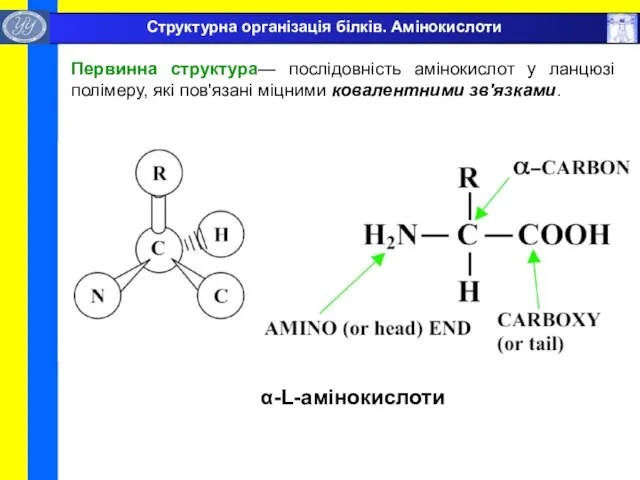
- 6. α-L-амінокислоти Структурна організація білків. Амінокислоти Первинна структура— послідовність амінокислот у ланцюзі полімеру, які пов'язані міцними ковалентними
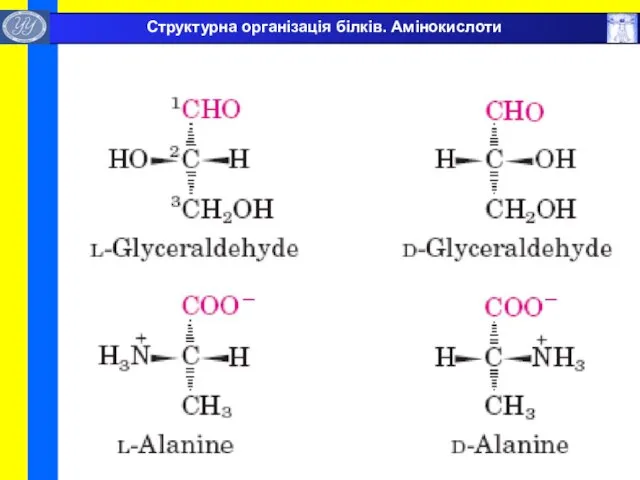
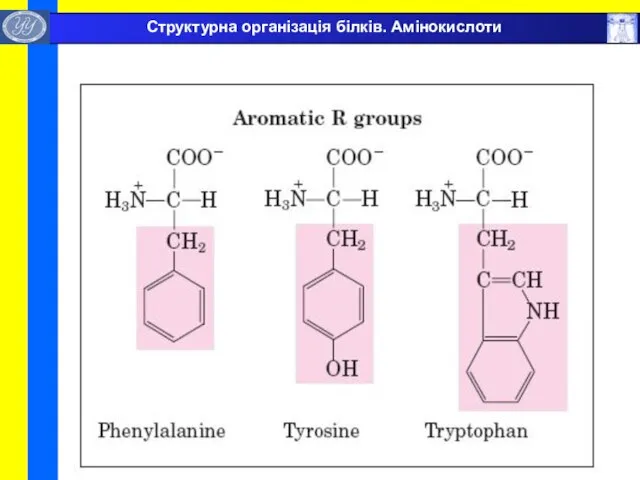
- 7. Структурна організація білків. Амінокислоти
- 8. Структурна організація білків. Амінокислоти
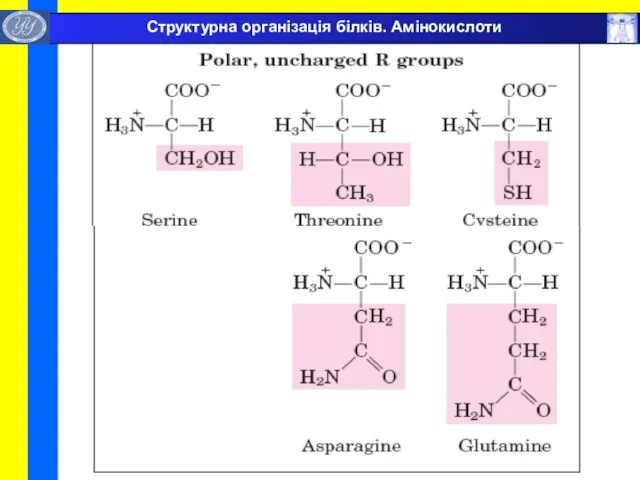
- 9. Структурна організація білків. Амінокислоти
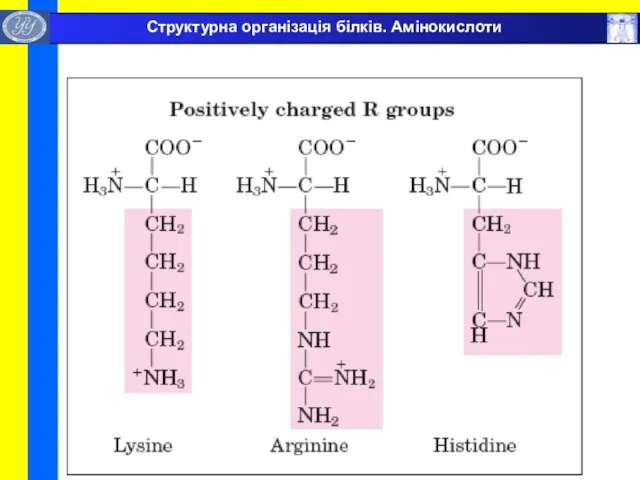
- 10. Структурна організація білків. Амінокислоти
- 11. Структурна організація білків. Амінокислоти
- 12. Структурна організація білків. Амінокислоти
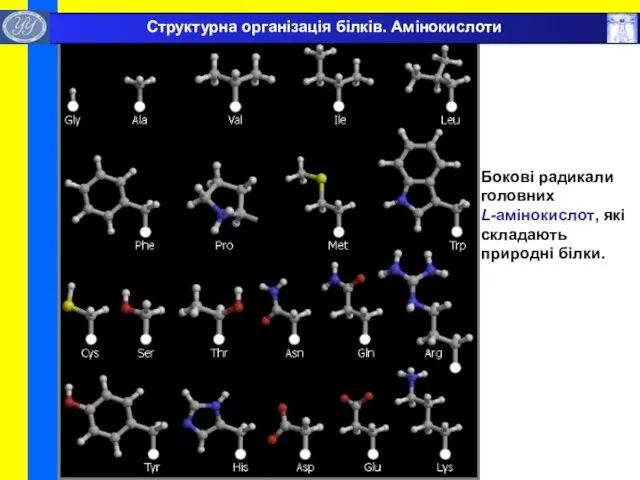
- 13. Бокові радикали головних L-амінокислот, які складають природні білки. Структурна організація білків. Амінокислоти
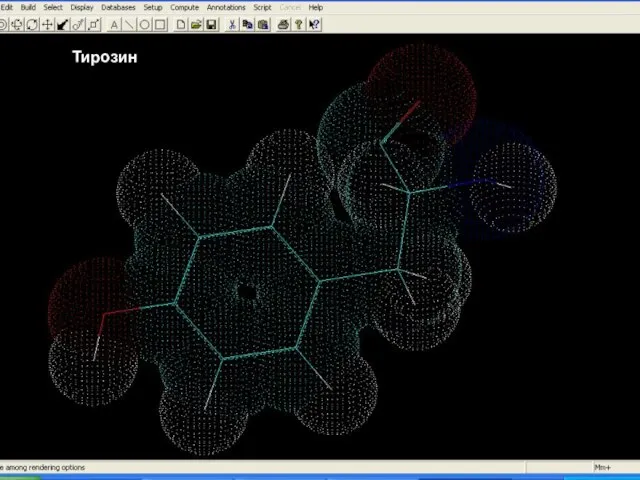
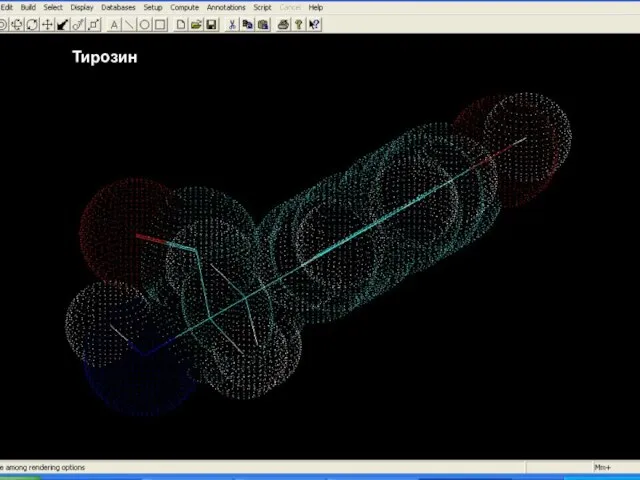
- 14. Білки – молекулярні конструкції Амінокислоти Тирозин
- 15. Білки – молекулярні конструкції Амінокислоти Тирозин
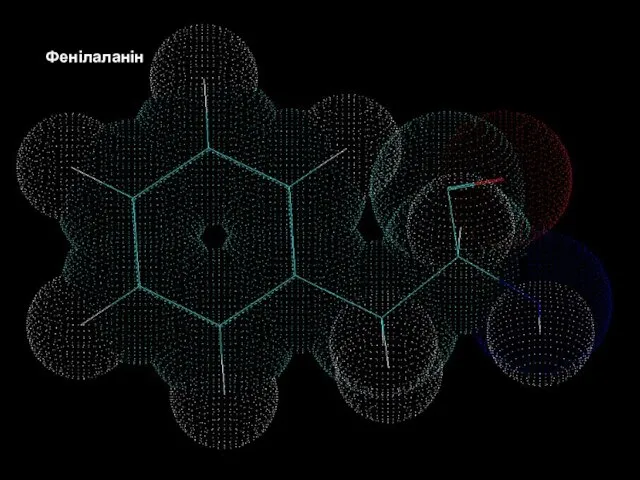
- 16. Білки – молекулярні конструкції Амінокислоти Фенілаланін
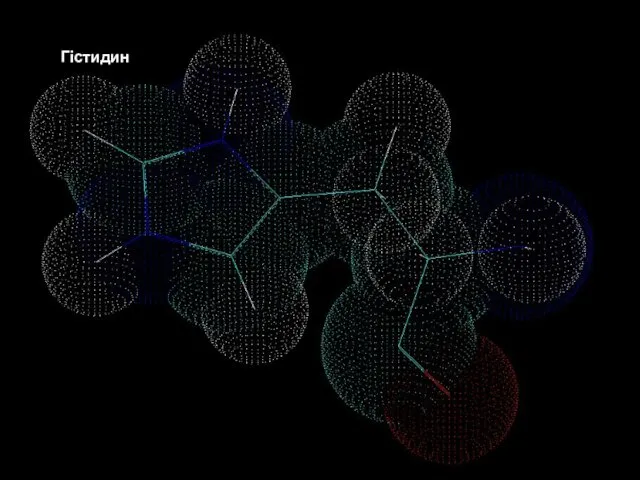
- 17. Білки – молекулярні конструкції Амінокислоти Гістидин
- 18. Білки – молекулярні конструкції Амінокислоти Валін
- 19. Білки – молекулярні конструкції Амінокислоти Аспарагінова кислота
- 20. Білки – молекулярні конструкції Амінокислоти Глутамін
- 21. Методи дослідження амінокислот Хроматографічні. Електрофоретичні. Оптичні (поглинання і флуоресценція). Маспектрометричні. Структурна організація білків. Амінокислоти
- 22. Зв'язки, які забезпечують стабілізацію просторової структури біомакромолекул: ковалентні зв'язки; електростатичні взаємодії; водневі зв'язки; Ван-дер-Ваальсові взаємодії; гідрофобні
- 23. Рівні структурної організації білків Первинна структура (1º) - амінокислотна послідовність білків; Вторинна структура (2º) – сегменти,
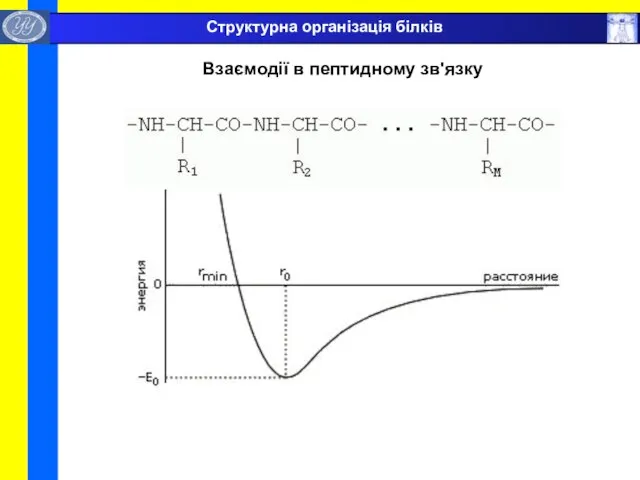
- 24. Взаємодії в пептидному зв'язку Структурна організація білків
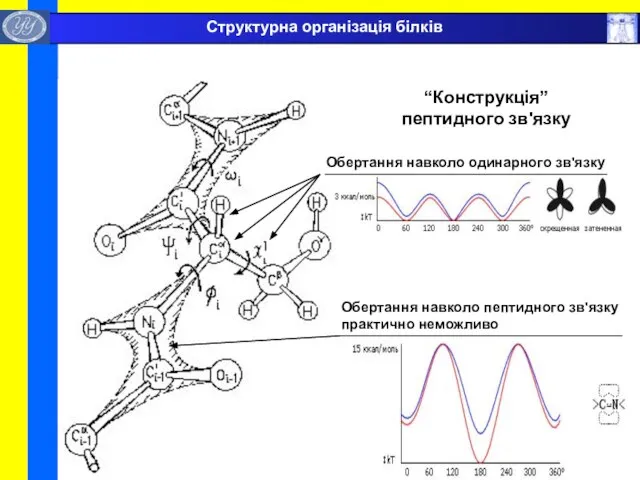
- 25. “Конструкція” пептидного зв'язку Обертання навколо одинарного зв'язку Обертання навколо пептидного зв'язку практично неможливо Структурна організація білків
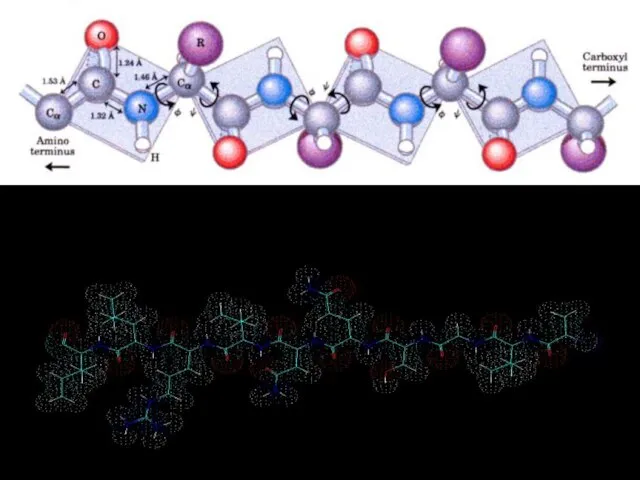
- 26. Білки – молекулярні конструкції
- 27. Вторинна структура характеризує просторову форму білкової молекули, яка найчастіше повністю або частково закручується у спіраль. Амінокислотні
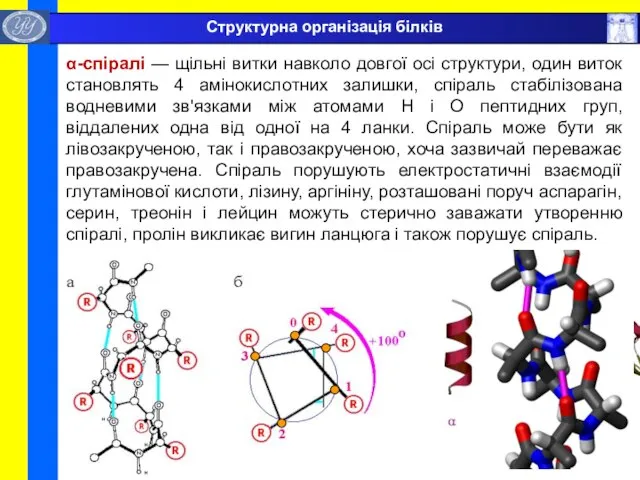
- 28. α-спіралі — щільні витки навколо довгої осі структури, один виток становлять 4 амінокислотних залишки, спіраль стабілізована
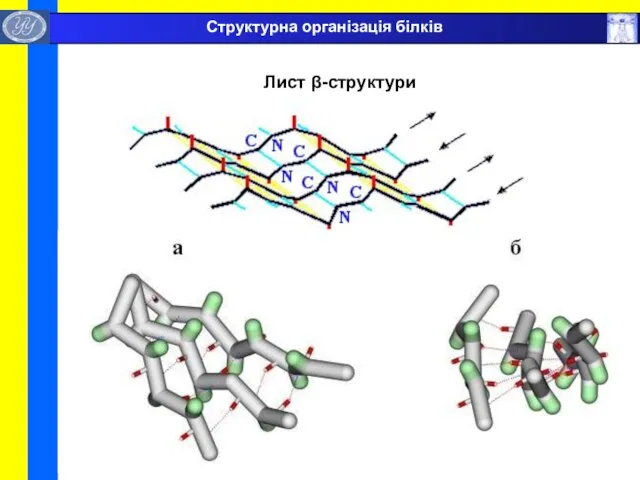
- 29. β-листи (складчасті шари) — декілька зигзагоподібних поліпептідних ланцюжків, в яких водневі зв'язки утворюються між відносно віддаленними
- 30. Лист β-структури Структурна організація білків
- 31. Приклади розташування β-тяжів
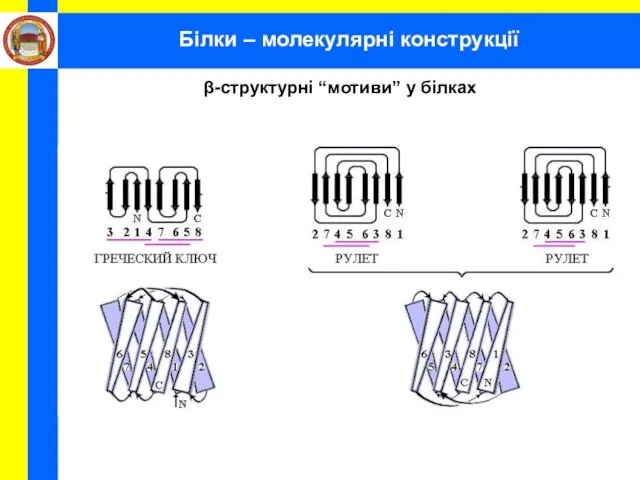
- 32. Білки – молекулярні конструкції β-структурні “мотиви” у білках
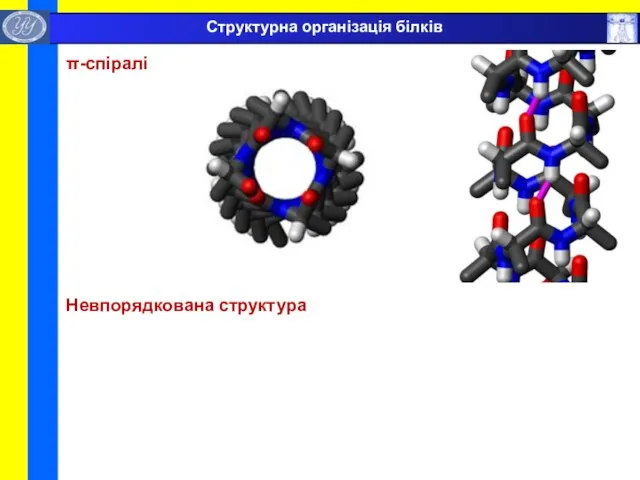
- 33. π-спіралі Невпорядкована структура Структурна організація білків
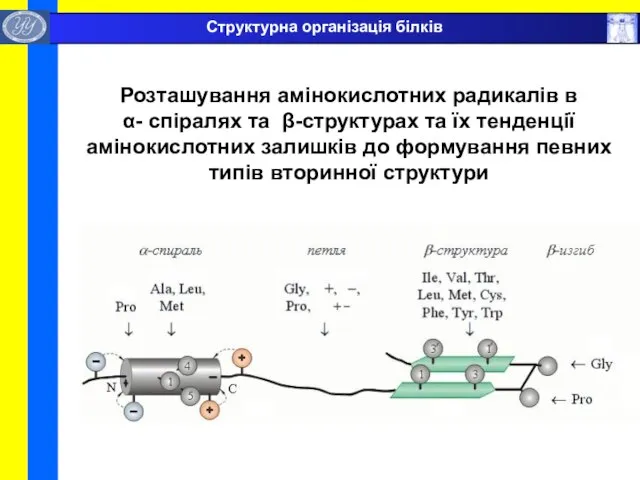
- 34. Розташування амінокислотних радикалів в α- спіралях та β-структурах та їх тенденції амінокислотних залишків до формування певних
- 35. «Надвторинна» структура Більшість білків організовані на кількох проміжних рівнях між основними елементами вторинної структури та повною
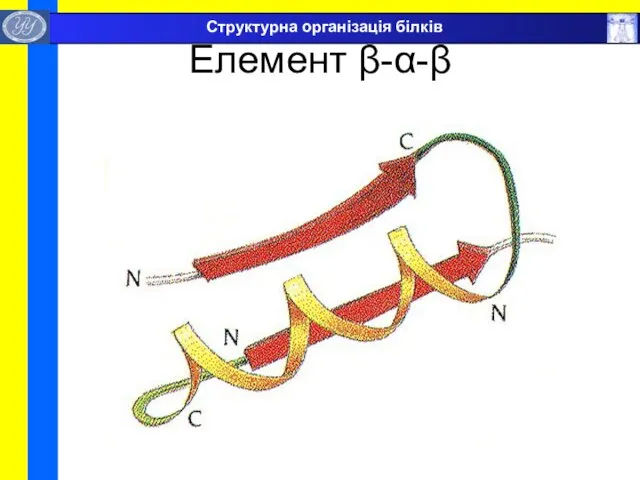
- 36. Елемент β-α-β Структурна організація білків
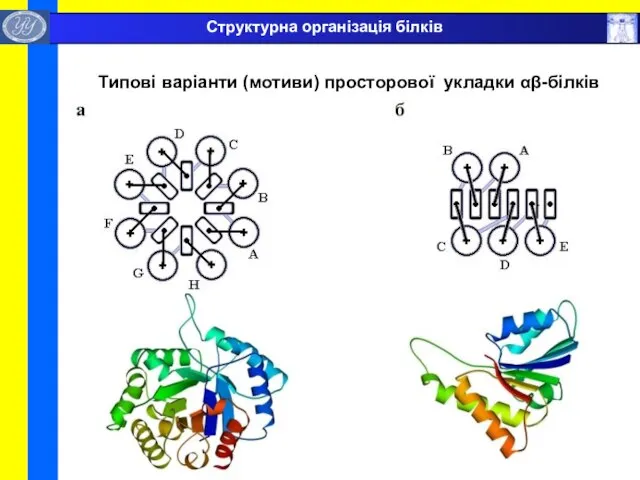
- 37. Типові варіанти (мотиви) просторової укладки αβ-білків Структурна організація білків
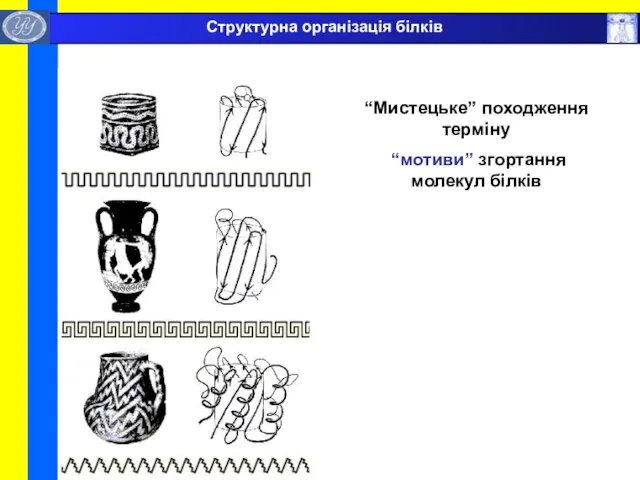
- 38. “Мистецьке” походження терміну “мотиви” згортання молекул білків Структурна організація білків
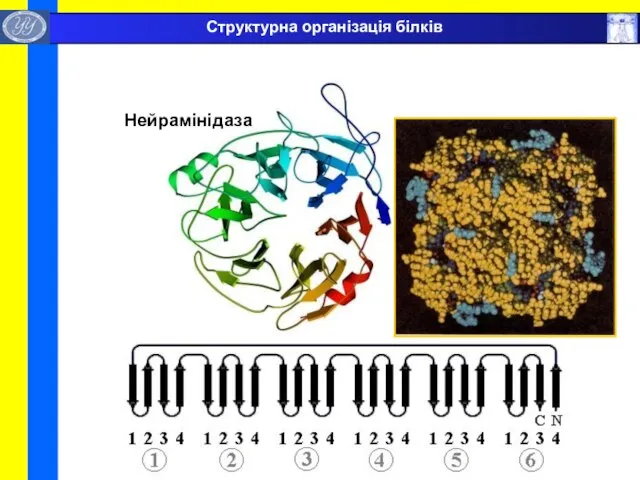
- 39. Нейрамінідаза Структурна організація білків
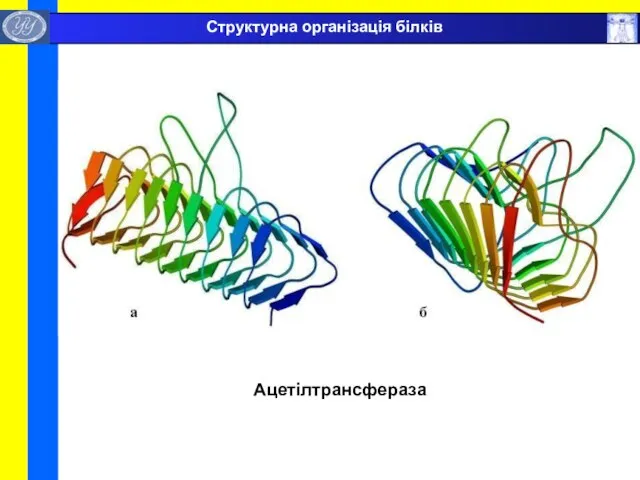
- 40. Ацетілтрансфераза Структурна організація білків
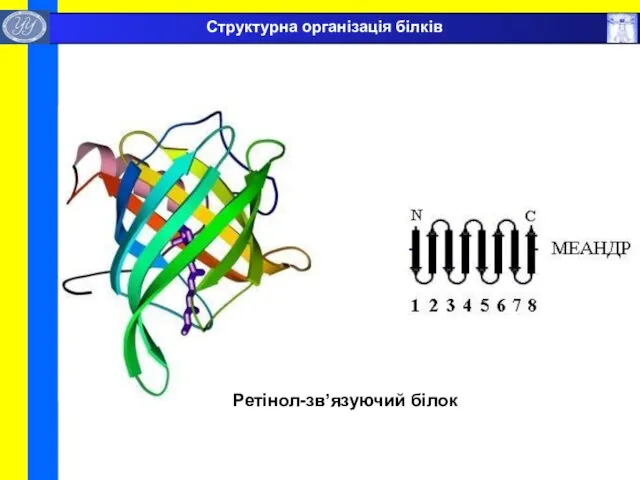
- 41. Ретінол-зв’язуючий білок Структурна організація білків
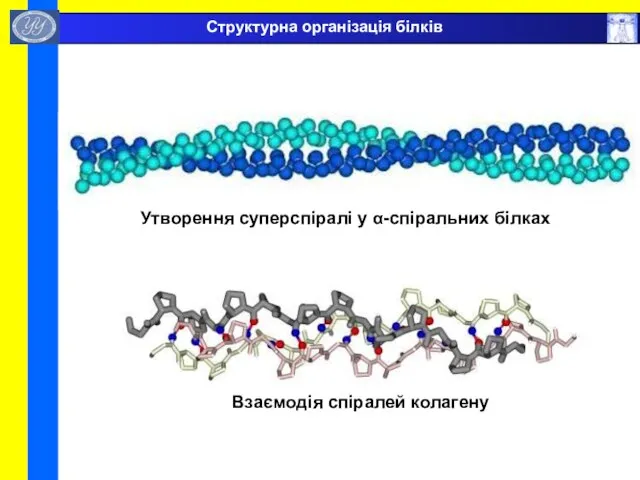
- 42. Утворення суперспіралі у α-спіральних білках Взаємодія спіралей колагену Структурна організація білків
- 43. Третинна структура Формується за рахунок далекодіючих взаємодій між амінокислотними залишками в різних ділянках поліпептидного ланцюга. Поліпептид
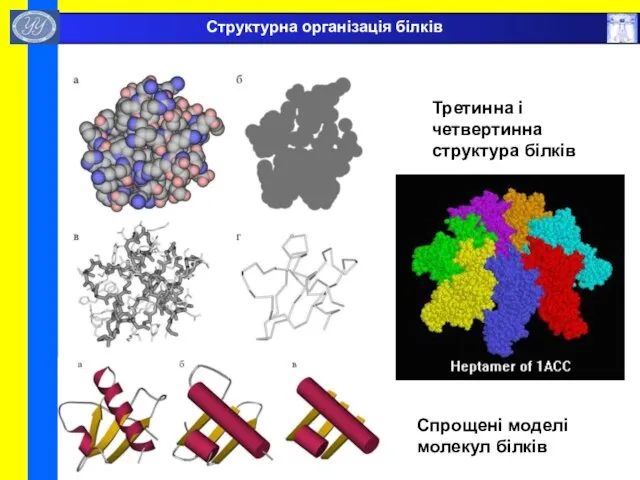
- 44. Спрощені моделі молекул білків Третинна і четвертинна структура білків Структурна організація білків
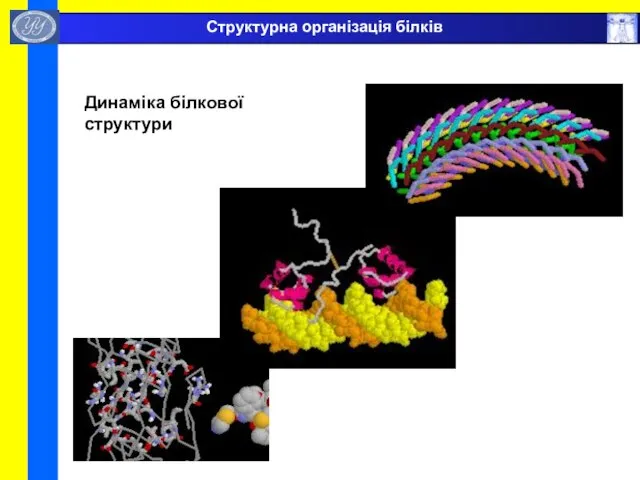
- 45. Динаміка білкової структури Структурна організація білків
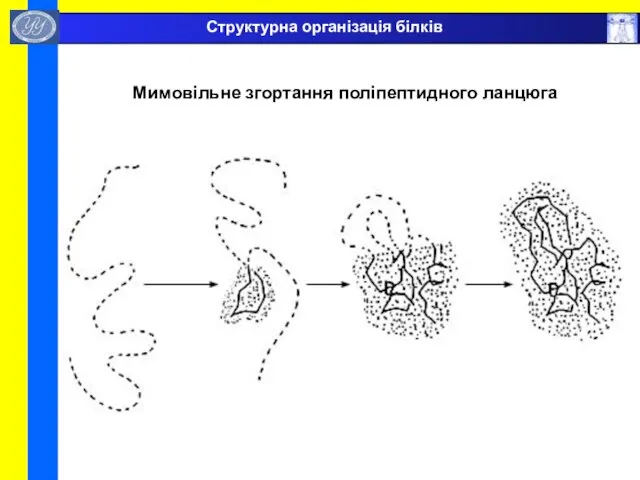
- 46. Мимовільне згортання поліпептидного ланцюга Структурна організація білків
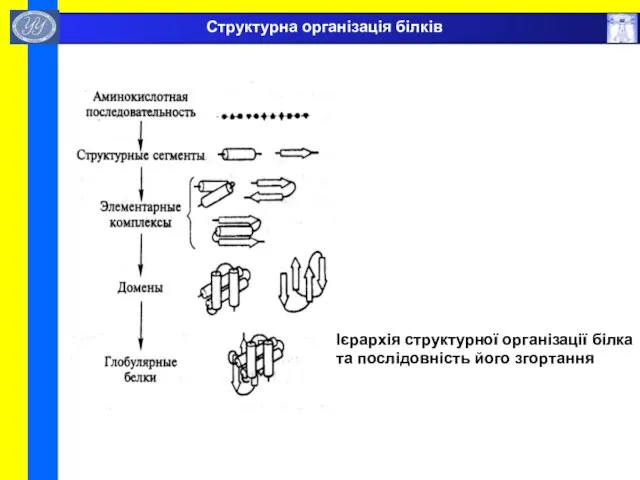
- 47. Ієрархія структурної організації білка та послідовність його згортання Структурна організація білків
- 48. Ферменти – як представники групи білків Ферменти (ензими) — органічні каталізатори білкової природи, які утворюються в
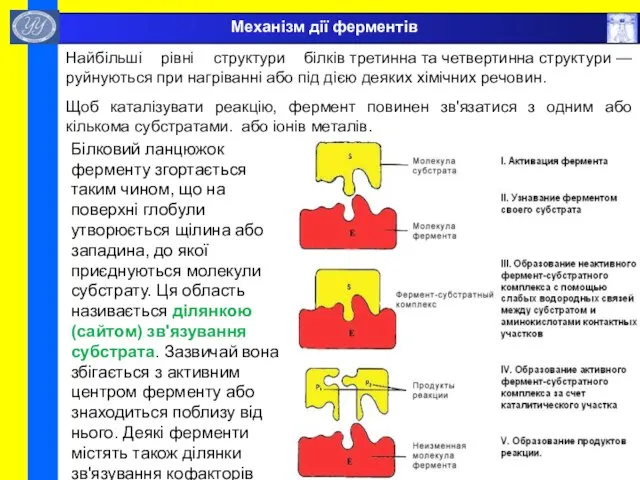
- 49. Механізм дії ферментів Найбільші рівні структури білків третинна та четвертинна структури — руйнуються при нагріванні або
- 50. Механізм дії ферментів Специфічність Ферменти зазвичай проявляють високу специфічність по відношенню до своїх субстратів. Це досягається
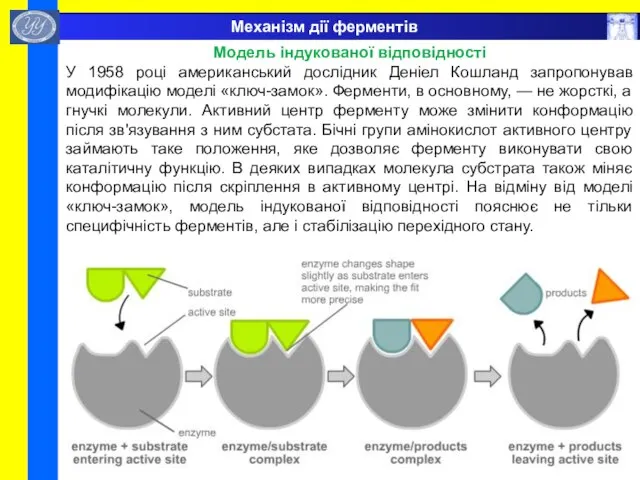
- 51. Механізм дії ферментів Модель індукованої відповідності У 1958 році американський дослідник Деніел Кошланд запропонував модифікацію моделі
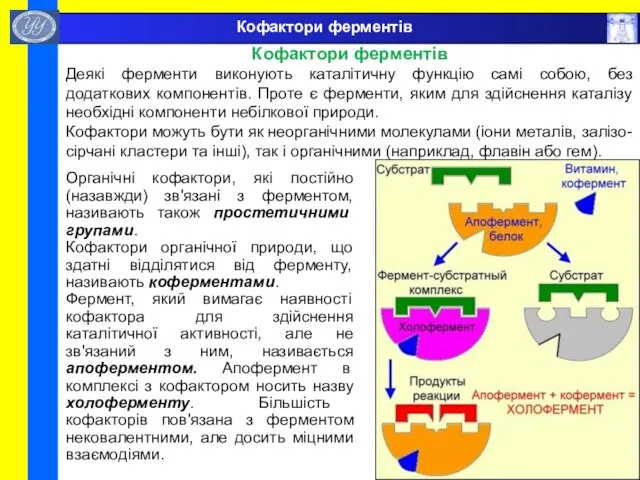
- 52. Кофактори ферментів Кофактори ферментів Деякі ферменти виконують каталітичну функцію самі собою, без додаткових компонентів. Проте є
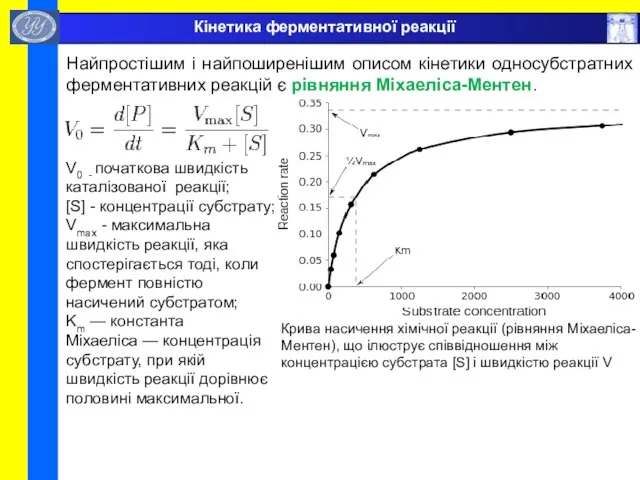
- 53. Кінетика ферментативної реакції Найпростішим і найпоширенішим описом кінетики односубстратних ферментативних реакцій є рівняння Міхаеліса-Ментен. Крива насичення
- 55. Скачать презентацию

















 Презентация на тему Государственный строй Испании
Презентация на тему Государственный строй Испании  Понятие мультимедиа.Компьютерные презентации.
Понятие мультимедиа.Компьютерные презентации. Мастерская чудес
Мастерская чудес Ростсельмаш. Поставка запасных частей для комбайнов
Ростсельмаш. Поставка запасных частей для комбайнов Генетический алгоритм и его модификация для формирования оптимального подмножества тестов
Генетический алгоритм и его модификация для формирования оптимального подмножества тестов Референсы, Екатеринбург
Референсы, Екатеринбург Конкуренция в живой природе
Конкуренция в живой природе Decision Making
Decision Making  Проектное управление в рамках РИП через организацию работы предметно-цикловой комиссии в ЧГПГТ
Проектное управление в рамках РИП через организацию работы предметно-цикловой комиссии в ЧГПГТ Генеральный директор
Генеральный директор Казочка про фею Теплинку
Казочка про фею Теплинку Мое здоровье
Мое здоровье Видеоряд для уроков в 1 классе РАЗДЕЛ 1. «МЫ И НАША КУЛЬТУРА» – 30 часов
Видеоряд для уроков в 1 классе РАЗДЕЛ 1. «МЫ И НАША КУЛЬТУРА» – 30 часов Опера «Князь Игорь». Русская эпическая опера. Ария князя Игоря
Опера «Князь Игорь». Русская эпическая опера. Ария князя Игоря Réservoirs
Réservoirs Педагогический конфликт
Педагогический конфликт Молодежная политика и специальные программы для молодежи в библиотеках Великобритании
Молодежная политика и специальные программы для молодежи в библиотеках Великобритании Государственное общеобразовательное учреждение Гимназия № 631 Приморского района Санкт-Петербурга ПРЕДСТАВЛЯЕТ на конкурс инно
Государственное общеобразовательное учреждение Гимназия № 631 Приморского района Санкт-Петербурга ПРЕДСТАВЛЯЕТ на конкурс инно Инновационные программы. Предмет «Музицирование»
Инновационные программы. Предмет «Музицирование» Траєкторія.Шлях.Переміщення
Траєкторія.Шлях.Переміщення И. А. Гончаров (1812 – 1891)
И. А. Гончаров (1812 – 1891) Руссу Кристина 2 класс школа №14
Руссу Кристина 2 класс школа №14 Пьеса «На дне »
Пьеса «На дне » ЧАСТНЫЙ БУХГАЛТЕР
ЧАСТНЫЙ БУХГАЛТЕР Проект – презентация«Город Николаевск – на – Амуре»
Проект – презентация«Город Николаевск – на – Амуре» Введение дошкольника в мир искусства
Введение дошкольника в мир искусства Психическое здоровье
Психическое здоровье ФизАрт. Клуб физического развития
ФизАрт. Клуб физического развития